Departamentul de Biochimie, Școala de Medicină a Universității Boston, 72 E. Concord Street, Boston, MA 02118, SUA
Departamentul de Biochimie, Școala de Medicină a Universității Boston, 72 E. Concord Street, Boston, MA 02118, SUA
Departamentul de Medicină, Școala de Medicină a Universității Boston, 72 E. Concord Street, Boston, MA 02118, SUA
Departamentul de Biochimie, Școala de Medicină a Universității Boston, 72 E. Concord Street, Boston, MA 02118, SUA
Departamentul de Biochimie, Școala de Medicină a Universității Boston, 72 E. Concord Street, Boston, MA 02118, SUA
Departamentul de Medicină, Școala de Medicină a Universității Boston, 72 E. Concord Street, Boston, MA 02118, SUA
Abstract
Translocarea Glut4 către membrana plasmatică a celulelor musculare grase și scheletice este mediată de vezicule receptive la insulină (IRV) specializate, a căror compoziție proteică constă în principal din izoformă transportoare de glucoză 4 (Glut4), amino peptidază receptivă la insulină (IRAP), sortilină, proteina 1 legată de receptorul lipoproteinelor (LRP1) și v - SNARE. Cum se pot găsi aceste proteine reciproc în celulă și să formeze vezicule funcționale după endocitoză din membrana plasmatică? Propunem un model conform căruia proteinele componente ale IRV sunt internalizate în sortarea endozomilor și sunt livrate compartimentului (donatorilor) IRV, reciclând endosomii și/sau trans‐Rețea Golgi (TGN), prin celugirină - vezicule de transport pozitive. Cozile citoplasmatice ale Glut4, IRAP, LRP1 și sortilină joacă un rol important de direcționare în acest proces. Odată ce aceste proteine ajung în compartimentul donator, ele interacționează între ele prin domeniile lor lumenale. Acest lucru facilitează gruparea proteinelor IRV într-un complex oligomeric, care poate fi apoi distribuit de la membranele donatorului la IRV ca o singură entitate cu ajutorul adaptorilor, cum ar fi Golgi - localizat, gamma - adaptină care conține urechi, care leagă ARF (GGA).
Reglarea nivelului de glucoză din sânge la mamifere se realizează prin translocația insulino-dependentă a transportorului de glucoză izoformă 4 (Glut4) la membrana plasmatică a grăsimilor și a celulelor musculare scheletice. Liniile multiple de dovezi independente, cum ar fi modelele de șoarece transgenic și knock-out (revizuite în 1) și studiile de rezonanță magnetică nucleară umană in vivo (revizuit în 2), demonstrează că absorbția de glucoză mediată de Glut4 reprezintă etapa limitativă a eliminării glucozei stimulată de insulină. În consecință, incapacitatea dozelor normale de insulină de a stimula translocarea Glut4, adică rezistența la insulină, poate reprezenta defectul primar în dezvoltarea diabetului zaharat de tip 2 3. Prin urmare, descifrarea etapelor mecaniciste ale reglării Glut4 va fi crucială pentru înțelegerea naturii moleculare a rezistenței la insulină și a diabetului zaharat și pentru posibilele modalități de tratament. În plus, traficul Glut4 reprezintă o paradigmă importantă pentru biologii celulari în numeroase moduri.
Rezistența la insulină în țesuturile musculare grase și scheletice poate fi cauzată de semnalizarea deficitară a insulinei, reciclarea aberantă a Glut4 sau ambele. Recent, majoritatea eforturilor de cercetare îndreptate spre înțelegerea rezistenței la insulină s-au concentrat pe potențialele defecte ale căii de semnalizare a insulinei în amonte, care constă din receptorul insulinei, substraturile sale (IRS), fosfatidilinozitol - 3 kinază (PI - 3 - kinază), PI - 3 ‐Kinază - kinază dependentă (PDK) și serină/treonin kinază, Akt 4, 5. În special, a fost observată în numeroase contexte experimentale fosforilarea contrareglatorie a IRS1 asupra reziduurilor ser/thr, care rezultă în semnalizarea tocită a insulinei, cu efectul general de a conduce mai mult la confuzie decât iluminarea mecanismelor de rezistență la insulină 6. Mai mult, aceste evenimente de fosforilare IRS din amonte nu se corelează neapărat cu scăderea absorbției de glucoză, care se poate demonstra că are loc in vitro iar la animalele transgenice in vivo într-o manieră independentă de insulină 7. Aceste descoperiri indică biologia celulară a reciclării Glut4 ca un potențial loc al anomaliilor primare legate de diabet și subliniază necesitatea descrierii multor aspecte ale traficului Glut4 care rămân necunoscute.
Deși s-au făcut pași considerabili în definirea căii de semnalizare a insulinei în amonte, acele evenimente biochimice proximale mobilizării IRV și fuziunii cu membrana plasmatică rămân neclare. Activarea Akt este esențială pentru traficul global Glut4 și, prin urmare, ținte/substraturi ale acestei proteine, cum ar fi Rab GAP (GTPase - activating protein), AS160/TBC1D4, au apărut ca jucători importanți în mobilitatea IRV (revizuită în 8). Cu toate acestea, nu este clar în ce stadiu al traficului Glut4 participă AS160/TBC1D4, deoarece eliminarea sa nu imită complet translocația Glut4 dependentă de insulină. Prin urmare, este fezabil ca AS160/TBC1D4 să nu influențeze numai translocarea IRV preformate, dar poate fi implicat și în biogeneza lor. Procesul de biogeneză 9 și formarea dependentă de diferențiere a veziculelor Glut4 10 au fost recent revizuite. În continuare, vom lua în considerare problema interesantă a modului în care celula sortează o serie de proteine de marfă IRV majore cu funcții și proprietăți biochimice foarte diferite.
Veziculele mici preformate reprezintă forma primară de stocare Glut4 în celulă
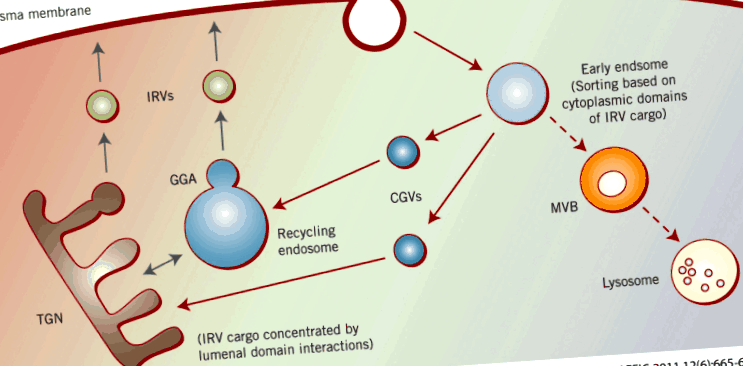
În drumul său către și de la suprafața celulei, Glut4 trece prin mai multe compartimente intracelulare distincte (Figura 1). Acestea includ endozomi timpurii, vezicule de transport intermediar și/sau endosomi de reciclare transRețeaua Golgi (TGN) și veziculele receptive la insulină (IRV) (denumite și GSV pentru veziculele de stocare a transportorului de glucoză), despre care mulți cercetători consideră că sunt ținta reglării insulinei care are ca rezultat livrarea Glut4 la membrana plasmatică.
Sortarea conținutului de proteine IRV. Pornind de la membrana plasmatică, principalele proteine de marfă IRV suferă endocitoză pe baza diverselor lor motive de internalizare (Tabelul 1). Acestea sunt transportate de la endosomi timpurii la endosomi de reciclare și/sau TGN prin vezicule de celugirină (descrise în albastru), de asemenea, pe baza acestor motive de sortare. În ultimele compartimente, încărcătura IRV este concentrată pe baza interacțiunilor din domeniul luminal și a mugurilor către IRV utilizând GGA (descris în negru).
Natura fizică a principalelor compartimente care conțin Glut4 în celulele musculare adipoase și scheletice complet diferențiate a fost demonstrată prin microscopie imunoelectronică constând în principal din vezicule mici (70-100 nm în diametru) și tubuli scurți 11; fracționarea biochimică arată că 60-75% din cantitatea totală de Glut4 este prezentă în vezicule mici (aproximativ 80–100S) care sunt ușor de detectat prin centrifugare în gradient de zaharoză și alte metode biochimice 12. Restul transportorului este prezent în membrane intracelulare mari care sedimentează rapid, care sunt susceptibile să reprezinte endozomi de reciclare și probabil structuri TGN 11 .
În celulele adipoase cultivate, majoritatea membranelor care conțin Glut4, inclusiv vezicule mici, endozomi de reciclare și TGN, sunt concentrate în regiunea perinucleară, ceea ce face dificilă disecarea naturii „căii Glut4” prin imunofluorescență convențională. În special, există dovezi incomplete și chiar controversate dacă Glut4 traficează prin reciclarea endozomilor 13, TGN 14 sau ambelor compartimente. Publicații recente demonstrează că proteinele Golgi ‘clasice’ precum p115 15 și Golgin - 160 16 sunt implicate în sortarea și traficul Glut4. Acest lucru sugerează că aparatul Golgi (inclusiv TGN) poate fi implicat mai intim în „calea Glut4” decât a fost apreciat anterior. Această idee este în concordanță cu rezultatele recente care arată că retragerea Glut4 de la endosomi la TGN poate fi un pas esențial în „calea Glut4” a miocitelor umane 17, 18 .
Dimensiunea bazinului vezicular al Glut4 este scăzută cu insulină ca. dublu concomitent cu o creștere echivalentă a conținutului de membrană plasmatică Glut4 sugerând că veziculele care conțin Glut4 se fuzionează cu membrana plasmatică. Reglarea insulinei a conținutului de Glut4 în endozomi și TGN nu a fost studiată în mod sistematic și este în mare parte necunoscută. Dovezile morfologice disponibile sugerează că insulina nu provoacă modificări majore în prezența Glut4 în „vacuole” mari și „tubuli” 19. Acest lucru, totuși, poate fi explicat prin reaprovizionarea rapidă a bazinului endosomal de Glut4 cu transportor 20 recent interiorizat. În orice caz, vezicule cu membrană mică și tubuli scurți cu un coeficient de sedimentare de cca. 80–100S par să reprezinte forma majoră de stocare Glut4 în adipocite și miocite bazale.
Procesul de biogeneză a veziculelor Glut4 mici din membranele mari donatoare poate fi reconstituit in vitro la incubarea membranelor donatoare cu ATP și citosol la 37 ° C 21, 22. Insulina stimulează formarea de vezicule Glut4 mici împreună cu declanșarea translocației veziculelor preexistente? Unele dovezi arată că insulina poate avea într-adevăr un efect pozitiv asupra formării veziculelor Glut4 20, 21, 23, 24. Cu toate acestea, în adipocitele diferențiate, este puțin probabil ca acest efect să explice creșterea masivă a conținutului de membrană plasmatică Glut4 ca răspuns la stimularea insulinei 21, sugerând că efectul major al insulinei este translocarea veziculelor preformate.
Eterogenitatea veziculelor mici Glut4
Veziculele Glut4 mici nu sunt omogene din punct de vedere structural sau funcțional, mai degrabă preparatele totale ale acestor vezicule reprezintă un amestec suprapus de cel puțin două populații veziculare care pot fi rezolvate parțial prin centrifugare în gradient. O populație de vezicule mai mici este marcată de prezența unei proteine numite celugirină, în timp ce o altă populație de vezicule mai mari nu conține această proteină 25-27. Celugirina are patru spirale transmembranare cu o funcție fiziologică încă necunoscută și este un omolog omniprezent al sinaptogirinei, un constituent major al veziculelor sinaptice 28. Celugirina este prezentă numai în populația de vezicule Glut4 care nu este recrutată la membrana plasmatică de insulină și astfel își menține permanent localizarea intracelulară. Dimpotrivă, veziculele Glut4 negative cu celugirină se translocează pe membrana plasmatică cu o eficiență practic de 100% 25-27. Deoarece veziculele celugirin pozitive și celugirin negative compartimentează cantități aproximativ egale de Glut4 25, 27, epuizarea rezervei veziculare totale a transportorului de către insulină nu depășește 50% în absența altor perturbații.
S-a sugerat că veziculele pozitive celugirină reprezintă un compartiment vezicular omniprezent 29 care transportă proteinele între endozomii precoce și reciclarea/TGN. Astfel de vezicule de transport sunt destul de abundente în diferite tipuri de celule 22, 30 și pot găzdui cantități semnificative de proteine de reciclare. Pe de altă parte, veziculele cu celugirină negativă sunt susceptibile de a reprezenta un compartiment specializat care răspunde la insulină, IRV, care a fost postulat ca fiind ținta semnalizării insulinei 31. Astfel, vom folosi termenul „IRV” atunci când vorbim în mod specific despre compartimentul care conține Glut4 vezicular care este translocat la membrana plasmatică ca răspuns la stimularea insulinei. Rezerva totală de vezicule Glut4 care include atât vezicule sensibile la insulină, cât și vezicule de natură biologică celulară va fi denumită „vezicule Glut4”.
Proteinele majore de marfă ale veziculelor Glut4 și IRV
În plus față de LRP1, IRV-urile găzduiesc o porțiune mică (aproximativ 10% din totalul bazinelor lor microsomale) din receptorii pentru transferină (TfR) și manoză-6-fosfat (M6PR), precum și o varietate de alte proteine cunoscute de reciclare a membranei 27, 35 care reprezintă componente veziculare minore al căror comportament nu a fost caracterizat pe larg. Prezența TfR și a M6PR în IRV poate explica translocația lor insulino-dependentă îndelung cunoscută la membrana plasmatică în adipocite 36 și prezența lor în IRV este explicată în secțiunea de sortare. În cele din urmă, IRV-urile pot conține mai mult de unul dintre funcțiile redundante funcționale v - SNARE 37 care sunt cunoscute de ceva timp pentru a participa la traficul Glut4 38 .
IRAP este probabil cea mai abundentă componentă IRV și este, în mare parte, dacă nu complet co-localizat cu Glut4 26. Rolul fiziologic al activității aminopeptidazei insulino-dependente în grăsime și mușchi rămâne neclar, dar prezența IRAP în IRV ar putea contribui la sensibilitatea lor la insulină prin legarea Rab GAP, TBC1D4 35, 39 și/sau ar putea funcționa în sortarea proteinelor veziculare. Aceste posibile roluri vor fi discutate în continuare mai jos.
Sortilin este un omolog al receptorului de sortare vacuolar de drojdie, Vps10p, și reprezintă un receptor de proteine multi-ligand cu o specificitate foarte largă în celulele de mamifere și are diferite funcții în sortarea și semnalizarea proteinelor de o notă specială, în afară de mușchi și grăsimi, în celulele neuronale. 40. În fostele celule, sortilina este îmbogățită în IRV și joacă un rol important în biogeneza acestui compartiment probabil prin interacțiunile proteină - proteină în domeniul său luminal [a se vedea mai jos și Ref. 41-43]. În acest fel, poate fi considerat un receptor pentru proteinele sale însoțitoare IRV, Glut4 și IRAP.
O întrebare interesantă, deși oarecum teleologică, este de ce folosește celula acest amestec funcțional eterogen de proteine pentru a construi mașina de transport a glucozei care răspunde la insulină? O speculație este următoarea. Domeniul lumenal al sortilinei este foarte omolog cu cel al receptorului de sortare a drojdiei, Vps10p, care este responsabil pentru traficul intracelular al aminopeptidazei Y, carboxipeptidazelor Y și proteinazei A din Saccharomyces cerevisiae 44, 45. Astfel, nu poate fi surprinzător faptul că IRAP, o aminopeptidază, co-localizează cu sortilina în aceleași vezicule din celulele de mamifere, de asemenea. Mai mult, este posibil ca, în cursul evoluției, Glut4 să fi dezvoltat o afinitate față de receptorul de sortare preexistent, sortilina și, astfel, să fi deturnat un tip antic de purtător vezicular folosit pentru traficul intracelular de complexe Vps10p/peptidază în drojdie. Cu toate acestea, alte ipoteze sunt destul de posibile.
Reciclarea proteinelor IRV din celulă
| IRAP | 71-ESSAKLLGM-79-Tm | 64 - DEDEEDYE - 71 - Tm | |
| 47-EPRGSRLLVR-57-Tm | |||
| LRP1 | Tm-4470-NPTDa‐4473 | Tm - 4483 - DVGGLLDA-4490 | |
| Tm - 4504 - VANDa‐4507 | |||
| Sortilin | Tm - 820 - DEDLLE - 825 | Palmitoylation | |
| Glut4 | 5‐FQQI - 9 - Tm | Tm - 485 - RTPSLLEQ - 492 | Tm - 498 - TELEYL - 505 |
| Tm - 500 - LxxLxPDExD - 509 | |||
| Ubiquitin |
- Secvențele de aminoacizi de mai sus, cu excepția ultimei coloane, toate se leagă de proteinele adaptatoare ale clatrinei (AP), și anume AP - 1-3, GGA și ACAP1 46. Aceste secvențe au fost implicate în endocitoza de la suprafața celulei, precum și în alte etape de înmugurire a veziculelor intracelulare, dar secvența de legare DXXLL GGA, unică pentru sortilină, este considerată a fi exclusivă pentru TGN pentru sortarea endozomilor. Astfel, propunem, așa cum este subliniat în text și în Figura 1, că formarea IRV-urilor este mediată de GGA și sortilină, aceasta din urmă într-un complex cu încărcătura IRV rămasă.
În același mod, coada citoplasmatică a IRAP vizează această proteină în primul rând către membranele donatoare de IRV, dar nu și către IRV 52. Totuși, coada citoplasmatică a IRAP 53, precum și capătul C-terminal al Glut4 51 pot conferi un anumit grad de reacție la insulină a moleculelor raportoare, care, totuși, este mai mică decât capacitatea de răspuns la insulină a Glut4 de tip sălbatic și a IRAP 51, 52, 54. O explicație a acestui fenomen este că, odată ce o proteină intră în compartimentul (compartimentele) donatorului IRV, aceasta poate fi capturată de vezicule în devenire, de exemplu, prin acțiunea de masă 10. Acesta ar fi cazul proteinelor precum TfR, M6PR, sintaxinele 6/16 și Vti1a. Aceste proteine demonstrează o co-localizare semnificativă cu Glut4 la nivelul microscopiei cu lumină, dar nu sunt clasificate în mod activ în IRV și dobândesc mai puțină reacție la insulină decât proteinele majore de încărcare IRV. Majoritatea proteinelor de membrană, totuși, nu sunt reținute în compartimentul donator IRV din cauza lipsei informațiilor de țintire în cozile lor citoplasmatice și, în mod natural, au puține șanse de intrare în IRV.
Studiile de direcționare a sortilinei au arătat, de asemenea, că proteina raportor alcătuită din coada citoplasmatică a sortilinei și EGFP nu este direcționată către IRV și nu are o reacție la insulină 55. Dimpotrivă, domeniul Vps10p luminal marcat al sortilinei demonstrează co - localizarea parțială cu Glut4 și este, într - o oarecare măsură, vizat IRV - urilor în adipocitele 3T3 - L1. Interesant este că traficul intracelular de sortilină necesită palmitoilare 56, deși nu este încă clar dacă și în ce măsură este necesară palmitoilarea pentru biogeneza IRV.
Relația IRV-urilor cu compartimente similare, stimul - receptive în alte tipuri de celule
Nu există nicio îndoială că mai multe tipuri de purtători veziculari coexistă în celulele grase și musculare scheletice. Cu toate acestea, sensibilitatea ridicată la insulină este proprietatea unică a IRV-urilor care le diferențiază de alte vezicule intracelulare. Așa cum s-a menționat mai sus, explicația reacției la insulină a IRV-urilor ar trebui să vină în cele din urmă la specificul conținutului lor de proteine. Chiar și în cazul probabil în care capacitatea de reacție la insulină este asigurată IRV de către o proteină (proteine) de membrană periferică, această componentă (putative) trebuie să recunoască cumva unul sau mai mulți dintre constituenții de bază ai IRV, cum ar fi Glut4, IRAP, sortilin sau LRP1. Experimentele viitoare ar trebui să identifice proteinele IRV care sunt responsabile pentru capacitatea lor de reacție la insulină și să lege aceste vezicule de calea de semnalizare a insulinei.
Mulțumiri
Această lucrare a fost susținută de Institutele Naționale de Sănătate, DK30425 la PFP și DK52057 la KVK.
- Căpșună sălbatică; Scrub pentru corp cu ceai verde; Magazin online de wellness siberian
- Vor ajuta înlocuitorii zahărului să slăbească
- Urmărește Episodul Extrem de Pierdere în Greutate Online Sezonul 1 (2011) Ghid TV
- Vița de vie; - Ianuarie 2011 Chino a intervievat DeftonesWorld - Totul despre Deftones
- Ulei de terebentină MAK Value Documentation, 2017 - Hartwig - Lucrări de referință majore - Wiley Online