Departamentul de Bioenergetică, A.N. Institutul de biologie fizico-chimică Belozersky, Universitatea de Stat din Moscova, Moscova 119899, Rusia
Departamentul de Bioenergetică, A.N. Institutul de biologie fizico-chimică Belozersky, Universitatea de Stat din Moscova, Moscova 119899, Rusia
Autorul corespunzator. Fax: (7) (95) 939 03 38 sau (7) (95) 939 31 81. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Departamentul de Bioenergetică, A.N. Institutul de biologie fizico-chimică Belozersky, Universitatea de Stat din Moscova, Moscova 119899, Rusia
Departamentul de Bioenergetică, A.N. Institutul de biologie fizico-chimică Belozersky, Universitatea de Stat din Moscova, Moscova 119899, Rusia
Departamentul de Bioenergetică, A.N. Institutul de biologie fizico-chimică Belozersky, Universitatea de Stat din Moscova, Moscova 119899, Rusia
Autorul corespunzator. Fax: (7) (95) 939 03 38 sau (7) (95) 939 31 81. E-mail: [email protected] Căutați mai multe lucrări ale acestui autor
Departamentul de Bioenergetică, A.N. Institutul de biologie fizico-chimică Belozersky, Universitatea de Stat din Moscova, Moscova 119899, Rusia
Abstract
Formarea H2O2 a fost studiată în mitocondriile inimii șobolanilor, pretratate cu H2O2 și aminotriazol pentru a reduce capacitatea lor antioxidantă. Se arată că viteza de formare a H2O2 de către mitocondriile care oxidează succinat de 6 mM este inhibată de un decuplator protonofor, ADP și fosfat, malonat, rotenonă și mixotiazol și este stimulată de antimicina A. Efectul ADP este abolit de carboxiatractilat și oligomicină. Adăugarea decuplatorului după rotenonă induce o inhibare suplimentară a producției de H2O2. Inhibarea formării H2O2 prin decuplare, malonat și ADP + Pi se arată a fi proporțională cu scăderea ΔΨ de către acești compuși. Se găsește o valoare threshold prag, peste care are loc o creștere foarte puternică a producției de H2O2. Acest prag depășește ușor nivelul stării 3 ΔΨ. Datele obținute sunt în concordanță cu conceptul [Skulachev, VP, Q. Rev. Biofizi. 29 (1996), 169-202] că o forță motrice ridicată a protonului în starea 4 este potențial periculoasă pentru celulă datorită creșterii probabilității de formare a superoxidului.
1. Introducere
În 1973, Boveris și Chance [1] au descoperit că un decuplator de fosforilare oxidativă (CCCP) sau ADP + Pi a inhibat formarea H2O2 prin mitocondriile oxidând succinat și glutamat. Mai târziu, Liu și Huang [2, 3] au raportat o dependență foarte abruptă a producției de O −⋅ 2 și H2O2 de către mitocondrii la nivelul ΔΨ de pe membrana mitocondrială. În experimentul lor, ΔΨ a fost redus prin adăugarea de concentrații diferite de malonat, ceea ce scade rata de respirație a stării 4. Prin urmare, s-ar putea sugera că formarea speciilor reactive de oxigen (ROS) este mai degrabă o funcție a transportului de electroni din lanțul respirator decât de (.
Grupul nostru a propus [4-6] ca activarea producției de ROS în starea 4, atunci când potențialul protonic este ridicat și rata respirației este limitată de lipsa ADP, se datorează faptului că unii tranzitori ai transportului de electroni ai lanțului respirator, capabili să reducă O2 până la O −⋅ 2, cum ar fi CoQH ⋅, devin de lungă durată. S-a presupus că mitocondriile sunt echipate cu un mecanism special („decuplare ușoară”) care împiedică potențialul protonic să fie prea mare.
În această lucrare, investigăm din nou problema relațiilor mitocondriale ROS - potențial protonic. S-a constatat că orice scădere a stării 4 ΔΨ a dus la o puternică inhibare a formării H2O2 de către mitocondrii, indiferent dacă s-au adăugat activatori (decuplator sau ADP + Pi) sau inhibitori (malonat) ai transportului de electroni pentru a determina o scădere a ΔΨ. S-a găsit o valoare prag threshold necesară pentru creșterea generației de H2O2.
2. Materiale și metode
Mitocondriile au fost izolate din mușchiul inimii șobolanilor. Mușchii răciți, purificați de grăsime și tendoane, au fost tocate și trecute printr-o presă din oțel inoxidabil cu găuri cu diametrul de aproximativ 1 mm. Țesutul a fost apoi omogenizat timp de 3 minute cu un pistil de teflon într-un omogenizator de sticlă (Pyrex), raportul țesut: amestec de izolare fiind de 1: 8. După prima centrifugare (10 min, 700 ×g), supernatantul a fost decantat și filtrat prin tifon, apoi centrifugat (10 min, 16.000 ×g). Sedimentul a fost suspendat în amestec de izolare de 1 ml (250 mM zaharoză, 10 mM MOPS, 1 mM EDTA, pH 7,4) suplimentat cu BSA (3 mg/ml). Apoi amestecul a fost centrifugat încă o dată și spălat cu mediul de izolare fără BSA (10 min, 16 000 ×g). Sedimentul mitocondrial final a fost suspendat în amestecul de izolare (70-90 mg proteină/ml) și depozitat pe gheață.
În toate experimentele prezentate în figuri, procedura de mai sus a fost completată cu tratamentul mitocondriilor cu 2 mM H2O2 și 7 mM aminotriazol care au fost adăugați la supernatant înainte de a doua centrifugare.
Consumul de oxigen a fost înregistrat cu un electrod de oxigen de tip Clark și un polarograf Rank Brothers.
Nivelul ΔΨ a fost estimat utilizând safranina O. Raportul dintre colorant (nmol) și proteină mitocondrială (mg) a fost de 20: 1. Trebuie remarcat faptul că s-a demonstrat că răspunsul safraninei O depinde liniar de ΔΨ în regiunea 50-170 mV [7-9] .
Generarea de H2O2 a fost măsurată prin metoda scopoletin/peroxidază de hrean [10]. Răspunsul fluorescenței Scopoletin a fost calibrat cu glucoză/glucoză oxidază [11] și prin adăugarea unor cantități cunoscute de H2O2. În Fig. 3 și 4, ratele de producere a peroxidului de hidrogen sunt exprimate ca procent din rata obținută în mitocondriile de stare 4. Această rată a fost de 0,14 ± 0,04 nmol H2O2/min/mg proteină.
Oligomicina, antimicina A, SF6847 și rotenona au fost dizolvate în etanol de două ori distilat. Toți reactivii au fost testați mai întâi pentru a evita interferențele cu testul scopoletin/peroxidază.
EDTA, EGTA, rotenonă și scopoletin au fost de la Serva; ADP, oligomicină, MOPS, BSA fără acizi grași, catalază, antimicină A și aminotriazol au fost de la Sigma; 30% H2O2 a fost de la Merck.
3. Rezultate
În literatura de specialitate nu există un consens cu privire la capacitatea mitocondriilor de a produce cantități măsurabile de ROS în starea 4. Unii autori descriu o astfel de producție [1, 10-12], alții nu reușesc să facă acest lucru [13] sau au reușit în condiții speciale ( de exemplu, numai în cazul în care s-a utilizat o concentrație mare de succinat [14]).
În mâinile noastre, rata producției de H2O2 în starea 4 a fost neglijabilă, dar a crescut în timpul depozitării mitocondriilor izolate. S-a sugerat că o astfel de creștere se datorează epuizării antioxidanților mitocondriali endogeni (de exemplu glutation redus). Pentru a stimula acest proces, am modificat procedura de izolare a mitocondriilor pentru a include un tratament scurt H2O2 în etapa de spălare a mitocondriilor cu soluția de BSA la rece. Amestecul de spălare a fost suplimentat cu 2 mM H2O2 și 7 mM aminotriazol, inhibitorul catalazei. Această modificare a dat mitocondriilor care produc întotdeauna H2O2 la o viteză măsurabilă atunci când oxidează succinat de 6 mM în starea 4. Mitocondriile tratate cu H2O2 prezintă o stimulare de 3,5–4 ori a respirației stării 4 prin decuplări.
FIG. 1 prezintă efectele decuplărilor și inhibitorilor de respirație asupra producției de H2O2 de către mitocondriile inimii de șobolan pretratate cu H2O2 și aminotriazol. Se vede (Fig. 1, curba superioară) că o concentrație foarte scăzută de decuplare (1 × 10 −9 M SF6847) inhibă puternic producerea stării 4 H2O2. Acest efect pare să se datoreze activității de decuplare SF6847, mai degrabă decât altor efecte posibile ale acestui compus, deoarece 6 - cetocholestanol, un recuplator specific pentru SF6847 și derivați de carbonilcianură fenilhidrazonă [15, 16], a provocat o activare tranzitorie a generației H2O2 inhibată de SF6847. Adiția ulterioară a antimicinei A stimulat puternic producția de H2O2, acest fapt confirmând observația inițială a lui Boveris și Chance [1] .
Hansford și colegii săi [14] au raportat că producția de ROS de către mitocondriile de stat 4 în prezența unei concentrații mari de succinat este oprită de rotenonă. Ei au presupus că NADH - CoQ reductaza este responsabilă pentru toată formarea ROS de către lanțul respirator. Am constatat (Fig. 1, curba inferioară) că rotenona este cu adevărat inhibitoare pentru producția de H2O2 prin oxidarea succinatului de stat 4, dar o rată măsurabilă (aproximativ 20%) de formare a H2O2 este încă observată după adăugarea unei concentrații saturate de rotenonă. După rotenonă, adăugările de SF6847 și antimicină A au fost inhibitori și, respectiv, stimulatori. În conformitate cu unele observații anterioare (pentru revizuire, a se vedea [17]), mixotiazolul adăugat după antimicina A a inhibat puternic producția de H2O2.
Tranziția stării 4 - starea 3 a inhibat, de asemenea, generarea de H2O2 prin mitocondriile cardiace. FIG. 2 arată că adăugarea de Pi și ADP a eliminat aproape complet producția de H2O2. Inhibitorii ATP sintazei (oligomicină) sau ai ADP/ATP translocazei (carboxiatratactilat) au împiedicat efectul ADP.
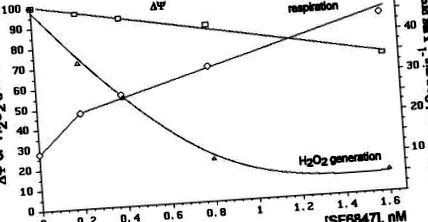
Efectele diferitelor concentrații de SF6847 asupra respirației mitocondriale, nivelul ΔΨ și rata de generare a H2O2 sunt comparate în Fig. 3. Se vede că formarea H2O2 este cel mai sensibil parametru. De exemplu, 8 × 10 −10 M SF6847 a provocat o scădere mică a potențialului membranei (aproximativ 13%), o creștere de 2,2 ori a ratei respirației și o inhibare de aproximativ 80% a producției de H2O2.
O dependență foarte abruptă a formării H2O2 de ΔΨ este ilustrată în Fig. 4. Nivelul ΔΨ a fost variat prin adăugarea de ADP și Pi sau diverse concentrații de SF6847 sau malonat.
4. Discutie
Nu este surprinzător faptul că unele condiții speciale, cum ar fi H2O2 și pretratarea aminotriazolului și concentrația mare de succinat, sunt necesare pentru a obține generarea de H2O2 măsurabilă de către mitocondrii în starea 4; în caz contrar, celula ar fi otrăvită de ROS în orice caz, atunci când ADP a fost epuizată. O astfel de epuizare apare destul de des, de ex. în mușchi sub tranziția activitate - repaus. Acesta este motivul pentru care am postulat [4-6] existența în mitocondrii a unui mecanism (numit „decuplare ușoară”) care face imposibilă menținerea potențialului protonic la un nivel esențial mai mare decât valoarea pragului critică pentru formarea rapidă a ROS (Fig. 4 ). Mecanismul în cauză a fost presupus a fi sub control tiroidian fiind legat de rezistența non-ohmică a membranei mitocondriale [5, 6] .
Non-ohmicitatea membranei mitocondriale interioare (creșterea puternică a conductanței H + la niveluri potențiale protonice ridicate) a fost sugerată a fi prima linie de apărare antioxidantă a celulei eucariote aerobe. Nu reușește să salveze celula, de ex. când lanțul respirator este inhibat de antimicina A sau (în cazul substraturilor legate de NAD) de rotenonă. O astfel de inhibiție este cauzată de o gamă destul de largă de xenobiotice hidrofobe.
Pe de altă parte, generarea de H2O2 indusă de antimicina A este puternic inhibată de mixotiazol ([17] și de această lucrare) care previne oxidarea CoQH2 la CoQH ⋅ în ciclul Q. Același efect este cauzat de cianură [19] și extracția citocromului c ([17] și Simonyan, Skulachev și Starkov, în pregătire). Mai mult, citocrom intermembranar c poate (i) organiza o ocolire a etapelor producătoare de superoxid ale lanțului respirator prin intermediul NADH - citocrom b 5 reductază și citocrom b 5 în unele țesuturi și (ii) oxidează O −⋅ 2 la O2, prevenind formarea H2O2.
Recent s-a raportat că eliberarea citocromului mitocondrial c este un fenomen fiziologic implicat în apoptoză [20-24]. Pe de altă parte, am sugerat că apoptoza indusă de ROS, un mecanism de purificare a unui țesut din celulele producătoare de ROS, reprezintă ultima linie de apărare antioxidantă a organismelor [4-6]. Astfel, următorul lanț de evenimente poate fi postulat pentru a fi implicat în apărarea antioxigenului: (i) decuplare ușoară, (ii) eliberare de citocrom c, (iii) citocrom c‐Apoptoza mediatizată.
Mulțumiri
Cercetarea descrisă aici a fost posibilă parțial prin grantul RFBR 95-04-12799.
- Efectele pe termen lung ale lipidelor bogate și ale alimentației cu conținut ridicat de energie asupra lipidelor serice, a compoziției acizilor grași din creier,
- Harvey Diamond De la viață ridicată până la vârf - Știri - Sarasota Herald-Tribune - Sarasota, FL
- Cum sunt definite dietele normale, bogate sau cu conținut scăzut de proteine de British Journal of Nutrition Cambridge Core
- Cafea în interiorul naturalului natural care străbate America - piatră de rulare
- In Vivo Efectul hipocolesterolemiant al extractului de apă de orez de drojdie roșie fermentată MARDI în cantități mari