1 Institutul Materia Medica, Academia Chineză de Științe Medicale și Beijing Union Medical College, Beijing, PR China
2 Spitalul pentru femei și copii, Universitatea Qingdao, Qingdao, PR China
* Autor corespondent: Chang Liu
Institutul Materia Medica, chineză
Academia de Științe Medicale și Beijing
Union Medical College, Beijing, PR China.
Tel: 86-18553263607
E-mail: [e-mail protejat]
Data primirii: 03 mai 2017; Data acceptată: 16 mai 2017; Data publicării: 23 mai 2017
Citare: Liu C, Jin H, Yu B și colab. Un studiu de toxicitate orală cu doză repetată de 90 de zile a clorhidratului de Yonkenafil la câinii Beagle. J Științe biomedicale. 2017, 6: 3. doi: 10.4172/2254-609X.100067
Abstract
Clorhidratul de Yonkenafil, un nou inhibitor sintetic al fosfodiesterazei de tip 5, este un medicament promițător pentru tratamentul disfuncției erectile. Toxicitatea cu doze repetate de clorhidrat de yonkenafil a fost evaluată la câinii beagle masculi și femele. Douăzeci și patru de câini au fost repartizați aleatoriu în patru grupuri și li s-a administrat clorhidrat de yonkenafil pe cale orală la doze de 0, 7, 30 sau 120 mg/kg/zi timp de 90 de zile, urmată de o perioadă de recuperare de 28 de zile. În timpul perioadei de testare, au fost examinate semnele clinice, mortalitatea, greutatea corporală, consumul de alimente, oftalmoscopia, electrocardiografia, hematologia, biochimia serică, analiza urinei, greutățile organelor, rezultatele brute și histopatologia. Nu au existat modificări anormale în observațiile clinice, cu excepția faptului că a fost observată intoleranță gastro-intestinală în grupul de 120 mg/kg/zi. Examinările de laborator și histopatologice au relevat toxicitatea clorhidratului de unkenafil pentru diferite organe, inclusiv glanda tiroidă, ficatul, prostata, uterul și sânul; la sfârșitul perioadei de recuperare, această pagubă a fost rezolvată. Nivelul clorhidratului de yonkenafil care nu a dus la efecte adverse observabile la câinii beagle a fost de 7 mg/kg/zi.
Cuvinte cheie
Clorhidrat de Yonkenafil; Disfuncție erectilă; Toxicitate; Semne clinice
Introducere
Conform definiției Conferinței Institutelor Naționale de Dezvoltare a Consensului în Sănătate privind impotența, disfuncția erectilă (DE), care va afecta viața a aproximativ 300 de milioane de bărbați în întreaga lume până în anul 2025, este incapacitatea de a realiza sau menține o erecție suficientă pentru satisfacție. performanță sexuală [1,2]. Farmacoterapia este în prezent principalul tratament pentru ED. Conform sugestiei ghidului Asociației Urologice Americane (AUA) privind ED, tratamentul de primă linie al ED ar trebui să fie inhibitori ai fosfodiesterazei de tip 5 (PDE5), care includ sildenafil, tadalafil și vardenafil [3]. Tratamentul ED cu inhibitori PDE5 este în general bine tolerat, deși au fost raportate unele reacții adverse, cum ar fi cefaleea, înroșirea feței, dispepsie, congestie nazală și tulburări vizuale neobișnuite [4,5]. Inhibitorii PDE5 sunt similari din punct de vedere structural cu cGMP și concurează cu cGMP la locul catalitic al PDE5. Inhibarea PDE5 în corpul cavernos uman crește nivelurile de cGMP intracelulare în celulele trabeculare ale mușchiului neted pentru a obține relaxarea și creșterea fluxului sanguin către penis [6-9]. Studii recente au arătat că inhibitorii PDE5 au efecte terapeutice remarcabile asupra multor alte boli, cum ar fi hiperplazia benignă de prostată, hipertensiunea pulmonară și boala Alzheimer [10-12].
Odată cu succesul pe scară largă și acceptarea acestor agenți, s-a generat un interes major în potențialul inhibitorilor PDE5. Mai mulți inhibitori PDE5 noi, cum ar fi avanafil, udenafil, SLx-2101 și mirodenafil, sunt candidați pentru a intra pe piață în următorii ani [13]. Clorhidratul de Yonkenafil, un nou inhibitor PDE5 sintetic și analog al sildenafilului, este un medicament promițător pentru tratamentul ED. Yonkenafilul (IC50 = 2,0 nM) este farmacologic mai activ decât sildenafilul (IC50 = 4,5 nM) și are mai puține efecte secundare gastrointestinale [14]. Cercetările anterioare au demonstrat, de asemenea, că yonkenafilul poate reduce eficient infarctul cerebral, deficitele neurologice, edemul și afectarea neuronilor din zona infarctului [14,15] și poate suprima activarea microglială pentru a promova supraviețuirea neuronală [16,17]. Yonkenafil a fost trimis la China Food Drug Administration (CFDA) pentru aprobare ca nou medicament și este în prezent în curs de studii clinice în China [18].
Cu toate acestea, informațiile privind toxicitatea yonkenafilului sunt foarte limitate. Este necesară înțelegerea profilului de siguranță al yonkenafilului pentru a anticipa pe deplin potențialul său terapeutic. Acest studiu a fost conceput pentru a evalua toxicitatea în doze repetate a clorhidratului de yonkenafil la câinii beagle, cu scopul de a obține informații despre siguranța clorhidratului de yonkenafil. Studiul a fost realizat în conformitate cu „Liniile directoare pentru testele de toxicitate pe termen lung ale substanțelor chimice” furnizate de China Food and Drug Administration (CFDA) în temeiul Regulamentelor de bună practică de laborator. Acest studiu a fost realizat în conformitate cu principiile și procedurile prezentate în Ghidul Institutelor Naționale de Sănătate pentru Îngrijirea și Utilizarea Animalelor de Laborator. Acest protocol a fost aprobat de Institutul Comitetului pentru îngrijirea și bunăstarea animalelor din Materia Medica, CAMS și PUMC.
Materiale și metode
Articol de testare
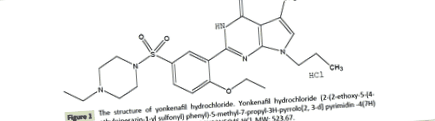
Clorhidrat de Yonkenafil (figura 1) (puritate 99,40%) este o pulbere galbenă, solubilă în apă, inodoră. Capsulele (300-500 mg, 200-300 mg, 40-50 mg yonkenafil clorhidrat/capsulă) au fost obținute de la Tianjin Tasly Company Ltd. (Tianjin, PR China) și au fost utilizate pentru administrare orală în acest studiu. Numărul de capsule pentru fiecare câine a fost calculat în fiecare săptămână pe baza greutății corporale recente.
Figura 1: Structura clorhidratului de yonkenafil. Clorhidrat de Yonkenafil (2- (2-etoxi-5- (4-etilpiperazin-1-il sulfonil) fenil) -5-metil-7-propil-3H-pirolo [2,3-d] pirimidină -4 (7H) - one- clorhidrat). Formula: C24H33N5O4S · HCI, MW: 523,67.
Animale și creșterea animalelor
Treizeci și doi de câini beagle sănătoși, de sex masculin și femel, cântărind 6-8 kg și cu vârsta cuprinsă între 6-12 luni au fost obținuți de la Institutul de Științe Animale de Laborator, Colegiul Medical din Uniunea Beijing și Academia Chineză de Științe Medicale (Beijing, China) Toți câinii au fost aclimatizați în instalațiile experimentale pentru o perioadă de 4 săptămâni înainte de debutul experimentului. Animalele au fost adăpostite individual în cuști și întreținute într-o cameră pentru animale controlată de mediu. Camera animalelor a fost monitorizată și menținută sub un ciclu de lumină-întuneric de 12 ore controlat printr-un temporizator automat cu o temperatură de 23 ± 5 ° C și umiditate relativă între 40% și 60%. Frecvența de ventilație a fost de 15 ori h-1 pe tot parcursul acestui studiu. Câinilor li s-a oferit acces ad libitum la dieta certificată extinsă (Laboratory Animal Science Center, Academy of Military Medical Sciences, Beijing, China). Apa municipală, procesată printr-o membrană de osmoză inversă, a fost furnizată câinilor ad libitum.
Proiectarea studiului și selectarea dozei
Câinii masculi și femele (n = 4/sex/doză) au fost repartizați aleatoriu în patru grupuri de tratament (0, 7, 30 și 120 mg/kg/zi clorhidrat de yonkenafil). Două animale pe sex per grup au fost sacrificate sub anestezie pentobarbitală la sfârșitul perioadei de tratament în ziua 90, iar restul de două animale pe sex per grup au fost examinate după o perioadă de recuperare de 28 de zile.
Selecția nivelurilor de dozare în studiul actual sa bazat pe rezultatele unui studiu de toxicitate acută al clorhidratului de yonkenafil la șoareci și pe datele farmacodinamice de la șobolani. În studiul acut, LD50 a fost de 2000 mg/kg/zi, iar intervalul de încredere de 95% a fost de la 1610 la 2438 mg/kg/zi. În studiul farmacodinamic, doza minimă eficientă a fost de 6 mg/kg/zi, iar doza maximă eficientă a fost de 24 mg/kg/zi. Doza optimă a fost de 12 mg/kg/zi. În prezentul studiu, 120 mg/kg/zi a fost specificat ca nivel de doză mare, care a fost de 33,3 ori doza eficientă optimă. Dozele mai mici de 30 mg/kg/zi și 7 mg/kg/zi au fost selectate ca niveluri medii și, respectiv, cu doze mici.
Observație clinică
Mortalitatea și observațiile clinice au fost înregistrate zilnic. Greutățile corporale și temperaturile tuturor animalelor au fost măsurate de două ori în perioada de carantină și o dată pe săptămână în timpul perioadelor de administrare și recuperare. Consumul de alimente a fost măsurat de două ori în perioada de carantină și la intervale săptămânale în timpul tratamentului și convalescenței. Cantitățile de alimente (aproximativ 300 g) au fost înregistrate înainte de a fi furnizate fiecărei cuști, iar restul de alimente a fost măsurat a doua zi pentru a determina diferențele, care au fost considerate ca consum zilnic de alimente (g la 100 g greutate corporală).
Examinările oftalmoscopice au fost efectuate pe fiecare câine înainte de începerea tratamentului (Ziua -14, Ziua -7, respectiv 14 și 7 zile înainte de inițierea tratamentului, respectiv), în perioada de tratament (Ziua 45), după ultima doză (Ziua 90) ) și după recuperare (ziua 118) folosind un oftalmoscop indirect binocular (Topcon, Japonia). Zonele de observare au inclus corneea, conjunctiva, sclera, irisul, cristalinul și fundul. Electrocardiogramele au fost efectuate în Ziua 14, Ziua 7, Ziua 45, Ziua 90 și Ziua 118 pentru a măsura ritmul cardiac, intervalul P-R, intervalul QRS și intervalul QT.
Parametrii de testare de laborator
Probele de sânge au fost recoltate de la toate animalele în Ziua 14, Ziua 7, Ziua 45, Ziua 90 și Ziua 118. Probele de urină au fost recoltate de la toate animalele în Ziua 90 și Ziua 118. Toți câinii au fost posti cu mai mult de 12 ore înainte de proba de sânge/urină obținută. Probele de sânge au fost extrase dintr-o venă a membrului anterior în tuburile de colectare a sângelui evacuate. Sub anestezie, urina a fost colectată din vezică pe o probă de hârtie de testare printr-un cateter. EDTA și citratul de sodiu au fost utilizate ca anticoagulante pentru studiul coagulării sângelui.
Hematologie și coagulare a sângelui
Parametrii hematologici au fost evaluați utilizând un analizor automat de hematologie MEK-6318K (Nihon-Kodhen Co., Tokyo, Japonia) pentru numărul de eritrocite (RBC), hemoglobină (Hb), hematocrit (HCT), volumul corpuscular mediu (MCV), corpuscular mediu hemoglobina (MCH), concentrația medie a hemoglobinei corpusculare (MCHC), coeficientul de lățime-variație a distribuției eritrocitelor (RDW-CV), numărul de trombocite (PL), volumul mediu de trombocite (MPV), lățimea de distribuție a trombocitelor (PDW), trombocit (PCT), număr de leucocite (WBC) și număr de celule diferențiale (DC). Frotiurile de sânge au fost colorate cu Wright-Giemsa-cenușiu-albastru (Heath și Daland, 1931), iar numărul de reticulocite (Reti) a fost efectuat prin microscopie cu lumină.
Parametrii de coagulare, incluzând timpul de trombină (TT), timpul de protrombină (PT), timpul de tromboplastină parțial activat (APTT) și fi brinogen (Fbg), au fost evaluați cu kitul DIAGNOSTICA STAGO STA-4 Coagmaster (Junior Instruments Co., Gennevilliers, Franța).
Biochimie serică
Parametrii de chimie a sângelui au fost determinați utilizând un Vitalab Autoanalyzer (Vital Scienti fi c, Dieren, Olanda) și un AVL-9181 Autoelectrolyte Analyzer (AVL Scienti fi c Co., Roswell, Georgia, SUA). Parametrii măsurați au fost aspartat aminotransferază (AST), alanin aminotransferază (ALT), fosfatază alcalină (ALP), glucoză (GLU), azot uree din sânge (BUN), acid uric (UA), lactat dehidrogenază (LDH), proteină totală), albumină (ALB), bilirubină totală (T-BIL), colesterol total (T-CHO), trigliceride (TG), creatinină (CRE), creatin kinază (CK), raportul albumină-globulină (A/G) și nivelurile serice de calciu (Ca), sodiu (Na), potasiu (K) și clorură (Cl).
Analiza urinei
Analiza urinei a fost efectuată utilizând benzi Multistrix® (Bayer Corp., Bridgend, South Wales, Marea Britanie) pentru parametri incluzând glucoza (GLU), bilirubina (BIL), cetone (KET), gravitația specifică (SG), sângele ocult (BLO), pH, proteine (PRO), urobilinogen (URO), nitriți (NIT), leucocite (LEU) și sedimente urinare.
Necropsie și examen histopatologic
2 câini/sex/grup au fost sacrificați sub anestezie cu eter la sfârșitul perioadei de tratament, iar restul de doi câini/sex/grup au fost sacrificați la sfârșitul perioadei de recuperare. S-a efectuat o necropsie amănunțită și s-au excizat și cântărit următoarele organe: creier, plămâni, inimă, ficat, splină, timus, rinichi, suprarenale, prostată, testicule, epididimită, uter și ovare. Greutatea relativă (greutatea la 100 g greutate corporală) a fiecărui organ a fost calculată și înregistrată. Organele de mai sus și glanda tiroidă, glandele paratiroide, glandele salivare, vezica biliară, pancreasul, sternul și măduva osoasă, măduva spinării, hipofiza, esofag, stomac, intestine (duoden, jejun, ileon și colon), ganglionii limfatici (mezenteric), vezica urinară, sânul, traheea, nervul sciatic și nervul optic au fost fixate într-o soluție de formalină tamponată 10%. Aceste probe au fost procesate în mod obișnuit, încorporate în parafină, secționate la 5 μm și colorate cu hematoxilină-eozină pentru examen histopatologic.
Toxicocinetica
Probele de sânge au fost obținute în prima zi (0,5, 1, 2, 3, 4, 5, 6, 7, 8, 24 ore după administrare), 45 a zi (0,5, 5, 24 ore după administrare), 90 de zile (0,5, 5, 24, 48, 72, 96 h după administrare) și 118 a zi pentru determinările plasmatice ale nivelului de clorhidrat de yonkenafil. Cu fiecare ocazie, s-au extras aproximativ 2,0 ml de sânge din vena membrelor anterioare a câinilor; probele au fost colectate în tuburi care conțin heparină. Probele de sânge au fost centrifugate imediat, iar probele de plasmă au fost depozitate într-un congelator de -20 ° C până la analiză. După decongelare la temperatura camerei, probele de plasmă au fost vortexate și o alicotă (100 μL) a fost amestecată cu 100 μL I.S. (standard intern) (diazepam 250 ng/ml) și 100 μL metanol: apă (50:50, v/v) și 50 μL NaOH (1 M) într-un tub cu capac de 10 ml. Amestecul a fost vortexat timp de 10 s și a fost extras cu 3,0 ml dietileter: diclormetan, 60:40, v/v).
După agitare timp de 10 min și centrifugare la 3500 × g timp de 5 min, faza organică superioară a fost transferată cu atenție într-un alt tub și evaporată la 40 ° C sub un curent ușor de azot. Reziduul a fost reconstituit în faza mobilă de 200 μL și 20 μL au fost injectați în sistemul LC-MS/MS. Determinarea cunoștințelor tehnice a fost efectuată la Colegiul de Științe ale Vieții de la Universitatea Jilin (Changchun, China).
analize statistice
Grupurile experimentale au fost comparate cu grupul de control în ceea ce privește greutatea corporală, consumul de alimente, parametrii hematologici (cu excepția numărului diferit de leucocite și a numărului de reticulocite), a valorilor chimiei sângelui și a greutății organelor. Dacă datele au fost omogene în conformitate cu testul lui Bartlett, s-a folosit o analiză continuă a varianței (ANOVA). Dacă datele nu erau omogene (și pentru numărul diferențiat de leucocite și numărul de reticulocite), s-a folosit testul lui Kruskal-Wallis. Parametrii găsiți semnificativi în analiza unică a varianței (ANOVA) au fost evaluați prin testul Dunnett. Datele privind procentul și raportul din analiza urinei au fost evaluate prin teste chi-pătrat. Nivelurile de semnificație pentru comparațiile pe perechi au fost raportate la p 0.798, p
- Un studiu pe 100 de sugari și copii mici cu alergie la laptele de vacă SpringerLink
- Un studiu al utilizării absorbantului natural pentru a reduce cationii de fier din soluțiile apoase
- Un studiu al modelelor de utilizare a Etoricoxib în Franța (MK-0663-148) - Vizualizare text complet
- Asociere între IMC, tensiune arterială și studiu de vârstă la bărbații tribali Tangkhul Naga din
- Abdominoplastie, lipectomie de aspirație și repararea herniei ventrale - Buletine de politici clinice medicale