De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
De la Facultatea de Medicină din Charité (RF, RD, SF, FH, AG, IS, UBZ, ES, AS, FCL, DNM), Centrul de Cercetări Experimentale și Clinice, Clinica Franz Volhard și HELIOS Klinikum Berlin-Buch, Berlin, Germania; Max-Delbrueck-Center for Molecular Medicine (F.Q., M.M., R.P., A.H., F.C.L., W-H.S., D.N.M.), Berlin-Buch, Germania; Facultatea de Medicină din Hanovra (J-K.P.), Hanovra, Germania.
Vizualizați cea mai recentă versiune a acestui articol. Versiunile anterioare:
Abstract
Metode
Proiectare experimentală
Am studiat dTGR-urile masculine (RCC Ltd) și șobolanii non-transgenici Sprague-Dawley (SD) (Tierzucht Schönwalde) netransgenici. 4.7.15.16 Autoritățile locale au aprobat studiile și am urmat liniile directoare ale Societății Fiziologice Americane. Omacor, un amestec de n-3 PUFA-uri foarte concentrate care conțin 46% EPA- și 38% DHA-esteri etilici, a fost furnizat de Solvay Pharmaceuticals. Novartis Pharmaceuticals a furnizat DRI, aliskiren. Am comparat dTGR-uri netratate (n = 16), dTGR + Omacor (25-g/kg dietă; n = 18), dTGR + aliskiren (3 mg/kg pe zi cu mini-pompă osmotică; n = 9) și SD (n = 10) șobolani. Am folosit un număr mai mare de dTGR netratate și tratate cu Omacor, deoarece nu am putut prezice mortalitatea lor. Tratamentul a fost început la vârsta de 4 săptămâni. ECG, magnetocardiografia (MCG) și tensiunea arterială sistolică (prin manșeta cozii) au fost determinate în săptămâna 7. Șobolanii au fost eutanasiați prin decapitare la vârsta de 7 săptămâni. Serul și plasma au fost colectate pentru analize ulterioare. Inimile au fost îndepărtate și spălate cu soluție salină rece ca gheața, șterse uscate și cântărite. Într-un al doilea protocol, șobolanii vechi de 7 săptămâni (dTGR: n = 8; dTGR + Omacor: n = 9; dTGR + aliskiren: n = 8; SD: n = 7) au fost supuși unor stimulări electrice programate in vivo.
ECG, MCG și studii electrofiziologice in vivo
ECG și MCG s-au făcut sub anestezie ușoară cu izofluran, așa cum s-a descris anterior. 6,17,18 Stimularea electrică programată a fost efectuată după cum a fost raportat recent 6 (vă rugăm să consultați suplimentul de date disponibil la http://hyper.ahajournals.org).
Compoziția acidului gras
Țesutul cardiac ventricular stâng (n = 6 per grup de animale) a fost înghețat în azot lichid și omogenizat cu ajutorul unui biopulverizator (Biospec Products Inc). Alicote (10 mg) au fost tratate cu hidroxid de tetrametilamoniu pentahidrat, iar acizii grași liberi eliberați au fost analizați prin cromatografie lichidă/spectrometrie de masă (FILT GmbH). Separarea a fost efectuată pe o coloană Gemeni (5 μm de C18, 150 × 3 mm) folosind un gradient acetat de amoniu/acetonitril la pH 9,5. Pentru detectarea acizilor grași individuali a fost utilizat un mod negativ de monitorizare cu un singur ion. Acidul pentadecanoic a servit ca standard intern, iar cuantificarea acizilor grași individuali a fost efectuată utilizând curbele de calibrare respective. Aceeași procedură a fost aplicată pentru a determina compoziția de acizi grași a diferitelor ciururi utilizate pentru hrănirea șobolanilor.
Imunohistochimie și cantitativ TaqMan RT-PCR
Criosecțiile fixate cu acetonă rece ca gheața (6 μm) au fost colorate prin tehnici de imunofluorescență, așa cum s-a descris mai devreme. 19 Au fost utilizați următorii anticorpi monoclonali: anti - ED-1, antifibronectină și anticolagen I (Southern Biotechnology), precum și iepure policlonal anti - Cx-43 (Sigma; vă rugăm să consultați suplimentul de date). Izolarea ARN și TaqMan RT-PCR au fost efectuate așa cum s-a descris mai devreme. 7 Am analizat țesutul LV pentru expresia mARN-ului peptidului natriuretic atrial. Fiecare probă a fost în trei exemplare. Secvențele țintă au fost normalizate în raport cu produsul 36B4. Exemplul de secvență este disponibil la cerere (Biotez).
Statistici
Datele sunt prezentate ca medie ± SEM. Diferențele în valorile medii au fost testate prin testul exact nonparametric al lui Mann-Whitney; inducerea aritmiei a fost testată cu χ 2. O valoare de P 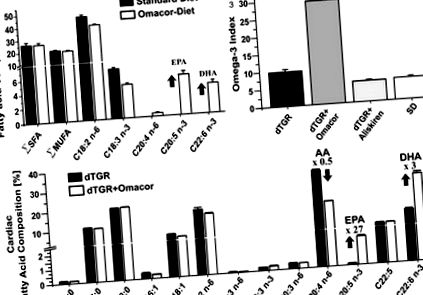
figura 1. A, Chow-ul standard nu conțin EPA și DHA și conține cantități mari de acid linoleic (C18: 2 n-6). Rețineți prezența acidului α-linolenic (C18: 3 n-3), care poate explica conținutul relativ ridicat de DHA cardiac deja la animalele hrănite cu chow-ul standard Chow-ul suplimentat cu Omacor s-a diferențiat de chow-ul standard doar prin prezența suplimentară a EPA și DHA. B, dTGR-uri alimentate cu dieta suplimentată cu Omacor au arătat o creștere semnificativă a indicelui cardiac omega-3 calculat ca (EPA + DHA)/acizi grași totali în procente. C, conținutul cardiac al EPA (20: 5 n-3) și DHA (22: 6 n-3) a fost crescut, iar conținutul de AA (20: 4 n-6) a fost redus în dTGR-uri alimentate cu Omacor- dieta suplimentată în comparație cu dTGR-uri netratate. Compoziția acizilor grași cardiaci a fost analizată la animale vechi de 7 săptămâni (n = 6 per grup). Conținutul total de acizi grași (micrograme per miligram de țesut cardiac) a fost de 18,6 ± 1 (dTGR), 18,6 ± 0,7 (dTGR tratat cu Omacor), 25,4 ± 1 (dTGR tratat cu Aliskiren) și 18,8 ± 0,6 (SD).
DTGR-urile netratate au prezentat 31% mortalitate la vârsta de 7 săptămâni (5 din 16; Figura 2A). În schimb, niciunul dintre dTGR-urile tratate cu Omacor și aliskiren nu a murit. DTGR-urile netratate au dezvoltat tensiune arterială sistolică ridicată, care a fost redusă modest prin tratamentul cu Omacor (208 ± 5 versus 180 ± 3 mm Hg; P
Figura 2. A, DTGR netratate au prezentat mortalitate ridicată (5 din 16), care a fost redusă la 0 prin tratamentul cu Omacor (0 din 18) și aliskiren (0 din 9). Niciunul dintre controalele SD nu a murit (n = 10). B, la vârsta de 7 săptămâni, Omacor a redus tensiunea arterială doar ușor, în timp ce aliskiren a normalizat-o. C, dTGR-urile netratate și tratate cu Omacor au prezentat greutate cardiacă crescută comparativ cu dTGR-urile tratate cu aliskiren și șobolanii SD. D, expresia mARN-ului ANP ventricular stâng, ca marker pentru hipertrofia cardiacă, a confirmat rezultatele. Rezultatele sunt medii ± SEM. *P
Pentru a analiza dacă mortalitatea redusă s-ar putea datora morții subite cardiace diminuate, am testat inducerea aritmiei. Stimularea electrică programată a arătat o rată ridicată de inducție a tahicardiei ventriculare nesustenate și susținute în dTGR-uri netratate (75%; Figura 3A). În controalele SD, același protocol nu a inițiat niciodată aritmii. Inducția aritmiei a fost redusă în aceeași măsură de ambele tratamente. Doar 17% din dTGR-urile tratate cu Omacor și 17% din dTGR-urile tratate cu aliskiren au răspuns la stimularea electrică cu tahicardie ventriculară (P
Figura 3. Studii electrofiziologice in vivo la șobolani dTGRs vechi de 7 săptămâni (n = 8), dTGR + Omacor (n = 9), dTGR + aliskiren (n = 8) și SD (n = 7). A, Figura arată inducibilitatea aritmiilor ventriculare prin stimulare electrică programată in vivo. Dat este numărul protocoalelor de stimulare cu aritmii inductibile din toate protocoalele de stimulare efectuate în procente. B, Perioada refractară eficientă ventriculară stângă a fost prelungită în dTGR-uri netratate. Ambele tratamente au redus refractarul ventricular. *P
Perturbarea din perioada refractară ventriculară a indicat modificări ale fenotipului electrofiziologic, care a fost confirmată de ECG și MCG. Intervalul QRS prelungit în dTGR-uri comparativ cu controalele SD (21 ± 0,5 versus 18,4 ± 0,2 ms; P
Figura 4. A, intervalul QRS a fost prelungit semnificativ în dTGR-uri netratate. Ambele tratamente au redus intervalele QRS în aceeași măsură. B și C, repolarizarea a fost prelungită în dTGR netratate, indicate de un sindrom QT lung dobândit. Aliskiren a normalizat intervalele QT, în timp ce Omacor a redus intervalele QT. D, dispersia temporală a vârfului undei T a fost evaluată prin cartografierea suprafeței magnetocardiografice. Cifra oferă diferența maximă în TPEAK într-o zonă pătrată de 60 × 60 mm peste toracele animalului. Dispersia ridicată TPeak a dTGR-urilor netratate a fost redusă semnificativ prin tratamentul cu Omacor. Aliskiren l-a redus la niveluri de control. *P
DTGR-urile netratate au prezentat fibroză marcată. Imunoreactivitatea cardiacă pentru colagenul I a fost observată predominant perivascular, în timp ce expresia fibronectinei a fost predominant interstițială. Tratamentul cu Aliskiren și suplimentarea cu PUFA n-3 au redus substanțial ambele depozite de matrice (Figura 5A și 5B). ED-1, un marker al infiltrării monocitelor/macrofagelor, a arătat prevalența inflamației în dTGR-uri netratate. Ambele tratamente au redus infiltrarea monocitelor/macrofagelor la nivelul SD (Figura 5C). Dislocarea joncțiunii gap Cx43 este un mecanism de remodelare electrică a dTGR. Am găsit imunoreactivitate pronunțată Cx43 la marginile cardiomiocitelor laterale (Figura 5D). În schimb, Cx43 a fost limitat la regiunile de disc intercalate în SD. În mod surprinzător, inimile hipertrofiate ale dTGR-urilor tratate cu Omacor au prezentat localizarea normală a joncțiunii gap Cx43. Aliskiren a prevenit, de asemenea, expresia anormală a Cx43.
Figura 5. Tratamentul A și B, Omacor și aliskiren au redus depunerea de colagen I și fibronectină. C, infiltrarea cu monocite cardiace și macrofage (celule ED-1 +) a fost normalizată prin tratamentul cu Omacor și aliskiren, comparativ cu dTGR-urile netratate. Rezultatele sunt medii ± SEM. *P
Discuţie
Am arătat că o intervenție bazată pe n-3 PUFA a redus mortalitatea în modelul nostru la 0. Suplimentarea n-3 cu PUFA a redus modificările electrofiziologice într-o măsură similară cu aliskirenul DRI, în ciuda unei diferențe de 70 mm Hg a tensiunii arteriale și a dezvoltării hipertrofie cardiacă. Aceste rezultate indică faptul că nivelurile tensiunii arteriale și ale hipertrofiei cardiace nu sunt singurii factori determinanți pentru aritmii crescute. Ambele tratamente au prevenit inflamația, fibroza și dislocalizarea joncțiunilor gap Cx43. Prin urmare, reducerea aritmiilor sau a morții subite poate depinde de o arhitectură a țesutului nonmorfologic și de cuplarea organizată celulă-celulă comparativ cu hipertrofia cardiacă, în sine.
Reducerile marcate ale intervalului QRS și ale inducției aritmiei sugerează o îmbunătățire a conducției. Factorii cel mai probabil responsabili sunt fibroza și joncțiunile gap Cx43, care sunt cruciale pentru cuplarea electrică a cardiomiocitelor adiacente. Într-adevăr, am găsit fibroză redusă și, mai surprinzător, o distribuție subcelulară normală a Cx43 în ambele grupuri de tratament. Dislocalizarea joncțiunii gap indusă de Ang II în dTGR-uri netratate s-a datorat probabil modificărilor stării de fosforilare Cx43. Redistribuirea 30 Cx43 apare și în condiții de ischemie și contribuie la decuplarea electrică a cardiomiocitelor și la dezvoltarea aritmiilor. S-a demonstrat că precondiționarea cardiacă previne redistribuirea intracelulară a Cx43 și protejează împotriva leziunilor cardiace și aritmiilor în timpul atacurilor ulterioare de ischemie prelungită. 31 Suntem primii care arată că există, de asemenea, o legătură directă între proprietățile antiaritmice ale n-3 PUFA și restabilirea localizării Cx43 corespunzătoare pe discurile intercalate. DHA a îmbunătățit, de asemenea, localizarea funcțională a Cx43 în astrocite, 32 indicând existența unor mecanisme comune ale modului în care n-3 PUFA-urile pot îmbunătăți cuplarea joncțiunii gap în celulele inimii și creierului.
Perspective
DRI și n-3 PUFA pot fi viitori agenți terapeutici puternici care asigură cardioprotecție și reduc în special riscul de aritmii. Combinația ambelor terapii ar putea fi utilă la pacienții cu boli de inimă induse de hipertensiune. Descoperirea căii de semnalizare PUFA n-3 poate prezenta noi candidați pentru medicamente antiaritmice.
Primii 2 autori au contribuit în mod egal la această lucrare.
Mulțumim Astrid Schiche, Jutta Meisel și Gabriele N′diaye pentru asistență tehnică.
- Acizi grași polinesaturați și cancerul dietetic Omega-3 Gabriella Calviello Springer
- Efectele drenajului limfatic și al acizilor grași polinesaturați omega-3 asupra intestinului
- Acizi grași polinesaturați ca compuși bioactivi ai contribuției microalgelor la sănătatea umană a irisului
- Raportul dietetic dintre acizii grași omega-3 și omega-6 poate fi problema Neurologiei
- Grăsimi, stres, moarte Descoperirea efectelor toxice ale acizilor grași saturați asupra celulelor Știri Harvard T
