Anna G. Drannik
1 Departamentul de patologie și medicină moleculară, Centrul de cercetare în imunologie McMaster, Institutul Michael G. DeGroote pentru cercetarea bolilor infecțioase, Universitatea McMaster, Hamilton, Ontario, Canada,
Kakon Nag
1 Departamentul de Patologie și Medicină Moleculară, Centrul de Cercetare în Imunologie McMaster, Institutul Michael G. DeGroote pentru Cercetarea Bolilor Infecțioase, Universitatea McMaster, Hamilton, Ontario, Canada,
Xiao-Dan Yao
1 Departamentul de patologie și medicină moleculară, Centrul de cercetare în imunologie McMaster, Institutul Michael G. DeGroote pentru cercetarea bolilor infecțioase, Universitatea McMaster, Hamilton, Ontario, Canada,
Bethany M. Henrick
1 Departamentul de Patologie și Medicină Moleculară, Centrul de Cercetare în Imunologie McMaster, Institutul Michael G. DeGroote pentru Cercetarea Bolilor Infecțioase, Universitatea McMaster, Hamilton, Ontario, Canada,
T. Blake Ball
2 Departamentul de Microbiologie Medicală, Universitatea din Manitoba și Agenția de Sănătate Publică din Canada, Winnipeg, Manitoba, Canada,
Francis A. Plummer
2 Departamentul de Microbiologie Medicală, Universitatea din Manitoba și Agenția de Sănătate Publică din Canada, Winnipeg, Manitoba, Canada,
Charles Wachihi
3 Departamentul de Microbiologie Medicală, Universitatea din Nairobi, Nairobi, Kenya,
Joshua Kimani
3 Departamentul de Microbiologie Medicală, Universitatea din Nairobi, Nairobi, Kenya,
Kenneth L. Rosenthal
1 Departamentul de Patologie și Medicină Moleculară, Centrul de Cercetare în Imunologie McMaster, Institutul Michael G. DeGroote pentru Cercetarea Bolilor Infecțioase, Universitatea McMaster, Hamilton, Ontario, Canada,
Conceput și proiectat experimentele: AGD KN KLR. A efectuat experimentele: AGD. Analiza datelor: AGD KN X-DY. Reactivi/materiale/instrumente de analiză contribuite: KN X-DY BMH TBB FP CW JK. Am scris lucrarea: AGD KN KLR.
Abstract
Introducere
Tr și E (Tr/E) sunt antiproteaze de alarmă și regulatoare ale imunității mucoasei, cu proprietăți antimicrobiene, imunomodulatoare și de reparare a țesuturilor bine documentate [23], [24]. Tr/E sunt membri ai familiei de proteine acide din zer (WAP) care conține un nucleu caracterizat și evolutiv conservat cu patru disulfuri (FDC) sau domeniu WAP, implicat în inhibarea proteazei [25], [26]. Tr (9,9 kDa) este o moleculă precursor secretată care are două domenii. În domeniul său N-terminal, Tr conține un domeniu de legare a substratului transglutaminazei (TSBD), permițând cuplarea Tr la proteinele matricei extracelulare [27]. Scindarea proteolitică a capătului N-terminal al Tr produce elafină (E) (5,9 kDa), conținând un domeniu inhibitor WAP [28] și un TSBD [29].
Similar cu omologul lor structural, inhibitor secretiv al proteazei leucocitelor (SLPI) [26], Tr/E posedă activitate antimicrobiană împotriva bacteriilor, ciupercilor și virusurilor, inclusiv HIV-1 [11], [23], [30], [31] . Au fost propuse mai multe mecanisme ale activității antimicrobiene Tr/E, inclusiv interacțiunea lor directă cu membrana celulară microbiană datorită naturii cationice a acestor molecule [31], opsonizarea bacteriană [32] și legarea la ADN-ul bacterian [33]. De asemenea, s-a arătat că Tr/E posedă proprietăți imunomodulatoare [24]. Sa demonstrat că E inhibă eliberarea declanșată de LPS de MCP-1 în monocite [34], în timp ce Tr/E a redus secreția IL-8 și TNFα ca răspuns la elastaza umană, LPS și LDL oxidat în celulele endoteliale și macrofage TNF [35]. ]., [36]. Această imunomodulare a fost atribuită legării la LPS [35] sau inhibării activării căilor NF-κB și AP-1 [34]. Aceste descoperiri demonstrează natura pleiotropă a Tr/E și contribuția lor la apărarea gazdei la niveluri diferențiale: vizând atât agenții patogeni, cât și răspunsurile imuninflamatoare ale gazdei.
Tr/E au fost, de asemenea, legate de tulburări inflamatorii ale plămânului [37], [38], intestinului [39] și pielii [25]. Tr/E sunt exprimate constitutiv în secrețiile mucoasei [9], [11] și pot fi induse ca răspuns la IL-1β, TNFα și poliI: C [3], [11], [40]. Tr/E sunt produse de mai multe tipuri de celule, inclusiv EC genitale [3], [11], [40] și au fost identificate în fluidul de spălare cervicovaginală (CVL) [22], [30]. Împreună cu SLPI și o mulțime de alte molecule efectoare, și anume defensine, serpine, cistatine, lizozimă și lactoferină, Tr/E joacă un rol semnificativ în protejarea FGT împotriva ITS, inclusiv HIV-1 [9], [11] ], [12], [30], [41], [42].
Materiale și metode
Reactivi și linii celulare
Acidul polinozinic/policitidilic (poliI: C) (Sigma-Aldrich, Oakville, ON, Canada) a fost reconstituit în PBS la concentrația indicată. Carcinom endometrial uman (HEC-1A, ATCC # HTB-112 ™, depus de Dr. H. Kuramoto) și TZM-bl (JC53-BL) (ATCC # PTA-5659, brevet SUA numărul 6.797.462, contribuit de Dr. John Kappes și celulele Xiaoyun Wu) au fost obținute din colecția American Type Culture Collection (ATCC) (Rockville, MD, SUA) și menținute în McCoy's 5A Medium Modified (Invitrogen Life Technologies, Burlington, Ontario, Canada) și, respectiv, DMEM, completate cu 10% fetal ser bovin, 1% HEPES (Invitrogen Life Technologies), 1% l-glutamină (Invitrogen Life Technologies) și 1% penicilină-streptomicină (Sigma-Aldrich, Oakville, Ontario, Canada) la 37 ° C și 5% CO2.
Test de inhibare a proteazei
Activitatea inhibitoare a elastazei a fost măsurată așa cum s-a descris anterior [30], [43]. Pe scurt, proteina Tr/E (volumul final 10 pl/godeu), sau diluant singur, a fost combinată într-o placă cu 96 de godeuri cu 50 ng în 10 pl/godeu de elastază neutrofilă umană purificată (HNE) (Sigma-Aldrich) sau diluant singur (martor negativ) și incubat timp de 30 de minute la 37 ° C. Ulterior, 50 μl de substrat HNE, N-metoxisuccinil-Ala-Ala-Pro-Val p-nitroanilidă (Sigma-Aldrich), diluat la 50 μg/ml în tampon (50 mM Tris, 0,1% Triton, 0,5 M clorură de sodiu, s-a adăugat pH 8). Hidroliza a fost măsurată prin monitorizarea absorbanței la 405 nm timp de 15 minute folosind un cititor ELISA Tecan Safire (MTX Labs Systems).
Participanții la studiu
Participanții la studiu au fost descriși mai detaliat în altă parte [30]. Pe scurt, femeile dintr-o cohortă de CSW-uri Pumwani din Nairobi, Kenya, au fost înscrise în timpul cercetărilor bianuale programate în două grupuri de studiu: HIV-R, HIV-S. Aceasta este o cohortă continuă, deschisă, cu participanți înscriși între 1989 și 2009. În cadrul cohortei, femeile care au rămas HIV negative timp de 7 ani de urmărire, conform evaluării atât prin serologie, cât și prin RT-PCR, și care erau clinic sănătoase și libere de infecțiile cu transmitere sexuală (ITS) concomitente, precum și au rămas active în munca sexuală au fost considerate relativ rezistente la HIV HIV-R [44] _. Participanții, care au fost CSW neinfectați cu HIV, dar care au fost urmăriți de mai puțin de 7 ani, au fost definiți ca HIV-S. Toți participanții la cohortă aveau medii socio-economice și genetice similare. Niciun CSW înscris în acest studiu nu sa dovedit a avea ITS coexistente. Protocoalele de studiu au fost aprobate de comisiile de revizuire a eticii de la Universitățile din Nairobi, Manitoba și McMaster. Toți participanții au oferit consimțământul semnat și informat.
Izolarea probelor de mucoasă
Eșantioanele de col uterin au fost colectate folosind răzuitor și citobrush endocervical, urmând protocolul standard. Celulele EC au fost purificate din materialele răzuite folosind un protocol gravitațional standard Ficoll, care au fost dizolvate în 0,8 ml de TRIzol și depozitate la -70 ° C. EC cervicale au fost disponibile pentru fiecare dintre grupuri după cum urmează: (HIV-S, N = 10 și HIV-R, N = 10).
Proteine Trappin-2 (Tr) și elafin (E) pentru experimente in vitro
Pregătirea stocului HIV-1 și analize conexe
Tulpina HIV-1IIIB adaptată la laborator (X4-tropic) a fost preparată în PBMC și virusul HIV-1ADA (R5-tropic) a fost preparat în macrofage aderente purificate din PBMC uman, așa cum s-a descris în altă parte [45]. O doză de 10 ng de p24 a fost utilizată pentru experimente de transcitoză și imunofluorescență. Doza infecțioasă mediană de cultură tisulară (TCID50) pentru fiecare stoc final a fost determinată utilizând metoda Reed-Muench în celulele TZM-bl (5,00 × 10 3/ml pentru X4-HIV-1IIIB și 2,77 × 10 4/ml pentru R5-HIV -1 stoc stoc); 100 TCID50 din fiecare stoc HIV-1 au fost utilizate în testele de atașament HIV-1 care au reprezentat 860 pg pentru X4-HIV-1IIIB și 504 pg pentru stocul R5-HIV-1ADA.
Atașarea/intrarea și transcitoza HIV-1 în celulele HEC-1A
Testele de atașare/intrare și transcitoză HIV-1 au fost efectuate așa cum s-a descris anterior în referințele [30], [46], [47], cu ușoare modificări. Pentru testul de atașare/intrare, 100 TCID50 de celule R5-HIV-1ADA, X4-HIV-1IIIB sau HEC-1A, crescute într-o placă cu 96 de godeuri până la confluență completă, au fost incubate individual cu mediul singur sau au fost testate proteine Tr/E 1 µg/ml timp de 1 oră la 37 ° C pentru a vedea efectul anti-HIV-1 separat mediat prin virus și celule. După incubare, celulele au fost spălate în mod repetat cu PBS. Ulterior, celulele netratate cu proteinele au primit fie mediu (-), HIV-1 (V) netratat, fie HIV-1 preincubat cu Tr sau E (V + p) pentru încă 1,5 ore la 37 ° C. Celulele pretratate inițial cu proteinele (c + p) au primit HIV-1 netratat singur. După 1,5 ore de incubație, inoculul viral a fost îndepărtat, celulele au fost spălate în mod repetat (4 ×) și lizate (1% Triton X-100 timp de 45 de minute la 37 ° C). Lizatele celulare au fost recoltate și centrifugate la 11.000 × g timp de 5 minute. Cantitatea de p24 asociat cu lizatul celular total a fost determinată de ELISA și exprimată ca pg/ml.
Celulele au fost apoi spălate de trei ori cu PBS și incubate timp de 50-60 min la 37 ° C în 300 ofl dintr-o soluție de ferocianură de potasiu 4 mM, fericianură de potasiu 4 mM, MgCl2 2 mM și 0,4 mg X-Gal per ml . Reacția a fost oprită prin îndepărtarea soluției de colorare și spălarea celulelor de două ori cu PBS, iar celulele albastre au fost numărate la microscop. Datele sunt exprimate ca procent de particule infecțioase recuperate în prezența Tr sau E comparativ cu procentul de virus recuperat numai în controlul virusului, luat ca 100%. Concentrațiile de Tr și E utilizate în aceste experimente s-au bazat pe o activitate anti-HIV-1 dependentă de doză a proteinelor care a fost raportată mai devreme [30].
Analiza viabilității MTT
Testul MTT (Biotium Inc., Hayward, CA, SUA) a fost utilizat conform instrucțiunilor producătorului pentru a determina viabilitatea celulelor HEC-1A și a fost descris în altă parte [5], [30] _.
Testele ELISA
CVL-urile și supernatanții fără celule ai celulelor HEC-1A au fost depozitați la -70 ° C până la testarea Tr/E umană, IL-8 și TNF-α cu kit ELISA Duoset (sisteme R&D) conform protocolului furnizorului. Limita de întrerupere pentru Tr/E și IL-8 a fost de 31,25 pg/ml; TNF-a 15,6 pg/ml. p24 a fost detectat de HIV-p24 ELISA conform protocolului furnizorului (test de captare a antigenului HIV-1 p24, Advanced BioScience Laboratories, Inc., Kensington, MD, SUA) cu o limită de 3,1 pg/ml. Analitele au fost cuantificate pe baza curbelor standard obținute folosind un cititor ELISA Cititor ELISA Tecan Safire (MTX Labs Systems Inc.).
Colorarea imunofluorescentă
Colorarea cu imunofluorescență a fost efectuată așa cum este descris în altă parte [3], [5] _, dar cu modificări minore. Celulele HEC-1A crescute pe diapozitive de cultură BD Falcon cu 8 godeuri (BD Biosciences) au fost pretratate cu diverse preparate proteice Tr și E, timp de 1 oră sau cu poliI: C (25 µg/ml per godeu), sau 10 ng HIV- 1 p24 timp de 4 ore. În urma tratamentelor de mai sus, celulele au fost fixate și blocate așa cum s-a descris anterior. _NF-κB p65 sc-372 (SantaCruz Biotechnologies, Santa Cruz, CA, SUA) (1∶500) au fost utilizate pentru a detecta translocația nucleară a NF-κB p65. Fracția de imunoglobulină de iepure de control negativ (DakoCytomation, Glostrup, Danemarca) a fost utilizată ca martor izotipic. Pentru detectarea Tr/E. s-au folosit anticorpi primari TRAB2O (HM2062, Hycult Biotech, Uden, Olanda). HAT și 6 × etichetele sale au fost detectate folosind anticorpi anti-HAT (LS-> C51508, LifeSpan Biosciences, Inc., Seattle, WA, SUA) și anti-His (# 2365, Cell Signaling, Denvers, MA, SUA). respectiv. Ca anticorp secundar au fost utilizate IgG conjugate Alexa Fluorine 488 (Molecular Probes, Eugene, OR, SUA). Nucleii au fost vizualizați prin colorare cu iodură de propidiu. Imaginile au fost achiziționate cu ajutorul unui microscop confocal cu scanare laser inversat (LSM 510, Zeiss, Oberkochen, Germania).
Extracția ARN și analiza PCR cantitativă în timp real (RT-qPCR)
analize statistice
Datele au fost exprimate ca medii ± deviație standard (SD). Analiza statistică a fost efectuată fie cu testul t al Studentului, fie cu o analiză unidirecțională a varianței (ANOVA) utilizând Sigma Stat 2.0.
Rezultate
Capătul N-terminal al elafinei este critic pentru anti-HIV-1, dar nu pentru activitatea inhibitoare a proteazei
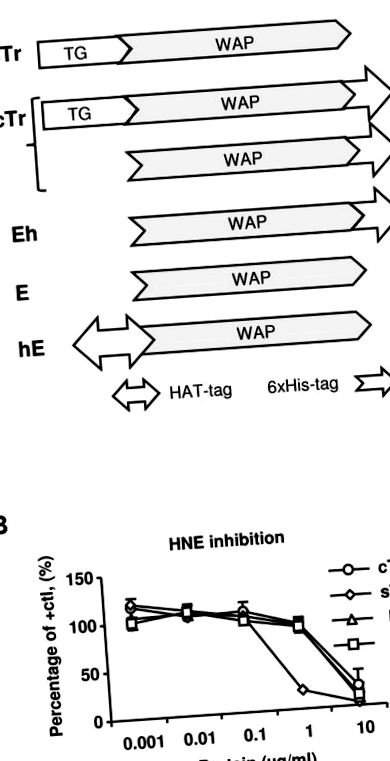
(A) Diagrame schematice ale preparatelor proteice umane testate trappin-2 (Tr) și elafin (E) (Tr/E). sTr, Tr secretat de om (fără etichetă); TG, domeniul transglutaminazei; WAP, domeniu proteic acid din zer; cTr, 6 × His-trappin-2 recombinant comercial pentru om, un amestec atât de Tr, cât și de E (cu o etichetă His terminală C); Eh, E recombinant uman purificat din cTr (cu o etichetă His terminală C); E, elafină recombinantă comercială umană (fără etichetă); hE, HAT-E uman recombinant intern (cu o etichetă HAT terminală N). (B) Activitatea inhibitoare a proteazei a diferitelor proteine Tr/E a fost testată prin combinarea elastazei neutrofile umane (HNE) cu diferite concentrații de Tr sau E și măsurarea activității reziduale a HNE prin adăugarea unui substrat specific de elastază cromogenă N-metoxisuccinil-Ala-Ala- Pro-Val p-nitroanilidă și monitorizarea schimbării absorbanței la 405 nm peste 15 min. Rezultatele sunt exprimate în raport cu activitatea NHE a unui control pozitiv (HNE numai în diluant); cTr (○); sTr, ((); E, ((); el, (().
Colorarea prin imunofluorescență a distribuției celulare a 1 µg/ml de proteine umane Tr sau E (verzi), detectată utilizând anticorpi specifici TRAB2O (A, B, C), His-tag- (D, E, F) și HAT-tag (G, H). Nucleii au fost vizualizați cu iodură de propidiu (PI) ca roșu. Colorarea reprezentativă a trei experimente diferite este prezentată pentru proteinele Tr sau E la 1 oră după expunere și imaginea combinată prezintă Tr sau E uman vizualizat ca galben în panouri compozite. Bara de scală, 20 mm.
Elafin inhibă secreția IL-8 ca răspuns la R5-HIV-1ADA în celulele HEC-1A
Interacțiunea HIV-1 cu EC genitale declanșează eliberarea factorilor proinflamatori, inclusiv IL-8 și TNFα [48], [49]. Având în vedere că studiile anterioare au demonstrat proprietăți imunomodulatoare ale Tr/E împotriva liganzilor bacterieni [34] și virali [3], am emis ipoteza că E poate afecta secreția de IL-8 și TNFα indusă de HIV-1 din celulele HEC-1A, implicate în ITS/Diseminarea și patogeneza HIV-1 [49]. Celulele HEC-1A au fost pretratate cu mediu singur sau cu 1 ug/ml de proteine cTr, E sau hE timp de 1 oră la 37 ° C și apoi stimulate suplimentar cu 10 ng de HIV-1 p24 timp de 8 ore la 37 ° C, condițiile care favorizează atașamentul/intrarea și transcitoza HIV-1. Măsurătorile ELISA au demonstrat niveluri semnificativ mai scăzute de IL-8 în compartimentul basolateral al celulelor HEC-1A după pretratarea cu E sau cTr, dar nu cu hE (datele nu sunt prezentate), după R5-HIV-1ADA (Fig. 4A), dar nu Expunerea la X4-HIV-1IIIB (Fig. 4B). Nivelurile de TNFα, cu toate acestea, au fost neglijabile și în jurul nivelului de detectare în toate grupurile, atât pentru probele tratate cu virus R5, cât și pentru X4-HIV-1 (datele nu sunt prezentate). Aceste rezultate sugerează că tratamentul E modifică reacția inflamatorie a celulelor HEC-1A indusă de HIV-1.
Nivelurile de proteină IL-8 au fost determinate în compartimentul basolateral prin ELISA și prezentate ca media ± SD a pg/ml. Analiza statistică a fost efectuată utilizând ANOVA, cu valorile p indicate pe un grafic și considerate semnificative atunci când p Fig. 5A). În special, provocarea poliI: C a produs un efect vizibil puțin mai mare decât provocarea R5-HIV-1ADA și a fost utilizată ca control pozitiv pentru experiment. Mai mult, X4-HIV-1IIIB nu a provocat nicio translocație nucleară semnificativă NF-κB/p65 (datele nu sunt prezentate). Interesant, spre deosebire de E sau cTr, tratamentul hE exogen nu a reușit să blocheze translocația nucleară NF-κB și a produs imagini similare celulelor UT (datele nu sunt prezentate).
EC genitale de la lucrătorii sexuali comerciali (CSW) rezistenți la HIV (HIV-R) au o expresie semnificativ mai scăzută a mai multor PRR
Având în vedere datele noastre in vitro (Fig. 5), am investigat dacă CSW-urile HIV-R, care rămân libere de HIV și au Tr și E mai mari în CVL-urile lor [22], [30], au avut, de asemenea, o expresie redusă a senzorilor virali înnăscuti în EC genitale. RT-PCR cantitativă a EC-urilor cervicale a arătat că CSW-urile HIV-R într-adevăr au redus semnificativ nivelurile de ARNm ale TLR2, 3, 4 și RIG-I în comparație cu CSW-urile susceptibile (HIV-S) (Fig. 6). Colectiv, datele noastre indică faptul că rezistența la HIV-1 poate fi asociată cu niveluri crescute de expresie scăzută mediată de E a PRR mucoase înnăscute pe EC genitale la portalul de intrare virală.
Nivelurile relative de expresie a ARNm ale TLR2, TLR4 și RIG-I în EC cervicale ale HIV-S (▪, N = 10) și HIV-R (•, N = 10) au fost evaluate prin RT-qPCR. Cantitatea relativă de expresie a acestor gene a fost normalizată față de 18S. Datele sunt prezentate ca medie ± SD. Analiza statistică a fost efectuată utilizând ANOVA, cu p considerat semnificativ atunci când p Wira CR, Grant-Tschudy KS, Crane-Godreau MA (2005) Celulele epiteliale în tractul reproductiv feminin: un rol central ca sentinele de protecție imună. Am J Reprod Immunol 53: 65–76. [PubMed] [Google Scholar]
- 10 caracteristici ale aplicației de activitate ascunsă care vă vor duce la fitness la nivelul următor
- BMR Calcularea raporturilor de activitate fizică prin înmulțirea BMR cu PAR - Pierderea în greutate pentru toți
- Activitatea de realizare a plăcilor MyPlate
- ACE - Certificat decembrie 2018 - Studiați câte calorii ardeți depinde de momentul zilei
- Activitate; Bellabeat