Chia-Hua Wu
1 Departamentul de farmacologie și științe nutriționale, Universitatea din Kentucky, Lexington, KY
Shayan Mohammadmoradi
1 Departamentul de farmacologie și științe nutriționale, Universitatea din Kentucky, Lexington, KY
Joel Thompson
2 Divizia de endocrinologie și medicină moleculară, Universitatea din Kentucky, Lexington, KY
Wen Su
3 Departamentul de fiziologie, Universitatea din Kentucky, Lexington, KY
Ming Gong
3 Departamentul de fiziologie, Universitatea din Kentucky, Lexington, KY
Genevieve Nguyen
4 Institutul Național al Sănătății și Cercetării Medicale (INSERM) și Collège de France, Unitatea de Medicină Experimentală, Paris, Franța
Frédérique Yiannikouris
1 Departamentul de farmacologie și științe nutriționale, Universitatea din Kentucky, Lexington, KY
Date asociate
Abstract
Hipertensiunea este principala cauză a bolilor cardiovasculare la nivel mondial și, potrivit NHANES III, prevalența hipertensiunii arteriale continuă să crească. 1,2 Obezitatea este un factor de risc important pentru hipertensiune. 1 Sistemul de renină angiotensină (RAS) este recunoscut pentru că joacă un rol critic în reglarea tensiunii arteriale și a homeostaziei de sodiu și apă. Ștergerea componentelor RAS, de exemplu angiotensinogen (AGT) în ficat sau în țesutul adipos, previne hipertensiunea arterială legată de obezitate. 3.4
Metode și animale
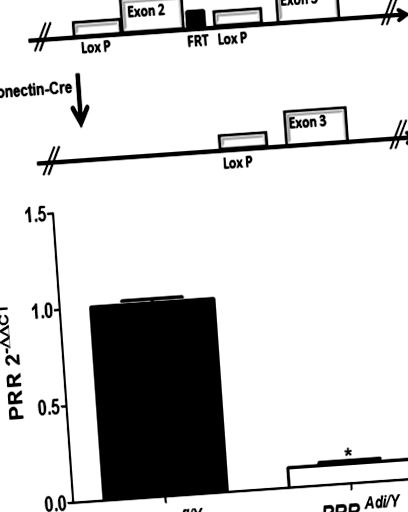
Toate procedurile care implică animale au fost efectuate în conformitate cu Ghidul Institutelor Naționale de Sănătate pentru Îngrijirea și Utilizarea Animalelor de Laborator și au fost aprobate de Comitetul Instituțional de Îngrijire și Utilizare a Animalelor de la Universitatea din Kentucky (numărul protocolului IACUC al Universității din Kentucky: 2013-1109 ). Șoarecii femele cu situsuri loxP care înconjoară exonul 2 al genei PRR (PRR fl/fl) au fost crescuți la șoareci masculi transgenici (PRR fl/Y) care exprimă recombinaza Cre sub controlul promotorului adiponectinei (Denumirea tulpinii: B6; FVB-Tg ( Adipoq-cre) 1Evdr/JB6; FVB-Tg (Adipoq-cre) 1Evdr/J) 24 (Figura 1A). Dietele, măsurătorile plasmei, histologia, radiotelemetria și analizele statistice sunt descrise în Suplimentul de date numai online.
(A) Reprezentarea schematică a alelei PRR flancate loxP înainte de (a) și după recombinare cu expresia Cre (Ad) de la Adiponectin (b). (B) PRR mRNA abundență de adipocit diferențiat de țesutul adipos subcutanat al șoarecilor PRR fl/Y și PRR Adi/Y. Datele sunt medii ± SEM de 3 până la 6 șoareci. * Șoareci P fl/Y.
analize statistice
Rezultatele sunt exprimate ca medie ± SEM. Toate datele au fost analizate folosind Sigma Plot și Graph Prism. ANOVA (și măsurile repetate ANOVA, atunci când este cazul) au fost utilizate pentru a compara dieta și efectele genotipului, urmate de teste post-hoc folosind corecții Holm-Sidak sau Bonferroni pentru comparații multiple. Când ipotezele care stau la baza ANOVA-urilor nu au fost îndeplinite altfel, datele au fost transformate neliniar; cu toate acestea, pentru ușurarea ilustrării, cifrele arată date netransformate. GraphPad QuickCalcs (testul lui Grubbs) a fost utilizat pentru a determina valorile aberante statistice și s-a folosit un test t pentru a compara nivelurile medii de insulină între șoarecii alimentați cu HF și LF. Semnificația statistică a fost definită ca Pf/Y) și șoarecii cu deficit de adipocite PRR (PRR Adi/Y) au fost diferențiați în adipocite (Figura 1A). Abundența PRR mARN a fost redusă semnificativ în adipocite diferențiate de șoarecii PRR Adi/Y în comparație cu șoarecii PRR fl/Y de control (Figura 1B; P Figura 2A) fără nicio diferență semnificativă între genotipuri. Masa de grăsime a fost semnificativ redusă la PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Figura 2B) și nu a crescut odată cu vârsta la șoarecii PRR Adi/Y care sugerează că șoarecii PRR Adi/Y nu acumulează țesut adipos (Figura S1) . Masa tuturor țesuturilor adipoase albe a fost semnificativ redusă la șoarecii PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Tabelul S1, șoarecii P fl/Y au relevat prezența adipocitelor diferențiate pe toată secțiunea, în timp ce analiza histologică a țesutului adipos rezidual din în jurul epididimului PRR Șoarecii Adi/Y au arătat un număr neașteptat de mic adipocite diferențiate (Figura S2). Pentru a determina dacă PRR adipocit a fost implicat în diferențierea adipocitelor, PRR a fost redus la tăcere in vitro în celulele 3T3-L1 (Figura S3). Au fost evaluate PPARγ, o genă importantă implicată în diferențierea adipocitelor și proteina 4 care leagă acidul gras (Fabp4 sau aP2), un marker pentru adipocite diferențiate și o proteină purtătoare pentru acizii grași. Abundența de ARNm PPARγ și Fabp4 au fost semnificativ reduse în celule siPRR diferențiate în comparație cu celulele de control.
Deficitul de adipocite PRR a redus masa grasă la șoarecii hrăniți cu o dietă standard. (A) Curbele greutății corporale ale șoarecilor PRR fl/Y și PRR Adi/Y. Datele sunt medii ± SEM de 4 până la 6 șoareci. (B) Masa grasă (% din greutatea corporală) pentru șoareci din fiecare grupă. Datele sunt medii ± SEM de 4 până la 6 șoareci. * P fl/Y .
Greutatea țesuturilor la ficat, splină și pancreas a fost semnificativ mai mare la șoarecii PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Tabelul S1). Concentrațiile plasmatice de leptină au fost mai mici la șoarecii PRR Adi/Y decât la șoarecii PRR fl/Y (Tabelul S1). Toleranța la glucoză nu a diferit între genotipuri în săptămânile 5, 9 sau 13 ale experimentului (Figura S4).
Deficitul specific de adipocite al PRR a declanșat acumularea de lipide la ficatul șoarecilor masculi hrăniți cu o dietă standard
Examinarea microscopică a secțiunilor hepatice a evidențiat o creștere a acumulării de grăsime hepatică cuprinzând vacuole mici și mari de grăsime la șoarecii PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Figura S5). Lipidele neutre au fost semnificativ crescute în ficatul șoarecilor PRR Adi/Y comparativ cu șoarecii PRR fl/Y. Trigliceridele plasmatice nu au diferit semnificativ între grupuri (Tabelul S1).
Deficitul specific de adipocite al PRR a crescut tensiunea arterială sistolică la șoarecii masculi hrăniți cu o dietă standard
SBP și presiunea pulsului au fost semnificativ mai mari la șoarecii PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Figura 3). Presiunea arterială medie, tensiunea arterială diastolică și ritmul cardiac nu au diferit semnificativ între grupuri (Tabelul S2).
Deficitul de PRR adipocitar a crescut tensiunea arterială sistolică (SBP; 24 ore) la șoarecii care au primit o dietă standard. (A) SBP (24 ore) pentru șoareci PRR fl/Y și PRR Adi/Y șoareci. Datele sunt medii ± SEM la 4 șoareci. * Șoareci P fl/Y.
Deficitul specific de adipocite al PRR a crescut concentrațiile plasmatice de sPRR
Deficitul specific de adipocite al PRR nu a modificat concentrația plasmatică a AGT (Figura 4A). Activitatea reninei plasmatice (PRA) și concentrația reninei plasmatice (PRC) nu au diferit semnificativ între șoarecii PRR Adi/Y și șoarecii PRR fl/Y (Figura 4B), sugerând că deficiența specifică a adipocitelor PRR nu a influențat AGT, PRA sau PRC . În mod surprinzător, nivelurile plasmatice de sPRR au crescut de trei ori la șoarecii PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Figura 4C).
Deficitul de PRR adipocitar a crescut sPRR plasmatic. (A) Concentrații plasmatice de AGT la șoareci masculi PRR fl/Y și PRR Adi/Y. (B) Activitatea reninei plasmatice (PRA; axa y stângă) și concentrațiile (PRC; axa y dreaptă) la șoarecii PRR fl/Y și PRR Adi/Y. (C) Concentrațiile plasmatice sPRR la șoarecii PRR fl/Y și PRR Adi/Y șoareci. Datele sunt medii ± SEM de 4 până la 6 șoareci. * Șoareci P fl/Y.
Deficitul specific de adipocite al PRR a împiedicat dezvoltarea obezității și acumularea de masă grasă la șoarecii cu hrană bogată în grăsimi
Șoarecii PRR Adi/Y au fost rezistenți la obezitatea indusă de dieta HF (Figura 5A). Masa grasă a șoarecilor PRR Adi/Y a fost mai mică cu aproximativ -70% comparativ cu șoarecii PRR fl/Y hrăniți cu LF și a fost mai mică cu aproape -80% comparativ cu șoarecii PRR fl/Y hrăniți cu HF (Figura 5B). Atunci când a fost provocat cu o dietă HF, greutățile țesuturilor la ficat, inimă și rinichi au fost semnificativ mai mari la șoarecii PRR Adi/Y comparativ cu șoarecii PRR fl/Y (Tabelul S3). Deficitul de adipocite PRR nu a afectat în mod semnificativ structura rinichilor (Figura S6). Șoarecii PRR Adi/Y hrăniți cu HF și LF au crescut acumularea de lipide în ficat în comparație cu șoarecii PRR fl/Y (Figura S7). Deficitul de adipocite-PRR nu a modificat nivelurile de ARNm PRR la rinichi și ficat (Figura S8A și S8B). Dieta HF a indus o creștere semnificativă a colesterolului plasmatic, care nu a diferit între genotipuri.
Deficitul de adipocite PRR a împiedicat dezvoltarea obezității și scăderea masei grase. (A) Curba greutății corporale a șoarecilor PRR fl/Y și PRR Adi/Y hrăniți cu o dietă cu conținut scăzut de grăsimi (LF) sau cu conținut ridicat de grăsimi (HF). Datele sunt medii ± SEM de la n = 5 la 8 șoareci/grup. (B) Masa grasă și slabă (% din greutatea corporală) a șoarecilor PRR fl/Y și PRR Adi/Y hrăniți cu o dietă LF sau HF. Datele sunt medii ± SEM de 3 până la 8 șoareci.
Când este provocat de dieta HF, deficitul specific de adipocite al PRR a îmbunătățit homeostazia glucozei
Toleranța la glucoză nu a diferit între genotipuri după 16 săptămâni de dietă LF (Figura S9A și S9B). Cu toate acestea, șoarecii PRi Adi/Y hrăniți cu HF au prezentat o toleranță îmbunătățită la glucoză în comparație cu șoarecii PR/fl/Y hrăniți cu HF. Nivelurile de glucoză la jeun au fost semnificativ mai mici la șoarecii PRR Adi // Y hrăniți cu HF sau LF comparativ cu șoarecii PRR fl/Y (Figura S9C). Deficitul de adipocite-PRR a indus o creștere semnificativă a nivelului de insulină plasmatică indiferent de dietă (Tabelul S3).
În ciuda rezistenței la obezitate indusă de dietă HF, deficitul specific de adipocite al PRR a crescut în continuare SBP
Deficitul specific de adipocite al PRR a indus o creștere semnificativă a SBP la șoarecii hrăniți cu LF (Figura 6). Creșterea SBP, rezultată din deficiența PRR, a fost în continuare agravată atunci când șoarecii PRR Adi/Y au fost hrăniți cu o dietă HF. Aceste date sugerează că deficiența specifică adipocitelor a PRR a agravat creșterea indusă de dietă HF a SBP. Presiunea arterială medie și ritmul cardiac au fost mai mari la șoarecii PRR Adi/Y, indiferent de dietă (Tabelul S4 și S5).
Deficitul de PRR adipocitar crește exagerat tensiunea arterială indusă de dietă. SBP (24 ore) de șoareci PRR fl/Y și PRR Adi/Y hrăniți cu o dietă cu conținut scăzut de grăsimi (LF) sau cu conținut ridicat de grăsimi (HF). Datele sunt medii ± SEM de la n = 5 la 8 șoareci. * Șoareci P fl/Y.
La șoarecii obezi, deficitul specific de adipocite al PRR a exagerat creșterea nivelului plasmatic al sPRR
Hrănirea cu conținut ridicat de grăsimi a indus o creștere semnificativă a concentrațiilor plasmatice de AGT la șoarecii de control PR/fl/Y (Figura 7A). Cu toate acestea, concentrațiile plasmatice de AGT nu au diferit între șoarecii PRR Adi/Y și PRR fl/Y, indiferent de dietă. PRA nu a fost influențată de dietă sau de deficit de PRR specific adipocitelor (Figura 7B). Când au fost provocați cu dieta HF, șoarecii PRR fl/Y au prezentat o PRC mai mică și o concentrație totală mai mică de prorenină/renină decât șoarecii PRR fl/Y hrăniți cu LF (Figura 7B, Tabelul S3). PRC și concentrația totală de prorenină/renină la șoarecii PRi Adi/Y hrăniți cu LF și HF nu au diferit de cei ai șoarecilor PR/fl/Y hrăniți cu LF.
(A) Concentrațiile plasmatice de AGT la șoarecii PRR fl/Y și PRR Adi/Y șoareci hrăniți cu o dietă LF sau HF. (B) Activitatea reninei plasmatice (PRA; axa y stângă) și concentrația (RPC; axa y dreaptă). (C) Concentrația plasmatică sPRR. Datele sunt medii ± SEM de 5 până la 8 șoareci. * Șoareci P fl/Y.
Nivelurile sPRR plasmatice au fost semnificativ crescute la șoarecii PRi Adi/Y hrăniți cu LF comparativ cu șoarecii PR/fl/Y hrăniți cu LF. Hrănirea cu HF a indus o creștere de trei ori a nivelurilor plasmatice sPRR la șoarecii PRR fl/Y alimentați cu HF comparativ cu șoarecii PRR fl/Y hrăniți cu LF (Figura 7C). Nivelurile sPRR plasmatice au fost de peste două ori mai mari la șoarecii PRi Adi/Y hrăniți cu HF comparativ cu șoarecii PR/fl/Y hrăniți cu HF. Concentrația plasmatică sPRR a fost corelată pozitiv cu SBP (șoareci P fl/Y și PRR Adi/șoareci combinați (Figura S10A) și doar la șoareci PRR fl/Y; corelația a fost mai slabă (P> 0,05) la șoareci PRR Adi // Y singuri Cu toate acestea, nivelurile de insulină plasmatică nu au fost corelate cu SBP (Figura S10B).
Discuţie
Acest studiu a examinat rolul PRR derivat din adipocite în controlul tensiunii arteriale și consecințele fiziologice ale ștergerii PRR în adipocitele șoarecilor masculi în timpul dezvoltării obezității. Ștergerea PRR adipocitară a indus o reducere marcată a tuturor țesuturilor adipoase albe, fără distribuție anormală a tampoanelor de țesut adipos. Studiile in vitro au demonstrat că PRR reglează PPARγ și Fabp4. Lipodistrofia a fost însoțită de steatoză hepatică. Când au fost provocați cu hrănirea cu IC, șoarecii adiposi cu deficit de PRR au fost rezistenți la dezvoltarea obezității și au avut o toleranță îmbunătățită la glucoză. În ciuda absenței țesutului adipos alb și a rezistenței la obezitate indusă de dietă, șoarecii cu deficit de adipocite-PRR au avut tensiune arterială crescută. Această creștere a tensiunii arteriale la șoarecii cu deficit de adipocite PRR pare să fie independentă de concentrațiile sistemice de AGT și de renină. În mod surprinzător, concentrațiile plasmatice de sPRR au fost crescute odată cu dieta HF și crescute semnificativ la șoarecii cu deficit de adipocite PRR.
Ștergerea PRR adipocitelor a dus la o reducere a masei țesutului adipos și la o creștere a depunerii de lipide în ficat, sugerând lipodistrofia însoțită de steatoză hepatică. Tăcerea PRR in vitro a relevat o scădere semnificativă a PPARγ și Fabp4 sugerând că PRR este un regulator principal al diferențierii adipocitelor. În plus, deoarece proteinele care leagă acizii grași sunt purtători importanți pentru absorbția acizilor grași și transportul acizilor grași către locurile de esterificare în trigliceride, datele noastre 27 sugerează un rol important al PRR în traficul de acizi grași și stocarea în adipocite.
Fenotipul nostru a fost observat în alte modele de lipodistrofie, cum ar fi modelele de șoarece transgenic A-ZIP/F, aP2/DTA, SREBP-1c sau distrofie hepatică grasă (fld). 28,29 În schimb, șoarecii PRR Adi/Y hrăniți cu o dietă HF au demonstrat o sensibilitate mult mai mare la glucoză decât șoarecii martor hrăniți cu HF. Rezultatele noastre diferă de cele ale altor modele de lipodistrofie la șoareci, în care se observă frecvent hiperglicemie și hipertrigliceridemie. În plus, nivelurile de insulină plasmatică la șoarecii PRR Adi/Y au crescut modest, iar șoarecii PRR Adi/Y nu au prezentat hiperinsulinemie severă. Datele noastre sunt totuși în concordanță cu fenotipul modelului de șoarece PPARγ P465L/+ 30, care a avut o capacitate îmbunătățită de a răspunde la supraîncărcarea acută de glucoză în comparație cu controalele atunci când a fost provocată de alimentarea cu IC. După cum sugerează Tsai și colab., 30 expansiunea insulelor pancreatice ar putea contribui la această reacție crescută la glucoză. Similar modelului nostru, modelul CGI-58β mouse 31 a dezvoltat steatoză hepatică, dar a fost protejat împotriva obezității și intoleranței la glucoză. O reducere a greutății corporale ar fi putut contribui, de asemenea, la o sensibilitate mai bună la glucoză.
Șoarecii PRR Adi/Y au prezentat tensiune arterială crescută similară cu cea raportată la șoarecii PPARy P465L/+ și la oamenii care exprimă mutații FPLD2 și FPLD3. 28-30 În ultimele cazuri, cauza creșterii tensiunii arteriale nu este bine înțeleasă. Creșterea leptinei a fost asociată cu tensiunea arterială crescută 32, dar ar putea proteja împotriva bolilor hepatice grase nealcoolice 33. Astfel, deși este puțin probabil ca nivelurile scăzute de leptină circulantă la șoarecii PRR Adi/Y să fi putut contribui la creșterea tensiunii arteriale, nivelurile scăzute de leptină circulantă ar fi putut contribui la dezvoltarea steatozei hepatice.
Rezistența la insulină poate determina creșterea tensiunii arteriale, astfel niveluri ridicate de insulină ar fi putut participa la creșterea SBP la șoarecii PRR Adi/Y. 28 Cu toate acestea, rezultatele noastre au demonstrat că nivelurile de insulină nu au fost corelate cu SBP, sugerând că insulina crescută ar putea să nu fie originea tensiunii arteriale crescute. În schimb, am demonstrat că nivelurile sPRR plasmatice au crescut odată cu dezvoltarea hipertensiunii induse de obezitate. În mod surprinzător, creșterea concentrațiilor plasmatice de sPRR a fost agravată de deficitul de adipocite-PRR. Creșterea concentrației plasmatice a sPRR în timpul sarcinii timpurii a fost raportată pentru a prezice atât hipertensiunea, cât și riscul de preeclampsie la femeile gravide. Mai mult decât atât, pacienții cu insuficiență cardiacă au niveluri sPRR plasmatice mai mari decât subiecții martor. 34 Cu toate acestea, demonstrația noastră a unei corelații pozitive între sPRR și SBP atunci când șoarecii martor și șoarecii PRR Adi/Y sunt combinați sau la șoarecii martor sugerează doar că sPRR ar putea juca un rol în controlul tensiunii arteriale. Au fost necesare investigații suplimentare cu privire la efectul direct al sPRR asupra SBP. Inima, creierul, ficatul, rinichii și mușchiul neted exprimă gena PRR și ar putea participa la eliberarea sPRR sau pot fi țesuturi țintă potențiale. 13–18.34
Perspective
Remarcabilul fenotip al modelului de șoarece cu deficit de adipocite-PRR demonstrează importanța PRR adipocitelor în homeostazia lipidelor și glucozei și insulinei. Rezultatele noastre demonstrează necesitatea PRR adipocitelor în dezvoltarea normală a țesutului adipos, dincolo de rolul său potențial în activarea RAS locală. Sunt necesare investigații suplimentare pentru a determina mecanismul prin care PRR reglează formarea celulelor adipoase și homeostazia lipidică și tensiunea arterială.
- Kvass de sfeclă; Curățător de ficat și tonic de sânge - Rebel alimentar real
- Un atac hepatic duce la o viață mai simplă - The New York Times
- 10 cele mai bune alimente de mâncat după donarea de sânge - Celeb sănătos
- 5 pași dietetici pentru a scăpa de ficatul gras Vietnam Times
- Oțetul de mere pentru tensiunea arterială funcționează