Mina Desai
1 Laboratoare de cercetare perinatală, Departamentul de obstetrică și ginecologie, Școala de medicină David Geffen, Universitatea din California, Los Angeles, 200 Medical Plaza, Suites 430 și 200, Los Angeles, CA 90095, SUA;
2 Institutul de cercetare biomedicală din Los Angeles la Harbour-UCLA Medical Center, 1000 W. Carson Street, Torrance, CA 90509, SUA.
Marie Beall
3 Los Angeles Perinatal Association, Los Angeles, CA, SUA
Michael G. Ross
1 Laboratoare de cercetare perinatală, Departamentul de obstetrică și ginecologie, Școala de medicină David Geffen, Universitatea din California, Los Angeles, 200 Medical Plaza, Suites 430 și 200, Los Angeles, CA 90095, SUA;
2 Institutul de cercetare biomedicală din Los Angeles la Harbour-UCLA Medical Center, 1000 W. Carson Street, Torrance, CA 90509, SUA.
Abstract
Epidemia sindromului metabolic, inclusiv o creștere semnificativă a prevalenței obezității și a diabetului gestațional gestational (GDM) la femeile gravide, reprezintă o problemă semnificativă de sănătate publică. Există o recunoaștere din ce în ce mai mare că riscul obezității la adulți este în mod clar influențat de expunerile mediului prenatal și infantil, în special de nutriție. Acest principiu este baza fundamentală a programării de dezvoltare. Greutatea redusă la naștere, împreună cu creșterea recuperării copiilor, este asociată cu un risc semnificativ de obezitate la adulți. Expunerea la obezitate maternă, cu sau fără GDM, sau având o greutate mare la naștere reprezintă, de asemenea, un risc crescut pentru obezitate la copil și adult. Modelele animale au reprodus constatări epidemiologice umane și au elucidat mecanisme potențiale de programare care includ dezvoltarea modificată a organelor, răspunsurile de semnalizare celulară și modificările epigenetice. Îngrijirea prenatală a făcut pași mari în optimizarea sănătății materne, fetale și neonatale și are acum oportunitatea de a începe intervenții care previn sau reduc obezitatea copiilor/adulților. Liniile directoare care integrează nutriția optimă a sarcinii și creșterea în greutate, gestionarea GDM și strategiile de hrănire a nou-născuților, cu consecințe pe termen lung asupra obezității adulților, rămân a fi elucidate.
Introducere
Este dificil să supraestimăm semnificația epidemiei de obezitate globală în continuă dezvoltare, a patologiilor rezultante care se dezvoltă și a impactului lor colectiv asupra sănătății, bunăstării și calității vieții. Obezitatea și bolile asociate acesteia sunt principala cauză de deces în societatea occidentală. În prezent, 65% dintre adulții din Statele Unite sunt supraponderali și mai mult de o treime sunt obezi [1], reprezentând o criză modernă de sănătate. Mai rău, datele epidemiologice indică faptul că obezitatea continuă să crească neîncetat, în special în rândul negrilor și hispanilor. În paralel, rata diabetului zaharat de tip 2 (DM) crește în Statele Unite și în întreaga lume [2]. De îngrijorare pentru obstetricieni, există o creștere marcată și continuă a prevalenței obezității și a DM gestațional (GDM) la femeile gravide
30%) [3,4], un factor asociat atât cu nou-născuții cu greutate mare la naștere, cât și un factor de risc cunoscut pentru obezitatea infantilă [5,6]. Deoarece obezitatea la copii este un factor major de risc pentru obezitatea la adulți [7], incidența cu 20% a obezității la copii [8] prezice o creștere suplimentară a prevalenței obezității la adulți și a DM.
Obezitatea este deseori atribuită unei diete bogate în grăsimi în stil occidental combinată cu niveluri scăzute de activitate. Deși există puține îndoială că acești factori sunt factori determinanți puternici ai obezității, sustenabilitatea pe termen lung a dietei, combinată cu exercițiile fizice, s-au dovedit în mare parte nereușite. În ultimii ani, există date convingătoare din laboratorul nostru și altele care susțin conceptul că originile obezității încep in utero. Deoarece fătul în curs de dezvoltare depinde de mediile nutriționale, hormonale și metabolice materne, orice perturbare care „programează” structura organelor, compoziția celulară, expresia genică și/sau epigenomul poate modifica în cele din urmă metabolismul și funcția. Important, interacțiunile cu mediul postnatal și creșterea neonatală modulează și mai mult susceptibilitatea la obezitate. Această revizuire se concentrează pe influența creșterii prenatale/neonatale și a adipogenezei în originile de dezvoltare ale obezității.
Nutriție și creștere
Creșterea țesuturilor și a organelor în timpul dezvoltării implică proliferarea, diferențierea și migrarea celulelor în structuri organizate. La om, la fel ca la alte specii de mamifere, cea mai mare parte a procesului de dezvoltare referitoare la diviziunea celulară are loc în timpul vieții intrauterine, subliniind necesitatea unui mediu optim în utero. Prin urmare, fără îndoială, nutriția este una dintre pietrele de temelie ale creșterii, dezvoltării și sănătății. Meritul suplimentării nutriționale, în special în timpul sarcinii, este evident, așa cum s-a demonstrat cu suplimentarea cu iod și folat în prevenirea cretinismului indus de deficiența de iod și, respectiv, a spinei bifide. Domeniul originilor de dezvoltare ale bolilor adulte a încorporat acest fenomen și prezice că nutriția maternă sub-optimă are impact asupra creșterii fetale, ducând la boli adulte. În plus față de influențele nutriționale, factori, inclusiv GDM, stresul matern, nașterea prematură și terapia cu glucocorticoizi materni, printre altele, pot avea un impact semnificativ asupra sănătății și bolilor adulților. Dovezi pentru conceptul de programare a sănătății și a bolilor sunt furnizate atât de studii la om, cât și de modele pe animale care au folosit greutatea la naștere ca măsură imediată pentru creșterea și dezvoltarea in utero.
Influența maternă asupra greutății la naștere
Dincolo de potențialul genetic al fătului, nutriția maternă, oxigenarea și perfuzia placentară au efecte predominante asupra greutății la naștere. Modelele animale care utilizează restricția maternă a nutrienților, ligarea arterelor uterine placentare sau expunerea la glucocorticoizi au reprodus efectiv rezultatele asociate cu greutatea redusă la naștere (LBW) [9-12]. În schimb, supranutriția maternă, rezultată din obezitate, dietă bogată în grăsimi sau creșterea excesivă în greutate în timpul sarcinii, a raportat efecte variabile asupra greutății la naștere. Cu toate acestea, descendenții adulți prezintă în mod constant obezitate și anomalii metabolice [13-15], dovezi ale programării in utero. Descendenții femeilor cu GDM sunt în mod constant mai mari decât martorii normali, cu greutatea la naștere proporțională cu nivelurile medii de glucoză [16].
În prezent, nu se știe dacă efectele de programare ale macrosomiei asociate GDM diferă de cele ale obezității materne.
Asocierea între greutatea la naștere și obezitate
Studiile epidemiologice și modelele pe animale leagă greutatea la naștere de riscul de obezitate la adulți și sindromul metabolic, inclusiv rezistența la insulină. În special la om, greutatea la naștere atât scăzută, cât și ridicată duce la un risc crescut pentru obezitate la copil și la adulți, sugerând un risc crescut de obezitate la ambele capete ale spectrului de greutate la naștere [17,18].
Greutate mare la naștere
Obezitatea în timpul sarcinii are nu numai efecte adverse asupra sănătății mamei și a rezultatului sarcinii, ci și asupra fătului în curs de dezvoltare. Mai exact, obezitatea maternă înainte și în timpul sarcinii, inclusiv creșterea în greutate crescută în timpul sarcinii, a fost asociată cu o greutate mai mare la naștere [16,19], precum și cu nou-născuți cu greutate mai mică la naștere, cu atât mai târziu rezultă o parte a riscului crescut de naștere prematură 20]. Creșterea cu 25-36% a IMC matern în ultimul deceniu s-a tradus într-o creștere cu aproximativ 25% a incidenței copiilor cu greutate mare la naștere [21]. Acest lucru este deosebit de important, deoarece nou-născuții cu greutate ridicată la naștere prezintă o creștere a masei țesutului adipos și un risc crescut de obezitate și risc de diabet în viața ulterioară (revizuire [22]). Cu toate acestea, atât studiile efectuate la om, cât și la animale, indică faptul că IMC crescut în maternitate la maternitate și creșterea excesivă în greutate maternă în timpul sarcinii sunt predictori mai mari ai obezității descendenților decât greutatea mare la nou-născut [5,23,24]. Deoarece majoritatea femeilor GDM au obezitate însoțitoare, efectele independente de programare ale GDM sunt incerte.
Greutate redusă la naștere
Studiile epidemiologice timpurii au demonstrat inițial că sugarii LBW cu o creștere rapidă a recuperării au un risc mai mare de obezitate și sindrom metabolic. Prevalența sindromului metabolic a crescut progresiv atât la bărbați, cât și la femei, de la cei care au avut cel mai mare nivel la cei care au avut cele mai mici greutăți la naștere. Dintre bărbații în vârstă de 64 de ani ale căror greutăți la naștere erau de 6,5 kilograme sau mai puțin, 22% aveau sindrom metabolic. Cei cu cea mai mică greutate la naștere au avut de 10 ori mai multe șanse de a avea sindrom metabolic în comparație cu cei care au fost cei mai grei la naștere [25,26]. Rata redusă a obezității la sugarii mai grei (născuți între 1935-1943) sugerează în plus că obezitatea maternă și dieta sarcinii/creșterea în greutate au un efect mai mare asupra programării obezității descendenților decât greutatea la naștere. Numeroase studii epidemiologice de la diverse populații confirmă această relație [17].
Curba în formă de U
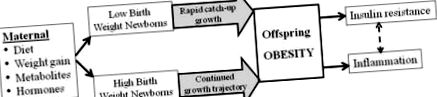
Studiile epidemiologice confirmă faptul că relația dintre greutatea la naștere la om și obezitatea adultă, hipertensiunea și/sau rezistența la insulină este o „curbă în formă de U” [27-30]. Poate cel mai important, relația creșterii fetale cu obezitatea descendentă și sindromul metabolic este un continuum [25], mai degrabă decât un răspuns de prag. S-ar putea să existe o greutate optimă la nou-născut (potențial specifică unei mame individuale) la care programarea potențialului de obezitate este minimizată. Cu toate acestea, în limitele greutăților la naștere mai mici sau mai mari în comparație cu valorile medii, studiile indică o gradație a înclinației către programarea sechelelor. Astfel, abaterile de la „optimă” în creșterea uterului, fie că este vorba de o nutriție limitată sau excesivă, cresc riscul relativ de sindrom metabolic la adulți (Figura 1).
Modificarea nutriției materne, mediul hormonal sau metabolit afectează creșterea fetală, ducând la nou-născuți cu greutate mică sau mare la naștere. Ca urmare a acestei abateri de creștere in utero combinată cu o creștere postnatală accelerată/similară provoacă o adipogeneză sporită, ducând la obezitate la copil și la adult. La rândul său, obezitatea duce la rezistență la insulină și inflamație.
Risc aditiv de creștere a recuperării postnatale
Deși efectele pe termen lung ale LBW sunt legate de obezitatea la adulți, mai multe studii au demonstrat efectele dăunătoare ale creșterii recuperării nou-născutului sau copilăriei în rândul sugarilor LBW (Figura 1). Acei sugari care se nasc mici și rămân mici prezintă un risc mai mic de obezitate și sindrom metabolic, apoi cei născuți mici care recuperează și depășesc greutățile normale până la copilărie sau la începutul adolescenței [31,32]. Important, copiii LBW sau prematuri cu creștere de recuperare în timpul vieții timpurii au o masă corporală mai slabă și o grăsime corporală mai mare, care prezintă o distribuție abdominală predominantă [33,34]. Un fenomen similar se observă la nou-născuții cu greutate normală la naștere, care prezintă o creștere accelerată în greutate în primii doi ani de viață [35].
Aceste descoperiri au fost replicate cu succes în modele animale folosind restricție prenatală de nutrienți pentru a produce nou-născuți LBW, urmată de asistență medicală normală pentru a promova creșterea recuperării. Ca adulți, descendenții LBW nu numai că au greutăți corporale și grăsimi corporale mai mari [36-39], dar prezintă o susceptibilitate mai mare la diete bogate în grăsimi [40]. În schimb, prevenirea creșterii recuperării la nou-născuții LBW previne un fenotip adult obez [37]. Aceste rezultate sugerează că gradul de îmbunătățire a nutrienților nou-născuți și momentul creșterii recuperării nou-născuților poate determina programarea obezității descendenților [37,41]. O întrebare fundamentală care se pune este ce mecanism reglementează captarea preferențială a grăsimii [42] la acești descendenți. Din nou, modelele animale au oferit o perspectivă inițială conform căreia factorii prenatali duc la programarea hiperfagiei, reducerea cheltuielilor de energie și/sau adipogeneza îmbunătățită, care au ca rezultat o tendință de acumulare de grăsime la descendenți [43-46].
Creșterea recuperării și acumularea de grăsime
Adipocitele sunt celule extrem de specializate care mențin homeostazia energiei întregului corp prin reglarea metabolismului glucozei și lipidelor [47]. Mai recent, adipocitele au fost recunoscute pentru rolul lor în inflamație și răspunsul imun [48]. Țesutul adipos conține subtipuri celulare distincte funcțional, cu adipocite albe care servesc drept depozite de stocare a energiei, în timp ce adipocitele maronii disipă energia prin termogeneză. Depozitarea grăsimilor este facilitată de insulină care stimulează absorbția glucozei adipocitare și lipogeneza. Modificarea fie a masei țesutului adipos, a creșterii acizilor grași liberi circulanți și/sau a împărțirii combustibilului în adipocite poate duce la dislipidemie, obezitate, rezistență la insulină și DM.
Creșterea masei grase sau adipogeneza are loc în primul rând în timpul dezvoltării prenatale și postnatale, deși unele adipogeneze continuă pe tot parcursul maturității [49]. Procesul de adipogeneză implică diferențierea preadipocitelor de adipocite mature care pot stoca grăsimea. Calea de diferențiere este strâns reglementată de o cascadă de factori de transcripție care sunt evidențiați în preadipocite și sunt exprimați secvențial ca răspuns la stimuli (substanțe nutritive, hormoni) probabil sub influența mecanismului epigenetic (Figura 2). Obezogenii, inclusiv factorii de mediu, au potențialul de a modifica căile adipogene cheie, inclusiv factorii de transcripție adipogenă, prin modificări epigenetice ale promotorilor sau histonelor [50].
Adipogeneza este un proces de diferențiere celulară prin care preadipocitele devin adipocite. Creșterea aportului de nutrienți sau niveluri hormonale ridicate (de exemplu, insulină, corticosteron, IGF1) stimulează proliferarea și diferențierea celulelor. Inducerea diferențierii adipocitelor este facilitată de factorul de transcripție adipogenă (PPARg) și depozitarea grăsimilor prin factorul de transcripție lipogenă (SREBP1). Creșterea adipogenezei este asociată cu scăderea infiltrării macrofagelor și creșterea secreției de pro-diabetice (TNFα, IL-6, leptină, visfatină) cu scăderea secreției de adipocitokine antidiabetice (adiponectină).
Reglarea adipogenezei și lipogenezei
Inducerea diferențierii adipocitelor este determinată de factorii de transcripție PPAR (receptorul activat cu proliferatorul peroxizomului) și C/EBP (proteinele care leagă CCAAT-amplificator) [51-53]. Dintre aceștia, principalul factor de transcripție adipogenă, PPAR 2γ induce factorul de transcripție lipogenă SREBP1 (proteina de legare a elementului de reglare a sterolului) inițind astfel diferențierea adipocitelor și lipogeneza [54-56]. SREBP1 poate activa, de asemenea, PPARγ, atât prin stimularea producției unui ligand endogen [57], cât și prin inducerea activității promotorului PPAR [54,57]. Aceste date sugerează un mecanism feed-forward, în care PPAR activează SREBP1 și viceversa și care vizează promovarea adipogenezei și lipogenezei [55]. SREBP1 facilitează lipogeneza prin inducerea enzimei lipolitice extracelulare (lipoproteina lipază) și a enzimei lipogene (sintază a acidului gras) care, la rândul său, duce la o creștere a absorbției și sintezei de acizi grași, favorizând acumularea de lipide în adipocit [58,59]. Eliberarea de acizi grași liberi din adipocite este facilitată de o enzimă lipolitică intracelulară, lipază sensibilă la hormoni [60].
Sinteza acizilor grași (prin lipogeneză de novo) și a trigliceridelor sunt factori importanți în acumularea de grăsimi. Trigliceridele destinate depozitării grăsimilor în țesutul adipos sunt compuse din acizi grași din surse alimentare și din sinteză de novo. Acizii grași sintetizați de novo pot suferi modificări prin crearea de legături duble prin desaturare și/sau prelungire suplimentară prin alungirea lanțului. În timp ce sinteza de novo și alungirea lanțului promovează stocarea energiei, defalcarea acizilor grași prin scurtarea lanțului și β-oxidarea promovează eliberarea de energie. Deoarece trigliceridele sunt încorporate în țesutul adipos pentru depozitare, o creștere a raportului de acizi grași mononesaturați la saturați, prin urmare, crește înclinația pentru depozitarea grăsimilor [61].
Perturbarea rețelei metabolice poate deplasa echilibrul energetic către o eliberare crescută de energie sau, ca în cazul obezității, o creștere a stocării energiei. Studiile pe animale oferă o oarecare perspectivă asupra bazei mecanice care stau la baza adipogenezei/lipogenezei îmbunătățite programate sau a modificării funcției/răspunsului adipocitelor.
Efectele creșterii adipogenezei asupra DM la descendenți
S-a demonstrat că acumularea crescută de grăsimi, în special grăsimea viscerală, determină alterarea metabolismului glucozei și lipidelor, ducând la rezistența la insulină și DM [62]. Baza mecanicistă de bază implică perturbarea producției de „adipocitokine” derivate din adipoză care modulează sensibilitatea la insulină. În starea obeză, țesutul adipos secretă proporțional mai multe adipokine care provoacă rezistență la insulină (de exemplu, TNFα, IL-6, leptină) și mai puține care promovează sensibilitatea la insulină (de exemplu, adiponectină) [63-65]. Într-adevăr, numeroase studii la om au confirmat că creșterea nivelului plasmatic de TNFα, IL-6 și leptină și scăderea nivelului plasmatic de adiponectină sunt asociate cu obezitatea/rezistența la insulină [66-69] Această relație a fost recent demonstrată în obezitatea infantilă, sugerând că adipocitokinele pot ca markeri timpurii ai dezvoltării DM [68,70].
LBW Descendenți
Deoarece aceste modificări sunt evidente la începutul vieții, sugerează o cale programată de diferențiere crescută a adipocitelor și lipogeneză, care probabil promovează dezvoltarea obezității și a DM la descendenții LBW (Figura 2).
Obezitate maternă/progenituri cu dietă bogată în grăsimi
Programarea țesutului adipos ca urmare a supranutriției in utero implică probabil o interacțiune a efectelor: obezitate maternă preexistentă, creștere în greutate maternă în timpul sarcinii, dietă occidentală bogată în grăsimi și grade diferite de intoleranță la glucoză maternă. Programarea adipogenezei poate apărea în prezența absenței unei greutăți crescute la nou-născuți. Studiile mecaniciste limitate privind adipogeneza programată din cauza obezității materne sau a unei diete bogate în grăsimi arată un fenotip remarcabil de asemănător cu descendenții LBW. Aceasta include expresia crescută a PPAR în țesutul adipos fetal și nou-născut [82,83], precum și expresia crescută a enzimelor care mediază biosinteza acizilor grași [84].
Implicații și concluzii clinice
Mulțumiri
Lucrările noastre raportate sunt susținute de National Institutes of Health Grants R01DK081756 și R01HD054751.
- Dovezi pentru un rol al genelor de dezvoltare în originea obezității și a distribuției grăsimii corporale PNAS
- Clasa 8A - Nutriție și sănătate - Întrebări din partea elevilor pentru examenul 1 Cum să vindeci obezitatea
- Frontiere Transdisciplinare Obezitatea Prevenirea Științelor Cercetării (TOPRS) Creșteri curriculare
- Frontierele Zinc-α2-Glicoproteina sunt asociate cu obezitatea la populația chineză și cu obezitatea indusă de HFD
- Efectul tărâței de orez nesaponificabile asupra dietei bogate în grăsimi - obezitatea indusă la șoareci - Șuncă - 2015 - Jurnal