Annette Kuehn
1 Laborator de imunogenetică și alergologie, Centrul public de cercetare pentru sănătate (CRP-Santé), Luxemburg, Luxemburg
Ines Swoboda
2 Secția de biotehnologie moleculară, Universitatea de Științe Aplicate, Viena, Austria
Karthik Arumugam
1 Laborator de imunogenetică și alergologie, Centrul public de cercetare pentru sănătate (CRP-Santé), Luxemburg, Luxemburg
Christiane Hilger
1 Laborator de imunogenetică și alergologie, Centrul public de cercetare pentru sănătate (CRP-Santé), Luxemburg, Luxemburg
François Hentges
1 Laborator de imunogenetică și alergologie, Centrul public de cercetare pentru sănătate (CRP-Santé), Luxemburg, Luxemburg
3 Unitatea de imunologie și alergologie, Centre Hospitalier de Luxembourg, Luxemburg, Luxemburg
Abstract
Alergie la pești
Prevalenta
În dieta umană, peștele este o sursă valoroasă de aminoacizi esențiali, acizi grași polinesaturați și vitamine liposolubile. Deși consumul de pește în țările europene este destul de stabil, cererea globală pentru pește și produse din pește crește în continuare constant (1). În timp ce multe surse din literatură indică faptul că alergiile la pești sunt în creștere, prevalența reală nu este bine stabilită, deoarece majoritatea studiilor se bazează pe alergii alimentare auto-raportate (2). Se estimează că până la 0,2% din populația generală este afectată de alergia la pești (3, 4). Cu toate acestea, expunerea la pești este un factor important care determină prevalența raportată a alergiilor la pești. Prin urmare, prevalența alergiilor la pește este mai mare în țările cu consum ridicat de pește și industriile de prelucrare a peștelui (5).
Caracteristici clinice
Diagnosticul și îngrijirea pacientului
Procedura de diagnostic se bazează pe patru piloni principali: istoricul clinic al pacientului, analiza in vivo a reactivității pielii, cuantificarea in vitro a IgE serice specifice și, în cazuri selectate, provocările provocării orale. O gamă largă de pești este consumată la nivel global, dar doar un număr limitat de extracte comerciale sunt disponibile pentru testarea pielii. Prin urmare, peștele proaspăt sau procesat este frecvent utilizat pentru această analiză in vivo. Cu toate acestea, valoarea predictivă a testelor cutanate este scăzută (28). Pentru analiza in vitro a nivelurilor specifice de IgE, sistemul ImmunoCAP (ThermoScientific) oferă un panou larg de extracte de pește. Între timp, două parvalbumine recombinate din crap și cod sunt disponibile pentru acest test de diagnostic. Valoarea predictivă a măsurătorilor IgE specifice extractului de pește nu este bine stabilită, dar un titru ridicat de IgE specific (20 kUA/L) a fost raportat pentru a prezice o alergie la cod cu o probabilitate de 95% (29).
Alte reacții adverse pot fi diagnosticate greșit ca alergii la pești (30). Simptomele asemănătoare alergiilor apar la ingestia de pești răsfățați cu histamină („otrăvire a peștilor scombroizi”) (31). De asemenea, consumul de pește contaminat cu parazitul Anisakis simplex (vierme hering) provoacă manifestări alergice acute cauzate de sensibilizarea mediată de IgE la alergeni Anisakis (27, 32).
Pentru a evita reacțiile severe, gestionarea alergiilor la pești se bazează pe eliminarea fiecărui produs din pește din dieta pacientului sensibilizat. În unele cazuri, s-a raportat că pacienții își pot pierde sensibilitatea la eliminarea dietei (33, 34). Desensibilizarea terapeutică la pești a fost raportată doar pentru un singur caz (35). Dezvoltarea unor imunoterapeutice specifice bazate pe variante hipoalergenice de parvalbumine, alergenii majori la pești, sunt în centrul studiilor în curs (36, 37). Cercetările privind o strategie primară pentru prevenirea alergiilor la pești sunt foarte limitate. Recomandările actuale ale Academiei Americane de Alergie, Astm și Imunologie nu sugerează, de asemenea, o introducere generală, întârziată, a peștilor în dieta copiilor (38).
Alergeni de pește
Alergeni alimentari
Cele câteva alimente care sunt responsabile de provocarea celor mai multe reacții alergice sunt laptele, ouăle, arahidele, nucile, peștele, crustaceele, soia și grâul. Conțin alergeni alimentari puternici (39). Potența lor alergenică a fost legată de caracteristicile proteice specifice. Acești alergeni sunt foarte abundenți în surse alimentare și, în plus, au o stabilitate ridicată în procesarea și digestia alimentelor (40). Stabilitatea structurală a fost alocată diferitelor caracteristici proteice, cum ar fi legarea intrinsecă a ligandului și legăturile disulfurice intramoleculare (41). Unii alergeni alimentari formează agregate proteice de stabilitate ridicată. Deși unii alergeni alimentari sunt sensibili la digestia gastrică și intestinală, fragmentele de degradare sunt încă recunoscute de anticorpii IgE specifici (42). Alergenii alimentari de origine animală sunt grupați în principal în trei superfamilii proteice, cum ar fi cazeina, tropomiozinele și proteinele EF-hand (43).
Parvalbumine de pește
Parvalbuminele aparțin familiei de proteine EF-hand. Ca atare, ele conțin motive specifice mâinii EF compuse din 12 reziduuri de bucle lungi care sunt implicate în legarea ionilor metalici divalenți. Situl N-terminal al mâinii EF este un domeniu nefuncțional, în timp ce celelalte două motive ale mâinii EF sunt legate de ioni de calciu și magneziu (56). Rolul fiziologic al parvalbuminelor musculare este legat de reglarea concentrației intracelulare de calciu în timpul relaxării musculare (57). La legarea ionilor și eliberarea ionilor, structura beta-parvalbuminului este supusă unei rearanjări globale care indică o flexibilitate generală a domeniilor mâinii EF (58). Proteina apo, care este parvalbumină sărăcită în calciu, are o capacitate redusă de a lega anticorpii IgE de la pacienții alergici la pești (59). În consecință, aceste regiuni proteice de legare a calciului au fost atribuite epitopilor conformaționali ai celulelor B (60).
Începând de astăzi, baza de date oficială a alergenilor conține 21 de parvalbumine din 12 specii de pești 1 (Tabelul (Tabelul 1) 1) (61). Baza de date Allergome listează mai mult de 100 de intrări pentru parvalbumine de pești și izoformele/izoalergenii 2 (62). Acest număr mult mai mare provine dintr-o compilație de molecule omologe, potențial alergenice, pe lângă proteinele cu alergenicitate dovedită. Parvalbuminul a fost definit ca alergenul major la pești, deoarece majoritatea pacienților alergici la pești au anticorpi IgE care reacționează la această proteină musculară (63-65). Cu toate acestea, prevalența anticorpilor IgE specifici parvalbuminului pare să varieze în funcție de populațiile de pacienți. De exemplu, pacienții alergici la pești cu sensibilizare la peștii tropicali reacționează în principal la alergeni, alții decât parvalbuminele (66, 67). În general, reactivitatea încrucișată clinică ridicată la pești a fost atribuită anticorpilor IgE cu reacție încrucișată care recunosc parvalbuminele de la mai multe specii (68). Recent, monosensibilitatea clinică la peștii salmonizi a fost legată de anticorpi IgE specifici parvalbuminului salmonid, sugerând că reactivitatea încrucișată între parvalbuminele peștilor poate fi limitată la acești pești strâns înrudiți (23, 25).
tabelul 1
Intrări ale alergenilor oficiali la pești de către Uniunea Internațională a Societăților Imunologice, baza de date a subcomitetului pentru nomenclatura alergenilor (www.allergen.org).
| Clupeiforme | Clupea harengus (hering atlantic) | Clu h 1.0101 | Parvalbumin |
| Clu h 1.0201 | |||
| Clu h 1.0301 | |||
| Sardinops sagax (Pacific pilchard) | Sar este 1.0101 | Parvalbumin | |
| Cipriniforme | Cyprinus carpio (crap comun) | Cyp c 1.0101 | Parvalbumin |
| Cyp c 1.0201 | |||
| Gadiforme | Gadus callarias (cod baltic) | Gad c 1.0101 | Parvalbumin |
| Gad m 1.0101 | Parvalbumin | ||
| Gad m 1.0102 | |||
| Gad m 1.0201 | |||
| Gadus morhua (cod Atlantic) | Gad m 1.0202 | ||
| Gad m 2.0101 | Enolază | ||
| Gad m 3.0101 | Aldolaza | ||
| Perciforme | Calcariferul tardiv (barramundi) | Lat c 1.0101 | Parvalbumin |
| Lat c 1.0201 | |||
| Oreochromis mossambicus (tilapia) | Minereu m 4.0101 | Tropomiozina | |
| Thunnus albacares (ton cu aripioare galbene) | Joi, 1.0101 | Parvalbumin | |
| Joi, 2.0101 | Enolază | ||
| Joi, 3.0101 | Aldolaza | ||
| Xiphias gladius (pește-spadă) | Xip g 1.0101 | Parvalbumin | |
| Pleuronectiforme | Lepidorhombus whiffiagonis (megrim) | Lep w 1.0101 | Parvalbumin |
| Salmoniforme | Oncorhynchus keta (somon Pacific) | Onc k 5.0101 | Vitellogenina |
| Oncorhynchus mykiss (păstrăv curcubeu) | Onc m 1.0101 Onc m 1.0201 | Parvalbumin | |
| Salmo salar (somon atlantic) | Sal cu 1.0101 | Parvalbumin | |
| Sal s 2.0101 | Enolază | ||
| Sal cu 3.0101 | Aldolaza | ||
| Scorpaeniforme | Sebastes marinus (redfish) | Seb m 1.0101 | Parvalbumin |
| Seb m 1.0201 |
Enolasele și aldolazele de pește
Inițial, reactivitatea IgE la beta-enolază și aldolază a peștilor a fost descrisă la pești singuri (69-71). În 2013, 50 kDa enolaze și 40 kDa aldolaze au fost identificate ca alergeni importanți ai peștilor din cod, somon și ton (Tabelul (Tabelul 1) 1) (72). Ambele enzime sunt abundente în mușchiul peștilor, deoarece sunt implicate în glicoliza metabolică, degradarea zahărului în timpul producției fiziologice de energie.
Într-un studiu recent, legarea IgE de enolaze și aldolaze a fost detectată la un număr mare de pacienți alergici la pești (72). Majoritatea pacienților cu enolază/aldolază pozitivă au avut, de asemenea, anticorpi IgE împotriva parvalbuminei. Ambii alergeni au fost pozitivi în testul de eliberare a mediatorului utilizând celule de leucemie bazofilă de șobolan care exprimă receptorul IgE cu afinitate ridicată uman sensibilizat pasiv cu serurile pacientului. S-a constatat că sunt sensibili la tratamentul termic. Relevanța lor ca alergeni alimentari nu este încă bine înțeleasă, în special la pacienții cu parvalbumină negativă.
Gelatina de peste
Relevanța gelatinei de pește ca alergen alimentar a fost discutată controversat de mulți ani (4). Gelatina de pește este frecvent utilizată în produsele alimentare și farmaceutice care înlocuiesc gelatinele de mamifere (73).
Inițial, legarea IgE de colagenul de pește a fost demonstrată la pacienții alergici la pești (74, 75). Ulterior, prevalența peștilor alergici la gelatină a fost abordată în studii clinice unice (76, 77). Într-un studiu, testele de înțepare a pielii au fost pozitive la 3 din 30 de pacienți alergici la cod, în timp ce provocările alimentare au fost pozitive la unul dintre cei trei pacienți testați. De asemenea, potențialul său ca alergen alimentar a fost arătat într-un raport de caz de anafilaxie severă la ingestia de dulciuri care conțin câteva grame de gelatină de pește (78). Nici o reactivitate încrucișată a gelatinei de mamifere și pește nu a fost raportată până acum. Un alt factor de risc al gelatinei de pește este o potențială contaminare cu parvalbumină de pește, deoarece este produsă din pește ca sursă naturală. De fapt, urme de parvalbumină au fost detectate în isinglass, un supliment alimentar pe bază de colagen pește (79).
Alte proteine de pește reactive la IgE
În ultimele decenii, numeroase studii au raportat alergeni diferiți de parvalbumin, care au fost specificați prin greutatea lor moleculară sau identificați prin alte metode. Deși majoritatea studiilor au arătat reactivitatea IgE la aceste proteine, relevanța acestor alergeni potențiali nu a fost abordată. Mai mulți alergeni (proteină 63 kDa, alte proteine reactive la IgE) au fost descriși pentru cod, în timp ce unii au fost identificați ca oligomeri de parvalbumină (80). Mai mult, s-au identificat alergeni la pești-spadă (25 kDa), anghilă/eelpout (40 kDa), snapper (35-90 kDa), ton/marlin (94-105 kDa), scad (46-50 kDa), pești tropicali (29 –54 kDa), și pangasius/tilapia (18-45 kDa) (20-22, 64, 66, 81, 82). Potențialii alergeni de identitate cunoscută au fost găsiți la cod (aldehidă fosfat izomerază), somon (triozofosfat izomerază, fructoză-bis-fosfat izomerază, albumină serică) și ton (creatin kinază, beta-enolază) (70, 83, 84).
Alți doi alergeni pești au fost înregistrați în baza de date IUIS-alergeni (Tabelul (Tabelul 1). 1). Alergia alimentară la icre de pește a fost abordată în câteva studii până acum. Vitellogenina, o proteină de gălbenuș de pește, a fost identificată ca alergen alimentar în caviar de la diferiți pești (85, 86). În 2013, tropomiozina, o proteină musculară filamentoasă, a fost purificată, clonată și identificată ca alergen de pește la pacienții sensibilizați la tilapia (87). Acest alergen tilapia a prezentat o omologie ridicată (88%) față de omologul uman. S-a sugerat că poate fi implicat în reacția autoimună a bolii inflamatorii intestinale, deoarece o proporție semnificativă de pacienți cu IgE la tropomiozină suferă de această boală autoimună.
Alergenicitatea Parvalbuminelor
În ultimele decenii, parvalbuminele, enolazele, aldolazele și gelatina de pește au fost identificate ca proteine alergene ale peștilor. Proprietățile specifice au fost atribuite alergenilor alimentari obișnuiți, cum ar fi rezistența la condițiile tractului gastro-intestinal și influențele condițiilor de procesare a alimentelor (88). Până în prezent, numai alergenicitatea parvalbuminelor a fost caracterizată mai detaliat în ceea ce privește alergenicitatea lor, în timp ce rezultatele consolidate trebuie încă generate pentru ceilalți alergeni.
Parvalbumine ale liniei alfa și beta
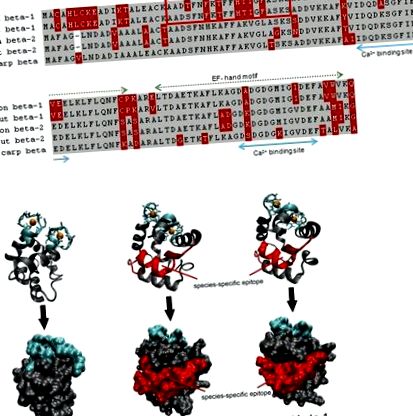
Comparație de somon (> X97824,> X97825), păstrăv (> FN544258,> FN544259) și crap (> P02618; 4cpv) parvalbumine. (A) Ambele secvențe de parvalbumine salmonide beta-1 diferă de omologii lor din treimea N-terminală a proteinei care nu este implicată în legarea calciului. Peptida alergenică este recunoscută în mod specific de IgE de la un pacient monosensibilizat la peștii salmonizi. Reziduuri gri, identice; roșu, reziduuri variabile. (B) Atât modelele de panglică, cât și cele de suprafață arată că peptida alergenică este localizată pe suprafața somonului și a păstrăvilor beta-1 parvalbumine. Regiuni albastre, care leagă calciu; roșu, epitopi IgE.
Concluzie
În ultimele decenii, s-au obținut informații importante despre caracteristicile clinice și bazate pe alergeni pentru alergia la pești: alergenicitatea variabilă a parvalbuminelor de somon (beta-1, beta-2) s-a arătat, în plus, alergeni noi și importanți ai peștilor (enolază, aldolază), gelatină de pește) au fost identificate. Aceste descoperiri vor ajuta la dezvoltarea de noi strategii imunoterapeutice, dar au demonstrat, de asemenea, că tabloul clinic al alergiei la pești este mai complex decât se anticipa. Noi molecule trebuie implementate în testele de rutină bazate pe IgE pentru a avansa diagnosticul și sfaturile pacientului.
Contribuțiile autorului
Toți autorii au contribuit la concepția, proiectarea și redactarea lucrării.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
Declarația tuturor surselor de finanțare: această lucrare a fost acordată de Ministerul Cercetării, Luxemburg.
- Efectul suplimentelor de pește și ulei de krill asupra toleranței la glucoză la iepuri cu experimentale
- Ghid Discus Fish Ultimate Care Regele lumii acvariilor de pescuit
- Articolul complet Fiziologia gustului în implicații potențiale ale peștilor pentru stimularea hranei și a intestinului
- Chukchi - Introducere, localizare, limbă, folclor, religie, sărbători majore, rituri de trecere
- Discus Pești care mănâncă obiceiuri Animale