Abstract
Hormonul intestinal oxyntomodulin (OXM) determină pierderea în greutate prin reducerea poftei de mâncare și creșterea cheltuielilor de energie. Mai mulți analogi sunt în curs de dezvoltare pentru a trata obezitatea. Cu toate acestea, exact modul în care funcționează oxyntomodulinul rămâne controversat. OXM poate activa atât receptorii glucagonului, cât și receptorii GLP-1, dar nu a fost identificat un receptor specific. Se crede că efectul anorectic apare predominant prin activarea receptorului GLP-1, dar, până în prezent, nu s-a confirmat în mod formal care receptor este responsabil pentru creșterea consumului de energie.
Am dezvoltat OX-SR, un analog OXM cu lansare susținută. Produce o creștere semnificativă și susținută a cheltuielilor de energie la șobolani, măsurată prin calorimetrie indirectă. Acum arătăm că această creștere a cheltuielilor de energie are loc prin activarea receptorului de glucagon. Blocarea receptorului GLP-1 cu Exendin 9-39 nu blochează creșterea consumului de oxigen cauzată de OX-SR. Cu toate acestea, atunci când activitatea la receptorul glucagonului este pierdută, nu există o creștere a cheltuielilor de energie. Prin urmare, activitatea receptorilor de glucagon pare a fi esențială pentru efectele OX-SR asupra cheltuielilor de energie. Dezvoltarea viitorilor analogi „dual agonist” va necesita o echilibrare atentă a activităților GLP-1 și a receptorilor de glucagon pentru a obține efecte optime.
1. Introducere
Oxyntomodulin (OXM) este o peptidă de 37 aminoacizi produsă de celulele L neuroendocrine ale ileonului. Se compune din cei 29 de aminoacizi ai glucagonului plus o coadă octapeptidică. Până în prezent, nu a fost identificat niciun receptor specific OXM. OXM activează receptorul glucagonului, deși mai puțin puternic decât glucagonul nativ din cauza cozii octapeptidice. Aceeași coadă permite OXM să activeze receptorul GLP-1, dar și mai puțin puternic decât GLP-1 nativ [1], [2], [3], [4]. În plus, coada octapeptidică încetinește eliminarea OXM din circulație în comparație cu glucagonul [5]. OXM este produs de acțiunea PCSK1 proprotein convertază subtilizină/kexin tip 1 asupra peptidei proglucagon. OXM este co-secretat din intestin cu GLP-1 ca răspuns la aportul de nutrienți. La fel ca GLP-1, OXM este o incretină, provocând în mod direct eliberarea de insulină din celulele insulelor pancreatice.
Toate tratamentele actuale disponibile pentru obezitate - dietetice, farmacologice și chirurgicale - reduc aportul de alimente. Cu toate acestea, pierderea inițială în greutate din reducerea aportului alimentar este asociată cu o scădere a cheltuielilor de energie, ceea ce limitează pierderea totală în greutate [6], [7], [8]. În schimb, stările în care cheltuielile de energie sunt crescute, cum ar fi tirotoxicoza sau expunerea la frig, sunt însoțite de o hiperfagie compensatorie, care are un efect limitativ similar asupra pierderii în greutate [9], [10]. Studiile pe termen scurt sugerează că administrarea OXM exogenă poate reduce greutatea corporală la om [4], [5]. Eficacitatea OXM, în comparație cu alte tratamente anti-obezitate, rezultă din capacitatea sa de a reduce atât aportul de alimente, cât și de a crește cheltuielile de energie. Afectând ambele părți ale ecuației echilibrului energetic, OXM oferă un mijloc de a provoca o pierdere în greutate eficientă și durabilă.
Mecanismul care stă la baza efectului anorectic al OXM este bine stabilit. Acesta este mediat central prin activarea receptorului GLP-1, confirmat atât prin blocarea farmacologică a receptorului GLP-1, cât și prin utilizarea șoarecilor knock-out ai receptorului GLP-1 [2], [11], [12]. Cu toate acestea, mecanismul prin care crește consumul de energie rămâne controversat și au fost implicați atât receptorii glucagonului, cât și receptorilor GLP-1.
Contribuția la incertitudinea cu privire la care receptor crește cheltuielile de energie este dificultatea de a măsura direct efectele cheltuielilor de energie ale OXM. Studiile menționate mai sus utilizează markeri surogat ai cheltuielilor de energie: compararea pierderii în greutate cu aportul alimentar sau a activității nervoase simpatice în BAT. Într-adevăr, niciun studiu până în prezent nu a arătat o creștere a consumului de oxigen după administrarea OXM. Acest lucru nu a fost pe deplin explicat, dar poate reflecta insensibilitatea relativă a celor mai multe cuști metabolice [16], combinată cu timpul de înjumătățire scurt al OXM, care necesită injecții zilnice multiple de OXM. O creștere semnificativă a cheltuielilor de energie la rozătoare a fost măsurată direct cu mai mulți analogi OXM diferiți [17], [18], [19]. Reproductibilitatea acestor rezultate conferă credibilitate ideii că OXM afectează cheltuielile de energie.
Analogii sunt din ce în ce mai folosiți pentru a investiga fiziologia hormonilor peptidici, deoarece manipularea peptidelor native poate crește timpul de înjumătățire și potența hormonilor [17], [19]. Am dezvoltat un analog OXM cu lansare susținută, OX-SR. Aceasta diferă de OXM nativ cu 5 aminoacizi între resturile 16 și 27. Aceste modificări permit OX-SR să formeze un depozit subcutanat, permițând administrarea ca o singură injecție subcutanată zilnică. Am măsurat direct cheltuielile de energie cauzate de acest analog în cuștile metabolice și le-am comparat cu efectele inhibării atât a receptorilor glucagonului, cât și a receptorilor GLP-1. Prin urmare, am reușit să determinăm în mod eficient contribuția relativă a acestor receptori la efectele de cheltuială a energiei OXM.
2. Metode
2.1. Peptide
OX-SR și OX-SR-Glu3 au fost sintetizate de Insight Biotechnology Ltd. (Middlesex, Marea Britanie) utilizând metodologia de sinteză a peptidelor în fază solidă (SPPS) și purificată prin HPLC preparativă în fază inversă. Puritatea peptidelor a fost mai mare de 95%. Pe tot parcursul, OX-SR și OX-SR-Glu3 au fost administrate într-un diluant pe bază de zinc. Oxyntomodulin, GLP-1, glucagon și exendin 9-39 au fost cumpărate de la Bachem (Bubendorf, Elveția). OX-SR-Glu3 are aceeași structură peptidică ca analogul OXM cu acțiune lungă OX-SR cu o substituție a acidului glutamic în poziția 3 pentru a elimina activitatea peptidei la receptorul glucagonului [6].
2.2. test de acumulare AMPc
Celulele CHO-K1 supraexprimând stabil receptorul uman de glucagon (hGCGr) au fost achiziționate de la Invitrogen Life Technologies (Paisley, Marea Britanie) în timp ce celulele CHO supraexprimând receptorul uman GLP-1 au fost produse în casă [7]. acumularea de AMPc a fost măsurată utilizând o analiză a AMP dinamică 2 (Analize Cisbio, Codolet, Franța), urmând protocolul producătorului.
2.3. Studii pe animale
Toate procedurile pentru animale întreprinse au fost aprobate de către Ministerul de Interne britanic în conformitate cu Legea privind animalele (procedurile științifice) din 1986 (licențele de proiect 70/7236 și 70/7596). Șobolani masculi Wistar (Charles River, Margate, Marea Britanie) au fost folosiți pe tot parcursul. Animalele erau adăpostite într-un mediu controlat de temperatură, cu 12:12 h lumină: ciclu întunecat, luminile aprinse la 0730. Pentru a stabili cheltuielile de energie, a fost utilizat un sistem cuprinzător de monitorizare a animalelor de laborator (CLAMS - Columbus Instruments, Columbus, Ohio). Animalele sunt plasate în cuști metabolice, cu măsurarea continuă a consumului de oxigen, producția de dioxid de carbon, activitatea locomotorie, precum și aportul de alimente.
2.4. Studii farmacocinetice
Farmacocinetica intravenoasă a peptidelor a fost măsurată așa cum s-a descris anterior [20]. Pe scurt, fiecare peptidă a fost perfuzată printr-un cateter de venă femurală introdus într-un șobolan anesteziat (n = 3). Peptidele au fost perfuzate la o concentrație de 30 nmol/ml și o rată de 0,3 ml/oră. Probele regulate au fost prelevate dintr-un cateter de venă jugulară pe o perioadă de 100 de minute. Pentru a determina farmacocinetica după o injecție subcutanată, șobolanilor li s-a administrat o singură doză subcutanată formulată în zinc de 1,4 μmol/kg de peptidă. Probele de sânge au fost prelevate la intervale prestabilite timp de 7 zile prin venezecția cozii. Nivelurile de peptide au fost determinate din probele de sânge utilizând un RIA intern [21] și s-au constatat proprietățile farmacocinetice.
2.5. Studiu de hrănire pereche pentru a demonstra efectul de cheltuială a energiei OX-SR
Șobolanii au fost randomizați la trei grupuri (n = 8) în funcție de greutatea corporală (medie 414 g). Grupurile de control și peptide au primit zilnic injecții SC cu vehicul și OX-SR (40 nmol/kg) timp de 3 zile la ora 0830 începând cu ziua 0. Grupul hrănit în perechi a primit injecții zilnice de soluție salină din ziua 1, dar aportul de alimente a fost limitat la aportul mediu al grupului OX-SR în ultimele 24 de ore. Aportul alimentar și greutatea corporală au fost măsurate zilnic la ora 0830. Animalele mai grele au fost utilizate în studiul de hrănire în pereche, comparativ cu studiile ulterioare CLAMS, deoarece acestea au variații mai mici în aportul zilnic de alimente, îmbunătățind calitatea studiului atunci când animalele sunt hrănite la medie aportul alimentar al grupului de tratament.
2.6. Măsurarea cheltuielilor de energie după administrarea acută de OX-SR în CLAMS
tabelul 1
Comparația caracteristicilor farmacocinetice și farmacodinamice ale OXM, OX-SR și OX-SR-Glu3.
| acumularea AMPc EC50 (nM) la receptorul glucagon ± SEM [raport comparativ cu glucagonul] | 3,46 ± 1,5 [7,8] | 2,17 ± 0,6 [4,8] | 20,8 ± 2,5 [46] |
| acumulare AMPc EC50 (nM) la receptorul GLP-1 ± SEM [raport comparativ cu GLP-1] | 136,6 ± 29,1 [17] | 91,2 ± 16,1 [11] | 74,7 ± 31,5 [9,5] |
| Timp de înjumătățire după administrarea intravenoasă (minute) | 12.1 | 15.9 | |
| Timpul până la concentrația plasmatică maximă după administrarea subcutanată (ore) | 0,5 | 3 | |
| Timp până la nivelurile plasmatice nedetectabile după administrarea subcutanată (zile) | 1 | 6 |
În mod similar, la receptorul GCG, nivelurile EC50 ale OXM, OX-SR și OX-SR-Glu3 au fost mai mari decât GCG nativ. GCG a fost 7,8 x mai puternic decât OXM, 4,8 x mai puternic decât OX-SR și cel puțin 46 x mai puternic decât OX-SR-Glu3.
Aceste rezultate arată că, deși OX-SR este mai puțin puternic decât hormonii înrudiți atât la nivelul receptorilor glucagonici, cât și al receptorilor GLP-1, este puțin mai puternic decât OXM cu 1,59 x și respectiv cu 1,50 x.
Aceste date demonstrează, de asemenea, că există o activare minimă a receptorului de glucagon de către OX-SR-Glu3 și, de asemenea, că OX-SR este ușor mai puțin puternic la receptorul GLP-1 decât versiunea Glu3 și constată în concordanță cu alte studii care compară analogii OXM cu comutatorul Glu3 [22].
3.2. Studii farmacocinetice
După perfuzia IV, timpul de înjumătățire plasmatică al OXM și OX-SR a fost calculat a fi de 12,1 și respectiv 15,9 minute. Când a fost administrat subcutanat, OXM a atins concentrația plasmatică maximă la 30 de minute și a fost nedetectabil după 24 de ore; în schimb, nivelurile OX-SR au continuat să crească până la 3 ore și au rămas la această concentrație timp de 24 de ore, înainte de a scădea lent în următoarele 6 zile (Tabelul 1).
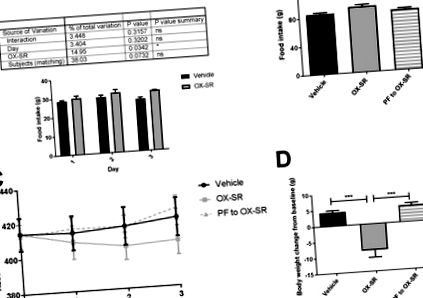
3.3. Studiul privind alimentarea în perechi arată că OX-SR crește consumul de energie
Studiu de alimentare cu perechi de 3 zile folosind OX-SR. Aportul zilnic de alimente (A), aportul alimentar cumulativ (B), greutatea corporală absolută zilnică (C) și modificarea finală a greutății corporale față de valoarea inițială (D) la șobolanii masculi Wistar după 3 zile de injecții cu vehicul, OX-SR (40 nmol/kg ) sau hrănirea în perechi a grupului OX-SR. Mâncarea și greutatea corporală au fost măsurate zilnic la ora 0830. N = 8. Greutatea corporală inițială medie în fiecare grup a fost de 414 g. Date prezentate ca medie ± SEM. Analiza statistică efectuată utilizând ANOVA bidirecțional pentru aportul zilnic de alimente cu testul de comparație multiplă al lui Sidak și ANOVA unidirecțional cu teste post hoc Testul de comparație multiplu al lui Tukey pentru aportul total de alimente și modificarea greutății corporale, * p Fig. 2 A-B). Nu a existat nicio diferență semnificativă în activitatea locomotorie între grupuri în perioada de creștere a cheltuielilor de energie (Fig. 2 F-G), demonstrând că activitatea fizică crescută nu explică cheltuielile de energie sporite. Aportul alimentar a fost, de asemenea, redus semnificativ: a fost redus cu peste 60% în cele 12 ore după injectare și cu 40% în cele 24 de ore după injectare (p Fig. 2 C). Raportul de schimb respirator a fost redus semnificativ cu OX-SR de la 0,96 la 0,90 pentru 12 ore după administrarea peptidei (p Fig. 2 E). Peste 24 de ore, modificarea greutății corporale a diferit semnificativ între cele două grupuri; grupul vehiculului a câștigat în medie 7 g greutate corporală (2,6% din valoarea inițială), iar grupul OX-SR a pierdut 2,6 g din greutatea corporală (1% din valoarea inițială) (p Fig. 2 D). Această pierdere în greutate se datorează consumului redus de alimente și creșterii cheltuielilor de energie.
Efectul blocării receptorilor GLP-1 asupra efectelor cheltuielilor energetice ale OX-SR. Consumul de oxigen peste 12 h (A), consumul de alimente peste 24 h (B), schimbarea greutății corporale peste 24 h (C), RER mediu peste 12 h (D) și activitatea locomotorie totală peste 12 h (E) după o injecție de vehicul sau OX-SR (40 nmol/kg), la șobolani singuri adăpostiți în cuști metabolice CLAMS. Șobolanilor li s-au implantat anterior pompe mini-osmotice subcutanate care conțin ser fiziologic sau EX9-39. Animalele aveau acces gratuit la chow-ul de laborator standard pe tot parcursul. N = 8. Date exprimate ca medie ± SEM. Analiză statistică efectuată utilizând ANOVA cu 2 căi obișnuite cu testul de comparație multiplă al lui Sidak.
3.6. Comparația cheltuielilor de energie după administrarea OX-SR și OX-SR-Glu3
În timp ce OX-SR a crescut consumul de oxigen cu 8% în decurs de 12 ore comparativ cu vehiculul (p Fig. 4 A). Acest lucru a arătat că activitatea receptorului de glucagon a fost necesară pentru ca OX-SR să crească cheltuielile de energie. În special, în timp ce OX-SR nu a afectat în mod semnificativ aportul de alimente, OX-SR-Glu3 a suprimat consumul de alimente peste 24 de ore comparativ cu grupurile vehicul și OX-SR (Fig. 4 B), reprezentând efectul anorectic puternic al GLP-1 activarea receptorilor. Grupul de vehicule a câștigat în medie 4 g greutate corporală în cele 24 de ore după injectarea subcutanată; ambele grupuri OX-SR și OX-SR-Glu3 au câștigat mai puțină greutate decât grupul de control, diferența fiind semnificativă între grupurile vehicul și OX-SR-Glu3 (p Fig. 4 C). Aceste rezultate sugerează că, acut, reducerea consumului de alimente are un efect mai mare asupra greutății corporale decât creșterea cheltuielilor de energie. Nu a existat nicio diferență semnificativă în activitatea locomotorie între grupuri. RER a fost suprimat semnificativ atât în grupurile OX-SR, cât și în grupurile OX-SR-Glu3 pe parcursul celor 12 ore după injectarea peptidei (p Fig. 4 D).
- Revitalizați energia și starea de spirit BodyStart Keto Slimina Pills Review - Storm Ventures Group
- Oferiți cele mai recente prescripții pentru slăbit în lume sănătoase - Fawcett Energy
- Revitalizați energia și starea de spirit 🔊 Scăderea în greutate picături Mlm - CREA-RS
- Spironolactona pentru scăderea în greutate funcționează cu adevărat Sănătate Energie Guru
- Rolul gustării în echilibrul energetic o abordare bio-comportamentală Journal of Nutrition Oxford Academic