Gema Flores
† Departamentul de Științe Biologice, Lehman College și The Graduate Center, City University of New York, 250 Bedford Park Boulevard West, Bronx, NY 10468, Statele Unite ale Americii
§ Instituto de Fermentaciones Industriales, Consejo Superior de Investigaciones Científicas (CSIC), c/Juan de la Cierva 3, 28006 Madrid, Spania
Keyvan Dastmalchi
† Departamentul de Științe Biologice, Lehman College și The Graduate Center, City University of New York, 250 Bedford Park Boulevard West, Bronx, NY 10468, Statele Unite ale Americii
Sturlainny Paulino
† Departamentul de Științe Biologice, Lehman College și The Graduate Center, City University of New York, 250 Bedford Park Boulevard West, Bronx, NY 10468, Statele Unite ale Americii
Kathleen Whalen
† Departamentul de Științe Biologice, Lehman College și The Graduate Center, City University of New York, 250 Bedford Park Boulevard West, Bronx, NY 10468, Statele Unite ale Americii
‡ Departamentul de Medicină, Colegiul Medicilor și Chirurgilor, Universitatea Columbia, 630 W, 168th Street, P&S 9-449, New York, NY 10032, Statele Unite ale Americii
Abdoulaye J. Dabo
‡ Departamentul de Medicină, Colegiul Medicilor și Chirurgilor, Universitatea Columbia, 630 W, 168th Street, P&S 9-449, New York, NY 10032, Statele Unite ale Americii
Kurt A. Reynertson
† Departamentul de Științe Biologice, Lehman College și The Graduate Center, City University of New York, 250 Bedford Park Boulevard West, Bronx, NY 10468, Statele Unite ale Americii
Robert F. Foronjy
‡ Departamentul de Medicină, Colegiul Medicilor și Chirurgilor, Universitatea Columbia, 630 W, 168th Street, P&S 9-449, New York, NY 10032, Statele Unite ale Americii
Jeanine M. D Armiento
‡ Departamentul de Medicină, Colegiul Medicilor și Chirurgilor, Universitatea Columbia, 630 W, 168th Street, P&S 9-449, New York, NY 10032, Statele Unite ale Americii
Edward J. Kennelly
† Departamentul de Științe Biologice, Lehman College și The Graduate Center, Universitatea din New York, 250 Bedford Park Boulevard West, Bronx, NY 10468, Statele Unite ale Americii
Abstract
Nouă antociani (1-9) din fructele comestibile ale Eugenia brasiliensis au fost identificate prin HPLC-PDA și LC-MS, iar șapte dintre acestea sunt descrise pentru prima dată în acest fruct brazilian. Două dintre antocianinele majore, delfinidina (8) și cianidină (9), au fost studiate pentru activitatea lor inhibitoare împotriva producției de chemokine interleukin-8 (IL-8) înainte și după tratamentul celulelor cu extract de fum de țigară (CSE). În celulele netratate, cantitatea de IL-8 a fost neschimbată după tratamentul cu cianidină și delfinidină în concentrații 0,1-10 M. Ambele delfinidine (8) și cianidină (9) a scăzut producția de IL-8 în celulele tratate, la 1 M și respectiv 10 M. Delphinidin (8) a demonstrat inhibarea IL-8 în celulele tratate cu CSE într-o manieră dependentă de doză.
1. Introducere
Pe lângă rolul lor de metaboliți secundari ai plantelor, antocianinele au câștigat atenția ca pigmenți funcționali în coloranții alimentari (He & Giusti, 2010). Interesul față de antociani a crescut în ultimii ani din cauza beneficiilor posibile pentru sănătate ca antioxidanți dietetici (Leiris J. & Martin, 2008). Numeroase studii au indicat că ar putea fi implicate pozitiv în sănătatea umană (Lila, 2004). Antocianinele au o gamă largă de activitate biologică raportată, inclusiv activitate antiinflamatorie (Longo & Vasapollo, 2006), reducerea riscului de boli coronariene (Basu, Rhone & Lyons, 2010), efecte vasoprotectoare (Bell & Gochenaur, 2006), citotoxicitate (Shin și colab., 2009), efecte antidiabetice (Nizamutdinova și colab., 2009) și prevenirea disfuncției adipocitelor care duce la obezitate (Wei și colab., 2011). Unele dintre efectele pozitive ale antocianinelor ar putea fi legate de activitatea lor antioxidantă puternică, după cum s-a demonstrat prin studii in vitro și in vivo (Tsoyi și colab., 2008).
Mai mulți cercetători au subliniat în ultimii ani rolul dietei în prevenirea BPOC (Keranis și colab., 2010). Studiile epidemiologice au arătat că consumul de fructe și legume este invers legat de incidența unui număr de boli, inclusiv cancerul și BPOC (Stan, Kar, Stoner și Singh, 2008). Gauliard și colab. (2008) au descoperit că o parte din sucul de zmeură îmbogățit în antociani poate fi benefic pentru tratamentul BPOC. Ipotezăm că fitochimicele, precum antocianinele, pot fi utile pentru tratamentul BPOC. Pe această linie, într-un brevet din laboratorul nostru, am propus cele două antocianine, cianidin-3-glucozidă și delfinidin-3-glucozidă, ca noi terapii promițătoare pentru BPOC (D’Armiento, Reynertson, Kennelly & Wallace, 2008). Ca parte a studiului nostru în curs de desfășurare a compușilor antioxidanți din fructele tropicale cu efecte terapeutice pentru BPOC E. brasiliensis a fost investigat (Dastmalchi, Flores, Petrova, Pedraza-Penalosa & Kennelly; Flores, 2011; Reynertson și colab., 2006). Obiectivul acestui studiu este identificarea antocianinelor din această plantă și explorarea beneficiilor lor potențiale pentru tratamentul BPOC.
Eugenia brasiliensis Lamarck, cunoscută în mod obișnuit ca „grumixama” sau cireș brazilian, este un copac din pădurile braziliene de coastă care aparține genului Eugenia din familia Myrtaceae. Este unul dintre cele mai mari genuri din familia Myrtaceae și cuprinde aproximativ 350 de specii (Fischer, Limberger, Henriques & Moreno, 2005). Mai multe specii de Eugenia sunt cultivate pentru fructele lor comestibile, iar altele sunt utilizate în medicina populară. În mod tradițional, frunzele, fructele și lemnul de scoarță al E. brasiliensis sunt astringente, diuretice și luate ca tratament pentru reumatism (Revilla, 2002). Pietrovski și colab. (2008) au raportat inhibarea edemului urechii al extractului hidroalcoolic, al fracțiilor și al compușilor izolați din E. brasiliensis ca răspuns la aplicarea topică a uleiului de croton pe urechea șoarecelui.
Fructele E. brasiliensis sunt de culoare violetă și roșie, caracteristice fructelor bogate în antociani. Am raportat anterior prezența cianidin-3-glucozidei și delfinin-3-glucozide în această plantă (Reynertson, Yang, Jiang, Basile și Kennelly, 2008). Cu toate acestea, compoziția antocianină a E. brasiliensis nu a fost raportată în literatura de specialitate. Pentru a testa efectul terapeutic potențial al antocianinelor majore identificate pe BPOC, acestea au fost evaluate pentru activitatea inhibitoare a IL-8 în celulele epiteliale ale căilor respiratorii mici umane (SAE) înainte și după tratamentul cu CSE.
2. Materiale și metode
2.1. Proceduri experimentale generale
Sephadex LH-20 (25-100 μm) (Pharmacia Fine Chemicals, Piscataway, NJ, SUA) a fost utilizat pentru cromatografia pe coloană. Analizele TLC au fost efectuate pe plăci RP-18 F254 (grosimea stratului de 200-270 μm, EMD Chemicals Inc., Gibbstown, NJ, SUA), cu compuși vizualizați prin pulverizare cu o soluție de vanilină (1,0 g de vanilină în 10 ml de concentrat H2SO4 și 90 ml EtOH). Solvenții pentru cromatografie, MeOH de calitate HPLC, acid formic și acetonitril au fost obținuți de la J.T. Baker (Phillipsburg, NJ, SUA). MeOH de calitate GR, acetat de etil și n-butanol au fost furnizate de VWR Inc. (Bridgeport, PA, SUA). Apa ultrapură a fost preparată folosind un sistem Millipore Milli-RO 12 plus (Millipore Corp., Bedford, MA, SUA).
Trolox a fost cumpărat de la Sigma Chemical-Aldrich (St. Louis, MO, SUA). Sarea 2,2'-Azinobis (3-etilbenzotiazolină-6-sulfonat) diamoniu (ABTS) a fost obținută de la TCI-Ace (Tokyo, Japonia). Delfinidin-3-glucozid, cianidin-3-glucozid, cianidin-3-arabinosid, malvidin-3-glucozid, delfinidin și cianidină au fost furnizate de Chromadex (Irvine, CA, SUA).
2.2. Material vegetal
Fructele E. brasiliensis au fost colectate la Fruit and Spice Park (Homestead, FL, SUA). Fructele au fost congelate și expediate prin curier peste noapte pe gheață uscată la laborator, unde au fost păstrate în depozite întunecate la rece (-20 ° C) până la procesare. Specimenele de voucher au fost pregătite, identificate și depuse la Herbarium Steere din Grădina Botanică din New York (Bronx, NY, SUA).
2.3. Pregătirea solventului de extracție
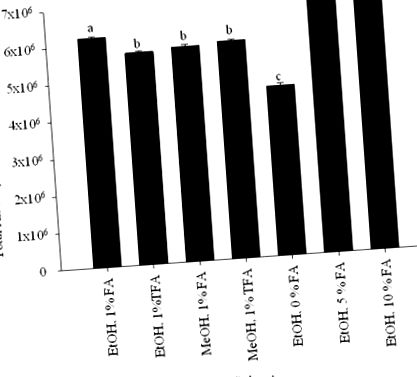
Efectul variației solventului asupra extracției totale a antocianinei a fost optimizat prin variația a trei parametri: tipul solventului organic; tip de acid; și cantitatea de acid utilizată. Un amestec de solvent organic/apă/acid (70: 29: 1, v/v/v) a fost luat în considerare pentru screening, folosind MeOH și EtOH ca solvenți organici și acid trifluoroacetic și acid formic ca acizi. Concentrațiile de acid testate includ 0, 1, 5 și 10 părți de volum.
2.4. Extractia probei
Antocianinele Eugenia brasiliensis au fost extrase de trei ori cu amestec EtOH/apă/acid formic (70: 25: 5, v/v/v) la temperatura camerei cu un blender timp de 5 min pe extracție, iar extractul combinat a fost uscat în vid. Extractul a fost suspendat în apă și repartizat secvențial de trei ori cu acetat de etil și apoi n-butanol. Partițiile combinate de acetat de etil și n-butanol au fost uscate în vid și analizate prin HPLC.
2.5. Fracționarea
Partiția n-butanol, îmbogățită cu antocianine, a fost fracționată pe o coloană Sephadex LH-20 folosind MeOH (0,1% acid formic) ca eluant și au fost colectate 39 de fracții. Aceste fracții au fost combinate în șapte pe baza analizei RP-18 TLC (70:30 H2O, 5% acid formic/acetonitril). Toate fracțiile au fost analizate prin HPLC și testate în testul ABTS. Fracțiunea 4, care conține antociani, a fost analizată prin LC-TOF și au fost identificate nouă antociani.
2.6. HPLC-PDA
A fost utilizat un sistem de cromatografie lichidă Waters (Milford, MA, SUA) echipat cu un modul de separare 2695 și un detector 2996 de fotodiodă (PAD) cuplat la Waters Empower (versiunea 5.0) pentru achiziționarea și prelucrarea datelor. Separarea a fost efectuată pe o coloană 250 × 4,6 mm, 4 μm Synergy Hydro-RP 80A (Torrance, CA, SUA). Solvenții de eluare A (soluție apoasă 1% de acid formic) și B (acetonitril) au fost aplicați după cum urmează: debit, 1 mL/min; izocratic 95% B timp de 10 min, de la 95-90% peste 6 min, de la 90-85% peste 10 min și de la 85-75% peste 15 min. Compoziția a fost apoi schimbată în starea inițială în 5 minute și menținută timp de 10 minute. Antocianinele au fost detectate prin monitorizarea eluției la 520 nm.
2.7. Analize LC-MS ale antocianinelor
Spectrometria de masă cu electrospray de înaltă rezoluție (HR-ESI-MS) a fost realizată folosind un spectrometru de masă LCT premier XE TOF (Waters, Manifold, MA, SUA) echipat cu o interfață ESI și controlat de software-ul MassLynx V4.1. Spectrele de masă au fost achiziționate atât în modul pozitiv, cât și în cel negativ în intervalul m/z 100-1000. Tensiunile capilare au fost setate la 3000 V (modul pozitiv) și respectiv 2800 V (modul negativ), respectiv tensiunea conului a fost de 20 V. Gaz azotat a fost utilizat atât pentru nebulizator, cât și pentru desolvatare. Debitarea și debitul gazului conic au fost de 600 și, respectiv, 20L/h. Temperatura de desolvatare a fost de 400 ° C, iar temperatura sursă a fost de 120 ° C. Coloana analitică utilizată a fost o coloană Synergi Hydro-RP 80A de 250 × 4,6 mm, 4 μm (Torrance, CA, SUA). S-au aplicat același solvent de eluție și metodă ca cea descrisă mai sus pentru HPLC-PDA.
2.8. Test ABTS
Activitatea antioxidantă a partițiilor de acetat de etil și n-butanol și a fracțiilor au fost măsurate prin testul ABTS • + de eliminare (Re și colab., 1999). A fost utilizat un cititor de microplăci Versamax Molecular Devices (Sunnyvale, CA, SUA). Această analiză se bazează pe formarea cationului de radicali liberi ABTS • + prin reacția soluției apoase ABTS (7mM) cu K2S2O8 (2,45 mM, concentrație finală) la temperatura ambiantă în întuneric timp de 12-16 ore. Înainte de utilizare, această soluție a fost diluată cu EtOH la o absorbanță de 0,700 0,020 la 734 nm. Într-un volum final de 200 L, amestecul de reacție a compromis 198 L de soluție ABTS • + și 2 L de probă la concentrații diferite. Absorbanțele la 734 nm au fost măsurate la intervale de 5 min timp de 40 min. În mod similar, amestecul de reacție al grupei standard a fost obținut prin amestecarea a 198 L de soluție ABTS • + și 2 L de Trolox. Capacitatea de eliminare a ABTS a fost exprimată ca capacitate antioxidantă Trolox echivalentă (TEAC, mmol Trolox/g al probei) la intervale de timp diferite. Quercetina a fost utilizată ca control pozitiv.
2.9. IL-8 Imunotest
Celulele umane SAE au fost cultivate conform instrucțiunilor furnizorului (Lonza, Walkersville, MD, SUA) și menținute într-o atmosferă controlată de aer-5% CO2 la 37 ° C. 80% celule SAE confluente la pasajele 2-5 au fost utilizate pentru experimente. CSE a fost pregătit folosind un protocol modificat (Laurent, Janoff și Kagan, 1983). Pe scurt, o pompă de vid Barnet care funcționează la debit constant a fost utilizată pentru a trage fumul unei țigări de calitate 3R4F de cercetare (Universitatea din Kentucky, Lexington, KY, SUA) prin 25 ml de soluție salină tamponată cu fosfat a Dulbecco. Această soluție (100% CSE) a fost ajustată la pH 7,4, filtrată, diluată cu mediu mic de creștere a căilor respiratorii până la o concentrație finală de 5% și adăugată imediat la celule.
Celulele au fost tratate cu 5% CSE sau compuși puri sau pretratate cu compuși puri cu o oră înainte de expunerea la 5% CSE. Viabilitatea celulară a fost evaluată după expunerea la CSE folosind kitul alamarBlue (Invitrogen, Carlsbad, CA, SUA) în conformitate cu specificațiile producătorului. După 24 de ore, măsurarea IL-8 umană în supernatantele de cultură celulară a fost efectuată de ELISA (R&D Systems Inc., Minneapolis, MN, SUA).
2.10. analize statistice
Datele sunt exprimate ca valori medii ± 95% interval de încredere. Analiza varianței a fost efectuată prin analiza unică a varianței (ANOVA) cu diferențe semnificative între medii determinate de testul t Student. Pachetul software JMP Statistics versiunea 8 a fost utilizat pentru analize statistice (SAS Institute Inc., NC).
3. Rezultate si discutii
Am identificat nouă antociani din E. brasiliensis și doi constituenți principali ai antocianinelor găsiți în această specie au fost testați pentru inhibarea IL-8 în celulele SAE înainte și după tratamentul cu CSE.
3.1. Extracția antocianinelor
Solventul de extracție pentru antociani a fost optimizat pentru a spori posibilitatea de a detecta antocianine prezente în cantități mici. Conținutul total de antocianină a fost aproximat prin însumarea totală a ariilor de vârf observate la 520 nm în timpul analizei HPLC-UV pentru a optimiza detectarea acestor compuși.
Optimizarea extracției s-a făcut folosind MeOH și EtOH ca solvenți organici și acid trifluoroacetic și acid formic ca acizi într-un amestec de solvent organic/apă/acid (70: 29: 1, v/v/v). Combinația de EtOH și acid formic cu apă a furnizat cea mai mare suprafață maximă semnificativă totală la 520 nm (Fig. 1). PH-ul extracției cu solvent este un factor în asigurarea unei condiții adecvate de extracție pentru antociani. Extracția pulpei de fructe E. brasiliensis cu 5 și 10% concentrații de acid formic, a dat cele mai ridicate niveluri de antociani (Fig. 1). Deoarece nu s-a găsit nicio diferență semnificativă în aria totală de antocianină atunci când 5 sau 10% acid formic au fost adăugați la solvent sau în numărul de vârfuri de antocianină, 5% a fost selectat ca concentrație de acid. Prin urmare, pulpa de E. brasiliensis a fost extrasă cu EtOH/apă/acid formic (70: 25: 5, v/v/v), iar extractul rezultat a fost suspendat în apă și partiționat cu acetat de etil și n-butanol. Partițiile de acetat de etil și n-butanol au fost analizate prin HPLC. Partiția n-butanol bogată în antocianină a fost separată pe Sephadex LH-20 pentru a se obține șapte fracțiuni. Fiecare fracție a fost analizată prin HPLC și evaluată pentru activitatea lor antioxidantă.
Conținutul total de antocianină la 520 nm de E. brasiliensis vs. sistem de solvent utilizat pentru extracție. Pe baza acestor rezultate a fost selectat un amestec de EtOH/apă/acid formic (70: 25: 5, v/v/v) pentru extracția E. brasiliensis. Datele sunt prezentate ca valori medii ± 95% limite de încredere (n = 3). Barele cu aceleași litere mici (a - d) nu sunt semnificativ diferite (P> 0,05) diferite.
3.2. HPLC-PDA
Cele șapte fracții obținute din E. brasiliensis au fost analizate prin HPLC-PDA și monitorizate la 520 nm. Fracțiunea 4 sa dovedit a fi îmbogățită în antociani (Fig. 2) și, prin urmare, a fost selectată pentru analiza compozițională.
- Biopolimer din nevertebrate marine comestibile Un aliment funcțional potențial - ScienceDirect
- Tratamentul comportamental al obezității la pacienții cu sindrom Prader-Willi SpringerLink
- O nouă modalitate de a stimula apelul la fructe și legume - Comunicații alimentare și sănătate
- Un nou tratament pentru o curbură dureroasă a penisului - The New York Times
- Behçet; Tratamentul bolii, sfaturi privind stilul de viață și cauzele