În numele Grupului de studiu Huntington
De la Departamentele de Neurologie și Psihiatrie, Institutul Taub pentru Cercetări privind boala Alzheimer și creierul îmbătrânit, Centrul Gertrude H. Sergievsky (K.M.), Universitatea Columbia, New York, NY; Departamentul de Epidemiologie și Biostatistică (H.Z.), Texas A&M Health Science Center, College Station; Departamente de Biostatistică (S.E., D.O.) și Neurologie (I.S.), Universitatea din Rochester, NY; și Parkinson’s Institute (C.M.T.), Sunnyvale, CA.
Abstract
Obiectiv:
Pentru a examina aportul caloric, compoziția dietetică și indicele de masă corporală (IMC) la participanții la studiul prospectiv Huntington At Risk Observational (PHAROS).
Metode:
Aportul caloric și compoziția macronutrienților au fost măsurate folosind Chestionarul de frecvență alimentară al Institutului Național al Cancerului (FFQ) la 652 de participanți cu risc de boală Huntington (HD) care nu îndeplineau criteriile clinice pentru HD. Regresia logistică a fost utilizată pentru a examina relația dintre macronutrienți, IMC, aport caloric și starea genetică (CAG ALBINE = cheltuieli energetice bazale; IMC = indicele masei corporale; FFQ = Chestionar privind frecvența alimentelor; HD = Boala Huntington; SAU = raportul de cote; PD = Boala Parkinson; FAR = Studiu de observație prospectiv Huntington At Risk; TEE = cheltuieli totale de energie; UHDRS = Scala unificată de evaluare a bolii Huntington.
Persoanele care suferă de boala Huntington (HD) au un indice de masă corporală (IMC) mai scăzut decât martorii de vârstă, 1-5, iar aceste diferențe cresc pe măsură ce HD avansează. 1.3 Pierderea în greutate de ≥ 1 kg/an a fost asociată cu afectarea motorie mai severă și coreea din ce în ce mai severă în 927 de cazuri HD urmate pentru o medie de 3,4 ani, în timp ce creșterea în greutate a fost mai frecventă la cei cu durată mai mică a bolii (0-2 ani) . 2 Pierderea în greutate în HD poate fi multifactorială și legată de scăderea aportului caloric din disfagie, creșterea cheltuielilor de energie datorate activității fizice (de exemplu, coreea și distonia), 6,7 sau un defect metabolic sistemic care duce la o stare hipermetabolică. 8.9
În 2 studii 6,7 care au examinat cheltuielile energetice de 24 de ore și activitatea fizică utilizând calorimetrie indirectă, cheltuielile totale de energie au fost cu 11% –14% mai mari în cazurile HD de la începutul până la mijlocul etapei, comparativ cu controalele și au fost atribuite creșterii activității fizice în timpul trezirii ore. Studii similare nu au fost efectuate în HD pre-manifest. Un studiu utilizând un chestionar semiquantitativ, deschis, a arătat un aport caloric zilnic semnificativ mai mare și un IMC mai mic în 15 cazuri HD presimptomatice, comparativ cu 21 de martori. 8
Am evaluat relația dintre IMC și dietă prin administrarea unui chestionar semiquantitativ al frecvenței alimentelor (FFQ) 10.11 persoanelor care participă la studiul prospectiv Huntington At Risk Observational Study (PHAROS). 12 Scopurile noastre au fost să comparăm participanții cu și fără CAG extins pentru a determina 1) dacă au existat diferențe în aportul de macronutrienți (proteine, carbohidrați, grăsimi), aportul caloric total și IMC și 2) relația dintre lungimea repetată a CAG, IMC, și aport caloric.
METODE
Subiecte.
Evaluarea dietetică.
Un total de 675 de persoane au finalizat inițial Institutul Național al Cancerului FFQ, care sa dovedit a fi fiabil și valid. 11 FFQ a fost administrat, în medie, la 30 de luni după examinarea inițială. Douăzeci și trei de persoane au fost excluse din analizele prezentate aici, deoarece au fost identificate ca având HD clinic definit înainte sau la momentul FFQ, sau pentru că le lipseau datele CAGn. Analizele se concentrează pe această primă evaluare dietetică și IMC la acea vizită sau pe cea mai apropiată vizită dacă FFQ nu a fost finalizată la vizită. Cea mai apropiată vizită a fost definită ca 180 de zile înainte de FFQ sau în termen de 14 zile de la FFQ. Șaptezeci și nouă la sută dintre subiecți au finalizat FFQ în termen de 2 zile de la o vizită, iar 95% dintre subiecți au avut o vizită care a intrat în fereastra specificată.
Analize statistice.
În cele din urmă, lungimea repetată a CAG a fost corelată cu IMC, aportul caloric și activitatea fizică estimată în grupul CAG ≥37 cu regresie liniară multiplă utilizând valorile quartilei (1, 2, 3, 4) ca variabile continue și ajustând în funcție de vârstă, gen și educație. În plus, pentru IMC ne-am ajustat pentru aportul caloric, iar pentru aportul caloric ne-am ajustat pentru IMC. De asemenea, am calculat probabilitatea anticipată de 5 ani de apariție clinică a HD 15.16 utilizând un model bazat pe CAG dezvoltat folosind date de la aproape 3.000 de indivizi. Regresia liniară de mai sus a fost efectuată utilizând probabilitatea de debut preconizată pe 5 ani ca variabilă de rezultat.
Toate analizele au fost repetate, cu excepția tuturor persoanelor care au lipsit mai mult de 10 articole din interviul dietetic și a femeilor cu aport caloric 3.500 kcal pe zi și a bărbaților cu aport caloric 4.000 kcal pe zi.
REZULTATE
Studiul PHAROS a înscris 1.001 participanți la cercetare. FFQ a fost completat de 675 de persoane (441 CAG 17 (12,9 [0,4] vs 13,0 [0,2]) și pentru fiecare dintre măsurile cognitive pe UHDRS. Scorurile coreei și bradikineziei au fost semnificativ mai mari în rândul necompetitorilor.
Șapte persoane care au finalizat FFQ au fost calificate cu 4 (îndeplinește criteriile clinice pentru HD) la momentul examinării inițiale și au fost excluse din această analiză. Un număr suplimentar de 15 persoane a fost evaluat cu 4 înainte sau la momentul FFQ și a fost exclus din analiză, pentru un total de 22 de persoane. O persoană care nu a avut date repetate CAG a fost, de asemenea, exclusă.
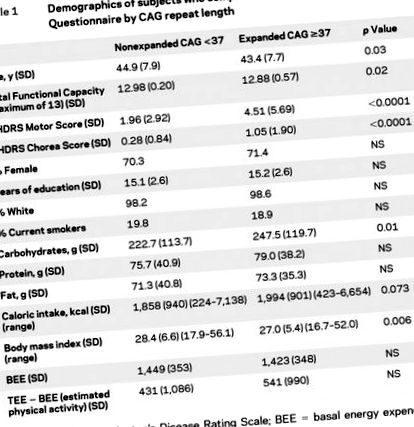
Caracteristici demografice și măsuri sumare din FFQ la 435 de indivizi cu tabelul 1 CAG. Scorul total al motorului UHDRS și scorul coreei au fost semnificativ mai mari în rândul celor cu o repetare CAG extinsă. Am examinat diferența dintre TEE (estimată utilizând aportul caloric total) și BEE ca măsură a activității fizice estimate. Datorită prezenței valorilor aberante pentru variabilele dietetice, distribuțiile acestor variabile în funcție de quartile au fost comparate pentru indivizii cu tabelul CAG 2). Aportul caloric a fost semnificativ mai mare în grupul CAG ≥37 (p pentru tendință = 0,01). IMC și activitatea fizică estimată au fost marginal diferite, în timp ce BEE nu a diferit semnificativ. Aportul de carbohidrați a fost semnificativ mai mare în grupul de repetare CAG extins (p pentru tendință = 0,02).
tabelul 1 Demografia subiecților care au completat chestionarul privind frecvența alimentelor după CAG repetă lungimea
masa 2 Distribuția variabilelor dietetice și indicele de masă corporală pentru subiecții cu tabelul CAG 3). Atât în analizele neajustate, cât și în cele ajustate, șansele de apartenență la grupul CAG ≥37 au crescut aproximativ de două ori pentru fiecare quartilă (a doua, a treia și a patra) a aportului caloric comparativ cu cea mai mică quartilă (prima) (referință) (p pentru tendință 0,05). Cotele cele mai mari au fost pentru a doua quartilă comparativ cu referința, iar cotele au scăzut odată cu creșterea aportului caloric (figura). Când scorul motor total a fost inclus ca o covariabilă, această relație a fost atenuată doar în cea mai înaltă quartilă (a patra). Activitatea fizică estimată mai mare a fost asociată cu o șansă crescută de apartenență la grupul CAG ≥37 după ajustarea pentru vârstă, sex și educație (p pentru tendința 0,02). Când scorul motor total din UHDRS a fost inclus ca o covariabilă, relația dintre activitatea fizică totală estimată și apartenența la grup a fost atenuată, așa cum ar fi de așteptat, deoarece scorul motor total este o măsură a activității fizice. Asocierea IMC și statutul genetic nu a atins importanță. Ajustarea scorului de coreea dihotomizată (0 vs> 0) a produs rezultate similare cu cele produse prin ajustarea scorului motor dihotomizat (datele nu sunt prezentate).
Tabelul 3 Raporturile de șanse (OR) neajustate și ajustate comparând subiecții cu CAG ≥37 cu subiecții cu tabelul 4 al CAG. S-a estimat o creștere a unității de 0,26 CAG pentru fiecare creștere a unității în kcal quartile. În mod similar, estimăm o creștere de 2,4% a probabilității de debut pe 5 ani pentru fiecare creștere a unității în kcal quartile. IMC nu a fost corelat cu lungimea repetată a CAG după ajustarea pentru vârstă, sex, educație și aport caloric.
Tabelul 4 Coeficienții de regresie ajustați ai lungimii repetate a CAG și probabilitatea de 5 ani de apariție a bolii Huntington (HD) la subiecții cu CAG ≥37
DISCUŢIE
Acesta este cel mai mare studiu al factorilor dietetici la persoanele cu risc de HD care nu știau de starea lor genetică. Persoanele cu CAG expandat (≥37) au raportat un aport caloric similar, dar au avut un IMC mai mic comparativ cu cei fără CAG expandat (5, după cum raportăm și în analize neajustate (tabelul 1). Studiile longitudinale vor fi utile pentru a determina dacă există modificări ale macronutrienți și cerințe de energie pe măsură ce unii indivizi din această cohortă dezvoltă HD.
Pierderea în greutate a purtătorilor de gene HD poate fi cauzată de mișcări excesive involuntare, dificultăți de înghițire sau malabsorbție. Nu putem exclude posibilitatea creșterii cheltuielilor energetice secundare mișcării; cu toate acestea, credem că am redus considerabil posibilitatea ca o creștere a cheltuielilor de energie să fie datorată exclusiv mișcărilor involuntare subtile prin eliminarea a 22 de persoane care au primit un diagnostic de cercetare clinică a HD la momentul inițial sau în orice moment până la administrarea FFQ. Într-un studiu efectuat pe 517 pacienți cu stadiu incipient HD, IMC scăzut pe o perioadă de 3 ani a fost legat de lungimea repetată a CAG extinsă, dar nu de nicio componentă specifică a UHDRS (motorie, cognitivă sau comportamentală). 18 Când ne-am ajustat doar pentru scorul motor total și coreea, relația dintre aportul caloric și apartenența la categoria CAG ≥37 a fost diminuată, dar nu a dispărut.
Folosind baza de date Huntington Study Group a cazurilor HD manifeste comparativ cu controalele potrivite vârstei (1: 5), am raportat IMC semnificativ mai scăzut în 361 de cazuri HD simptomatice în stadiul incipient al bolii> Capacitate funcțională totală> 11 [0-13; 13 normal], scorul coreei sau distoniei ≤2 și durata 4 IMC a fost mai mic decât cel raportat în studiul actual al indivizilor pre-manifestați, deși scorurile scorurilor coreei și distoniei au fost similare, sugerând că persoanele din studiul anterior au fost mai mari Deoarece participanții la acest studiu nu erau conștienți de starea lor genetică, orice creștere a aportului caloric nu ar putea fi atribuită informațiilor respective. În plus, dacă dificultatea de înghițire a reprezentat pierderea în greutate, s-ar putea aștepta o scădere, mai degrabă decât o creștere a aportului caloric. în grupul CAG ≥37.
Limitările studiului actual includ faptul că evaluările dietetice au fost auto-raportări și nu a existat nicio oportunitate de validare a aportului alimentar. În plus, toate sondajele au fost completate în mod privat. Nu au existat corecții sau interogări pentru datele lipsă. O treime din participanți nu au finalizat FFQ. Acești indivizi s-au comportat semnificativ mai rău în porțiunea cognitivă a UHDRS și au raportat mai multe simptome depresive și plângeri funcționale; cu toate acestea, proporția transportatorilor unei repetări CAG extinse nu a diferit semnificativ între cei care au finalizat sondajul și cei care nu au făcut-o. Nu am avut întrebări specifice despre disfagie. Am reușit să aproximăm TEE doar pentru că nu s-a obținut calorimetrie indirectă. De asemenea, nu am avut nicio măsură a activității fizice raportate pentru a determina în ce măsură TEE s-a datorat activității fizice. Studiile indirecte de calorimetrie și măsurarea precisă a activității fizice la această populație de indivizi pre-manifestați ar fi valoroase.
Aceste date se adaugă la dovezile convergente de la HD murin și uman la o stare metabolică crescută (procatabolică) care poate apărea înainte de dezvoltarea manifestărilor motorii evidente ale HD. 9,19,20 Un profil metabolomic (metabolit de moleculă mică) constând în modificări ale produselor de descompunere a acizilor grași, descompunerea crescută a acidului nucleic și o nereglare a metabolismului aminoacizilor a fost asociată cu o stare procatabolică atât la modelele murine cât și la HD uman, comparativ cu martorii . 20 La modelele murine și la oameni, semnăturile metabolice au diferit între stările pre-manifeste și cele manifestate clinic, sugerând o schimbare cu progresia bolii. Un studiu efectuat pe 15 cazuri HD pre-manifeste folosind spectroscopie 1 H RMN a arătat că nivelurile scăzute ale plasmei de aminoacizi cu lanț ramificat au distins cazurile HD pre-manifeste de martori, iar aceste niveluri au fost corelate cu pierderea în greutate și lungimea repetată a CAG. 8
Pierderea în greutate poate fi anterioară manifestărilor motorii la șoarecii transgenici HD (R6/2 și N17182Q). S-a postulat că reducerea HAP-1, care se leagă mai puternic de Huntingtin mutant decât proteina hunttin normală și este o proteină stimulatoare a hranei, poate fi legată de pierderea în greutate în HD. 9 șoareci knock-out HAP-1 prezintă atât scăderea în greutate, cât și degenerarea hipotalamică. 21
Nu este clar dacă modificările TEE și IMC sunt strict pre-manifestate sau apar în cadrul unei boli emergente subtil. În boala Parkinson (PD), scăderea în greutate în contextul aportului caloric crescut a avut loc cu 2 până la 4 ani înainte de diagnostic 22 și crește odată cu progresia bolii. Nici o diferență în IMC nu a fost observată în rândul bărbaților care au participat la studiul Harvard Alumni care au dezvoltat PD incident (n = 106) atunci când IMC a fost examinat înainte de facultate și la evaluarea inițială; cu toate acestea, cei care au slăbit 0,5 kg pe deceniu între facultate și linia de bază au prezentat un risc crescut de dezvoltare a PD. 23 Într-un alt studiu bazat pe populație, IMC> 23 cu vârste cuprinse între 25 și 59 de ani a fost asociat cu un risc dublu crescut de PD. 24 Aceste studii sugerează că, deși IMC-ul absolut ridicat la vârsta mijlocie poate fi asociat cu un risc crescut de PD, reducerea IMC în timp poate fi, de asemenea, un risc pentru incidentul PD.
Corelația aportului caloric, dar nu și a IMC, cu o lungime mai mare de repetare a CAG și o probabilitate crescută estimată de apariție a HD în 5 ani sugerează că indivizii ar putea consuma mai multe calorii pentru a-și menține greutatea în perioada pre-manifestă, dar în cele din urmă ar putea să nu fie capabili pentru a compensa și păstra echilibrul energetic. Cazurile HD de la începutul până la mijlocul perioadei, cu aport caloric suficient într-un cadru controlat, au fost capabile să mențină un echilibru energetic pozitiv. Cu toate acestea, în condiții de viață libere, rechemările dietetice repetate de 24 de ore au fost mai variabile la acești pacienți cu HD decât martorii și variabilitatea a crescut odată cu stadiul bolii (Capacitatea funcțională totală) 7, ceea ce poate explica de ce unii pacienți cu HD pierd greutate. Se așteaptă ca relația dintre aportul alimentar și măsurarea indicatorilor de severitate a bolii să fie clarificată prin evaluarea longitudinală a cohortei PHAROS.
CONTRIBUȚIILE AUTORULUI
Analize statistice efectuate de Dr. Zhao și Oakes și S. Eberly.
CONFIRMARE
Autorii mulțumesc comitetelor, consultanților și sponsorilor lor, precum și participanților la cercetare PHAROS și familiilor lor.
DEZVĂLUIRE
APENDICE
Note
Adresați cererile de corespondență și reimprimare către Dr. Karen Marder, 630 W. 168th St. Unitatea 16, Colegiul Columbia al Medicilor și Chirurgilor de la Columbia University, New York, NY 10032 ude.aibmuloc@1msk
* Co-anchetatorii PHAROS sunt enumerați în anexă.
Divulgare: dezvăluirile autorului sunt furnizate la sfârșitul articolului.
Primit la 2 septembrie 2008. Acceptat în formă finală la 1 mai 2009.
- Suplimentele alimentare și riscul de deces cauzat-specific, boli cardiovasculare și cancer reprezintă un protocol
- Aportul de proteine dietetice, deficitul de energie și echilibrul de azot la adulții cu greutate normală sunt randomizați
- Utilizarea suplimentelor alimentare și aportul de nutrienți în rândul copiilor din Coreea de Sud - ScienceDirect
- Articolul complet Aportul de micronutrienți în rândul utilizatorilor danezi adulți și al celor care nu utilizează suplimente alimentare
- Tahicardia ventriculară legată de efort nu reprezintă un risc pentru adulții în vârstă sănătoși - ScienceDaily