Descărcați în format PDF
Despre această pagină
Retinita Pigmentară și Tulburările Aliate
Kevin Gregory-Evans,. Richard G. Weleber, în Retina (ediția a cincea), 2013
Sindromul Bardet - Biedl și „BBSome”
Recent s-a propus că multe dintre proteinele codificate de genele Bardet - Biedl formează complexe, de exemplu, BBS1, BBS2, BBS4, BBS5, BBS7, BBS8 și BBS9 - „BBSome”. 520 Complexul este important în funcția cililor primari, proiecții nemotile găsite în numeroase tipuri de celule. În special, se crede că unii complexe BB joacă un rol central în traficul vezicular de proteine de membrană în cilii. BBSome se leagă de Rab8, un factor de schimb GTP/PIB implicat în andocarea și fuziunea veziculelor purtătoare de rodopsină în ciliul de conectare al fotoreceptorilor. 521 Se știe, de asemenea, că alte gene Bardet-Biedl, de exemplu, BBS3 (Arl6), formează relații funcționale cu acest BBSome. 522 Alții par să funcționeze ca chaperoni, de exemplu, BBs6, BBS10 și BBS12 și în ubiquitinarea proteinelor (BBS11/TRIM32). 523
Motilitatea și comportamentul celular
IX. Gene cu legături cu bolile umane
Sindromul Bardet-Biedl (BBS) este o boală rară autozomală recesivă a omului care a fost recunoscută pentru prima dată la sfârșitul anilor 1800. Este asociat cu boli renale, asemănătoare cu nefronoftiza, obezitatea centrală, polidactilia, degenerarea retiniană, anosmia, hipogenitalia și hipertrofia inimii. În prezent, există 13 gene care au fost identificate la pacienții cu BBS uman. BBS6 este singurul fără omolog clar în Chlamydomonas. BBS5 a fost identificat folosind conservarea genelor ciliare de la oameni la Chlamydomonas și absența acestor gene în organisme neconciliate, cum ar fi Arabidopsis sau drojdie (Figura 2.6). Gena BBS5 a fost cartografiată într-o familie din Newfoundland. Regiunea de interes era de 14 Mb și conținea 230 de gene. Doar două din cele 230 de gene au fost prezente în baza de date comparativă a cililor. Una dintre aceste gene era necunoscută și conținea o mutație a site-ului de îmbinare la membrii afectați ai familiei. Membrii afectați ai a trei familii suplimentare din Kuweit poartă mutații care duc la oprirea prematură a codonilor în această genă (Li și colab. 2004). Anticorpii crescuți către proteina de șoarece au prezentat localizare în jurul corpurilor bazale din celulele ependimale ale șoarecilor.
DIP13/NA14 se găsește asociat cu corpuri bazale și axoneme flagelare, precum și cu microtubuli citoplasmatici (Pfannenschmid și colab., 2003). Interacționează cu spastina, care este o AAA-ATPază care joacă roluri în separarea microtubulilor (Errico și colab., 2004). NA14 este un autoantigen asociat cu sindromul Sjögren, dar nu există dovezi că este implicat cauzal în boală. Cu toate acestea, spastina este asociată cu paraplegia spastică ereditară și degenerarea axonilor (Ramos-Morales și colab., 1998).
Este posibil ca alte proteine găsite de genomica comparativă să joace roluri în flageli (vezi Capitolul 15). Acestea includ proteina Tubby superfamily (TUSP), fibrocistina, UNC119, cunoscută și sub denumirea de HRG4, și calul de mare și qilina, care s-au dovedit a provoca letalitate embrionară și boli de rinichi chistice la peștele zebră (Li et al., 2004).
Reglementarea lungimii ciliului și a transportului intraflagelar
2.2.3 Sindromul Bardet - Biedl
Cilia primară
Luis F. Menezes, Gregory G. Germino, în Methods in Cell Biology, 2009
II Ciliul primar și bolile renale chistice
O dovadă morfologică
Prima observație care sugerează o legătură între PKD și cili a venit de la lucrul în Caenorhabditis elegans, arătând colocalizarea LOV-1 și PKD-2 marcate cu GFP - omologii PC1 și respectiv PC2 - în citoplasma și ciliul neuronilor senzoriali specifici masculin (Barr și Sternberg, 1999). Ulterior, clonarea genei de transport intraflagelar (IFT), IFT88, în Chlamydomonas a arătat că este omologă Tg737 de șoarece și om, o genă legată anterior de boala chistică renală (Pazour și colab., 2000). În Chalamydomonas, IFT88 este necesar pentru asamblarea flagelilor; în mod similar, șoarecii mutanți Ift88 Orpk/Orpk (Tg737) au cilii primari mai scurți în canalele colectoare în zilele 4 și 7 postnatale (Pazour și colab., 2000). Rezultatele anterioare au arătat că șoarecii mutanți Tg737 au un fenotip asemănător cu ARPKD, inițial cu chisturi tubulare proximale cu o deplasare treptată către un fenotip de chist de conductă care colectează predominant și malformația plăcii ductale în ficat (Moyer și colab., 1994).
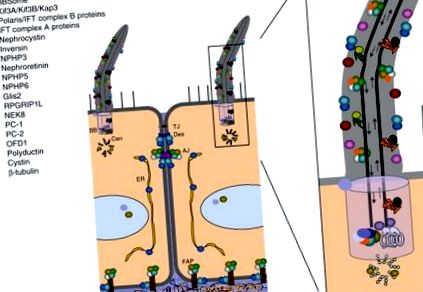
Etapa a fost acum stabilită pentru a plasa acest organel anterior obscur în centrul cercetării PKD. Încurajat de aceste rezultate, o serie de studii au localizat diferite cisto-proteine la cili (Fig. 2). PC2 a fost detectat atât în șili de tip sălbatic, cât și în șoareci mutanți Tg737 (Pazour și colab., 2002). PC1, PC2, polaris (proteina codificată de Tg737) și cistina (proteina codificată de gena mutată la șoareci cpk, un alt model de șoarece asemănător cu ARPKD (Hou și colab., 2002)) au fost colocalizate în cilii canalului de colectare a șoarecilor linii celulare (Yoder și colab., 2002) și poliductină/fibrocistină s-a găsit și în ciliu primar (Gallagher și colab., 2008; Kaimori și colab., 2007; Menezes și colab., 2004; Wang și colab., 2004 Ward și colab., 2003; Zhang și colab., 2004). În Drosophila, PC2 a fost localizat la tipul distal al cozii spermei (Watnick și colab., 2003).
FIG. 2. Localizarea subcelulară a cistoproteinelor. Peste 20 de cistoproteine au fost localizate în complexul primar de corp cilium/bazal (legenda din stânga sus), dar multe se mapează și la alte domenii intracelulare. AJ, joncțiune aderentă; BB, corp bazal; Cen, centriol; ER, reticul endoplasmatic; FAP, placă de adeziune focală; TJ, joncțiune strânsă. Adaptare din Watnick și Germino (2003). (A se vedea placa nr. 20 din secțiunea Placa de culoare.)
Contemporan cu aceste studii, proteinele BBS s-au dovedit a se colocaliza în structurile asociate cu cili. BBS8 marcat cu Myc a fost localizat în corpul bazal în linii celulare și în neuroni ciliați în C. elegans, unde are același tipar de distribuție ca omologii BBS1, BBS2, BBS7 și IFT88 (Ansley și colab., 2003). Ulterior, abordările genomice comparative pentru identificarea proteinelor flagelare și bazale ale corpului au ales BBS5 și au arătat că este exprimată exclusiv la baza cililor în C. elegans (Li și colab., 2004). În plus, s-a arătat că BBS1, BBS2, BBS4, BBS5, BBS7, BBS8 și BBS9 formează un complex stabil, BBSome, care se localizează către centrosom sau corpul bazal (Nachury și colab., 2007).
Proteinele NPHP par, de asemenea, prezente în cilii. În urma studiilor de imunodetecție care arată că NPHP2/inversina și NPHP1 s-au colocalizat într-un model punctat în axonemul ciliar (Otto și colab., 2003), NPHP4 a fost văzut în neuronii ciliați în C. elegans (Wolf și colab., 2005); NPHP5 în cilii celulelor epiteliale tubulare renale (Otto și colab., 2005); NPHP6 în centrosomi (Sayer și colab., 2006); GLIS2 în nuclei și axonem ciliar (Attanasio și colab., 2007); RPGRIP1L în centrosomi, colocalizat cu NPHP4 (Delous și colab., 2007); și NEK8 în regiunea proximală a cililor (Mahjoub și colab., 2005). Alms1 a fost, de asemenea, detectată în cilii (Hearn și colab., 2005).
B Dovezi funcționale
Primele dovezi funcționale care leagă ciliul primar de boala chistică au provenit din studiile Tg737 la șoareci menționate anterior. Linia de șoarece ORPKD, care are o alelă hipomorfă a locusului Tg737 produsă prin inserția transgenică aleatorie în locus, prezintă cilii anormali morfologic, anomalii ale ficatului și boală chistică renală foarte asemănătoare cu cea observată în ARPKD uman (Moyer și colab. 1994). Inactivarea completă a locusului (Tg737 Δ2-3β-Gal) are ca rezultat un fenotip și mai sever. Embrionii mutanți dezvoltă anomalii ale axei stânga/dreapta și celule ale nodului ventral lipsit de un cilium central (Murcia și colab., 2000). Rezultate similare au fost descrise pentru modelele murine de NPHP2. Mutantul mouse-ului inv este rezultatul unei inserții aleatorii a transgenelor în locusul inv (Nphp2). Homozigoții dezvoltă rinichi chistici mari și situs inversus (Mochizuki și colab., 1998; Morgan și colab., 1998). Interesant este că cilii șoarecilor mutanți par să aibă morfologie normală, ceea ce sugerează că cilii care apar cu o normalitate normală pot avea totuși funcții ciliare modificate (Phillips și colab., 2004). Acest lucru are relevanță pentru o serie de alte modele chistice în care structura ciliară este, de asemenea, normală la nivel microscopic cu lumină.
Dovezi suplimentare provin din rezultatele unui ecran de mutageneză inserțională în peștele zebră. Embrionii de pește zebră sunt animale transparente cu rinichi pronefrici simpli, compuși din doi glomeruli, contopiți în linia mediană, fiecare conectat la un canal pronefric. Rinichii pronefrici pot dezvolta, de asemenea, chisturi și au fost folosiți ca model pentru a înțelege PKD (Drummond și colab., 1998). Ecranul a identificat 15 loci care, atunci când au suferit mutații, au provocat chisturi pronefrice (Sun și colab., 2004). Dintre cele zece gene care au fost identificate, opt au fost cercetate în continuare, arătând că cinci au fost implicate în formarea și funcția cililor, trei au fost omologi ai componentelor IFT și una a fost asociată cu absența cililor în canalele pronefrice.
Studiile unui model de șoarece knockout condiționat Kif3A (Lin și colab., 2003) indică, de asemenea, că boala chistică poate rezulta din perturbarea funcției ciliare. KIF3A formează un complex motor kinesin heterotrimeric KIF3 cu KIF3B și KAP3 și se crede că mediază transportul bazat pe microtubuli orientat plus-end al complexelor de proteine și veziculelor legate de membrană și asamblarea cililor (Hirokawa, 2000). După inactivarea condițională Ksp-cre a tubului specific distal a Kif3A, șoarecii mutanți au prezentat formarea progresivă a chistului renal, având câteva segmente chistice în ziua postnatală (P5) (aproximativ 10 zile postinactivare), dar mărirea renală masivă și implicarea tubului distal difuz la P35. Formarea chistului a fost însoțită de pierderea ciliilor primari și niveluri crescute de β-catenină nucleară, un marker al creșterii activității Wnt canonice, în epiteliul chistic (Lin și colab., 2003). În concordanță cu această constatare, s-a constatat că embrionii Kif3a -/- au crescut activitatea Wnt canonică utilizând linia de raportare BAT-gal (Corbit și colab., 2008). Deoarece semnalizarea Wnt neregulată a fost implicată anterior ca o posibilă cauză a bolii chistice renale, aceste studii sugerează un posibil mecanism care leagă disfuncția ciliară de formarea chistului renal. Acest subiect este discutat în continuare mai jos.
În ciuda corelației interesante cu asamblarea cililor, este important de menționat faptul că multe dintre proteinele asociate bolii chistice au funcții multiple în interiorul celulei și se localizează la un număr de compartimente subcelulare diferite. Multitudinea funcțiilor pentru proteinele individuale din interiorul celulelor, care pot fi interdependente, face dificilă atribuirea unor consecințe specifice localizării ciliare a unei proteine (Corbit și colab., 2008). De exemplu, KIF3 mediază transportul microtubulilor în interiorul celulei către mai mult decât doar ciliul primar. PC2 pare a fi o proteină integrală a reticulului endoplasmatic (ER), unde poate funcționa ca un canal de eliberare a calciului, iar nefrocistina-1 a fost raportată că formează un complex cu Pyk2, p130 (Cas) și tensină în matricea celulară. aderențe la membrana basolaterală (Benzing și colab., 2001; Koulen și colab., 2002). Interesant este faptul că inactivarea condiționată a KAP3 are ca rezultat captarea N-cadherinei în Golgi, reducerea grupului de limită celulară a N-cadherinei și creșterea consecventă a β-cateninei citoplasmatice (Teng și colab., 2005). Aceste date îl determină pe cineva să se întrebe dacă efectele perturbării KIF3A sunt în primul rând rezultatul disfuncției ciliare sau a pierderii altor funcții.
Mutații IFT oferă cele mai puternice dovezi care leagă funcția ciliară a diferitelor cistogene de fenotipul chistic. În prezent, se crede că proteinele IFT funcționează exclusiv în formarea și funcția ciliară. Dacă studiile viitoare sugerează roluri suplimentare pentru această clasă de proteine, ar putea fi necesare strategii suplimentare pentru a discrimina proprietățile lor ciliare și nonciliare și relația lor cu boala chistică.
Un studiu recent al uneia dintre genele identificate în ecranul peștilor zebră poate fi deosebit de informativ. Mutanții Seahorse arată foarte asemănător cu mutanții IFT, cu anomalii ale axei L/R, curbura corpului modificată și chisturi pronefrice (Kishimoto și colab., 2008). Interesant este faptul că celulele epiteliale chistice pronefrice mutante au structura, lungimea și motilitatea ciliară normală. Proteina pare a fi prezentă numai în citoplasmă, unde formează un complex cu Disheveled. Disheveled este o componentă cheie a sistemului de semnalizare Wnt, jucând un rol critic atât în căile canonice, cât și noncanonice/polaritatea celulei planare (PCP). Aceste studii sugerează că calul de mare poate funcționa în aval de ciliul primar, servind ca o legătură între acesta și calea Wnt. Un număr de cistoproteine poate servi în mod similar fie pentru transducerea semnalelor ciliare, fie pentru funcționarea în căile efectoare.
Gene și mecanisme în ciliopatiile umane
165.2.3 Tulburări asemănătoare ciliopatiei
165.2.3.1 Sindromul Bardet - Biedl
Sindromul Bardet-Biedl (BBS) este diagnosticat folosind o combinație de caracteristici majore și minore. Criteriile majore sunt distrofia conului tijei, polidactilia, obezitatea (de obicei truncală), dificultățile de învățare, hipogenitalismul la bărbați și anomaliile renale. Un diagnostic clinic de BBS este acceptat numai dacă un pacient are patru criterii majore sau trei criterii majore și două sau mai multe criterii secundare. Caracteristicile secundare sunt tulburările de vorbire, brahidactilia/sindactilia, întârzierea dezvoltării, polidipsia/poliuria, ataxia, diabetul zaharat, dentiția anormală/defecte palatine, bolile congenitale ale inimii și fibroza hepatică (109,110). Mutațiile cauzative au fost identificate în 17 gene diferite din BBS. Multe dintre proteinele codificate sunt necaracterizate biochimic și sunt definite de domeniile structurale pe care le conțin, cum ar fi repetițiile tetratricopeptidice (BBS8) și motivele tripartite (BBS11). Un subset al acestor proteine (BBS1/2/3/4/5/7/8/9 împreună cu BBIP10, PCM-1 și RAB8a) formează un complex proteic cunoscut sub numele de BBSome (discutat mai târziu) (111-114). BBS3/ARL6 este o mică GTPază implicată în traficul de vezicule către cilium, în timp ce BBS6, 10 și 12 sunt membri ai superfamiliei de tip chaperonină de tip II care formează și un complex (25,26,115) .
Mai multe linii de dovezi sugerează că multe proteine BBS funcționează în corpul bazal. În primul rând, o analiză comparativă a proteomilor a două organisme ciliate îndepărtate, Homo sapiens și C. rheinhardtii, au identificat 668 proteine care erau împărtășite de aceste specii, dar care erau absente din planta uniliată Arabidopsis thalania, definind astfel corpul bazal al aparatului flagelar ( FABB) proteom. Proteinele BBS au fost îmbogățite în mod semnificativ în proteomul FABB, iar genele BBS au fost reglate transcripțional în sus după deflagelarea C. rheinhardtii (31). Această analiză, în combinație cu datele de legătură genetică, a servit la identificarea mutațiilor din BBS5. În al doilea rând, toate Ca. genele elegans bbs sunt exprimate exclusiv în neuronii ciliați unde reglează IFT (116,117). În cele din urmă, s-a demonstrat că mai multe proteine BBS se localizează în centrosomi și corpuri bazale din celulele și țesuturile mamiferelor (26,30,116,118), iar un subset de proteine BBS interacționează fizic pentru a forma așa-numitul BBSome care reglează transportul veziculelor către cilii –114 ) .
165.2.3.2 Tulburări ale spectrului Meckel - Joubert
165.2.3.3 Polidactilii cu coaste scurte și tulburări conexe
165.2.3.4 Dischinezie ciliară primară
Așa cum este prezentat în Tabelul 165-2, pacienții cu PCD suferă de infecții cronice recurente ale tractului respirator cauzate de eliminarea mucociliară eșuată. Alte caracteristici asociate includ bronșiectazie, sinuzită și pneumonie. Defectele de lateralitate sunt, de asemenea, frecvente la pacienții cu PCD, incluzând situs inversus (cunoscut sub numele de sindrom Kartagener), situs solitus, dextrocardie și polisplenie, care poate fi explicat prin cerința ca cilii mobili să genereze un flux direcțional de fluid în nodul embrionar (vezi mai jos) . În cele din urmă, bărbații sunt adesea infertili, din cauza funcției de flagel a spermei afectată. Pe scurt, PCD reprezintă o clasă distinctă de ciliopatii mobile, care este definită de defecte ultrastructurale la nivelul ciliilor și subliniază importanța fiziologică și de dezvoltare a motilității cililor.
- Biguanides - o prezentare generală Subiecte ScienceDirect
- Derivat Biguanide - o prezentare generală Subiecte ScienceDirect
- Dietele artificiale - o prezentare generală Subiecte ScienceDirect
- Association Constant - o prezentare generală Subiecte ScienceDirect
- Mouse CD-1 - o prezentare generală Subiecte ScienceDirect