Jungsu Kim
Departamentele 1 Neuroștiințe și
Victor M. Miller
Departamentele 1 Neuroștiințe și
Leviți Yona
Departamentele 1 Neuroștiințe și
Karen Jansen West
Departamentele 1 Neuroștiințe și
Craig W. Zwizinski
Departamentele 1 Neuroștiințe și
Brenda D. Moore
Departamentele 1 Neuroștiințe și
Fredrick J. Troendle
Departamentele 1 Neuroștiințe și
Maralyssa Bann
Departamentele 1 Neuroștiințe și
Christophe Verbeeck
Departamentele 1 Neuroștiințe și
Robert W. Price
Departamentele 1 Neuroștiințe și
Lisa Smithson
Departamentele 1 Neuroștiințe și
Leilani Sonoda
Departamentele 1 Neuroștiințe și
Kayleigh Wagg
Departamentele 1 Neuroștiințe și
Vijayaraghavan Rangachari
Departamentele 1 Neuroștiințe și
Fanggeng Zou
Departamentele 1 Neuroștiințe și
Steven G. Younkin
Departamentele 1 Neuroștiințe și
Neill Graff-Radford
2 Neurologie, Mayo Clinic College of Medicine, Mayo Clinic Jacksonville, Jacksonville, Florida 32224
Dennis Dickson
Departamentele 1 Neuroștiințe și
Terrone Rosenberry
Departamentele 1 Neuroștiințe și
Todd E. Golde
Departamentele 1 Neuroștiințe și
Abstract
Analizele efectelor biologice ale mutațiilor în genele BRI2 (ITM2b) și ale proteinelor β precursoare amiloide (APP) susțin ipoteza că acumularea cerebrală de peptide amiloidogene în demențele familiale britanice și familiale daneze și boala Alzheimer (AD) este asociată cu neurodegenerarea. Am folosit tehnologia transgenică a creierului somatic pentru a exprima transgenele BRI2 și BRI2-Aβ1–40 în modelele de șoarece APP. Exprimarea BRI2-Aβ1-40 imită efectul supresiv observat anterior folosind metode transgenice convenționale, validând în continuare metodologia transgenică a creierului somatic. În mod neașteptat, găsim, de asemenea, că expresia BRI2 umană de tip sălbatic reduce depunerea cerebrală Aβ într-un model de șoarece AD. Date suplimentare indică faptul că peptida 23 aa, Bri23, eliberată din BRI2 prin procesare normală, este prezentă în LCR uman, inhibă agregarea Ap in vitro și mediază efectul său anti-amiloidogen in vivo. Aceste studii demonstrează că BRI2 este un nou mediator al depunerii Aβ in vivo.
Introducere
Materiale și metode
rAAV1 construcție și pregătire.
RAAV1 care exprimă BRI2, BRI2-Aβ1-40, BRI2del244-266, fragment variabil nespecific cu lanț unic (scFv ns) sau proteină fluorescentă verde îmbunătățită (eGFP), sub controlul stimulatorului citomegalovirusului/promotorului β actinei (CBA) au fost generate de transfecția de calciu-fosfat a pAM/CBA-pI-WPRE-BGH, rAAV1 cis-plasmid pH21 (AAV1 helm plasmid) și pFΔ6 într-o linie celulară HEK293. Construcția rAAV1-scFv ns a fost raportată anterior (Levites și colab., 2006b). La 48 de ore după transfecție, celulele au fost lizate în prezență de 0,5% deoxicolat de sodiu și 50 U/ml benzonază (Sigma) prin runde repetate de îngheț/decongelare la -80 ° C și -20 ° C. Virusul a fost izolat folosind un gradient discontinuu de iodixanol și apoi purificat prin afinitate pe o coloană HiTrap HQ (GE Healthcare). Probele au fost eluate din coloană și tampon schimbat la PBS folosind un dispozitiv de centrifugare Amicon Ultra 100 (Millipore). Titrul genomic al fiecărui virus a fost determinat prin PCR cantitativă folosind ABI 7900 (Applied Biosystems). Probele de ADN viral au fost preparate prin tratarea virusului cu DNază I (Invitrogen), prin inactivarea căldurii a enzimei și apoi digerarea stratului proteic cu Proteinaza K (Invitrogen), urmată de o a doua inactivare termică. Probele au fost comparate cu o curbă standard de plasmidă supraînfășurată.
injecție rAAV1 la șoareci neonatali.
Cuantificarea depunerii amiloide.
Hemibrainele au fost imersate fixate în 10% formalină apoi prelucrate pentru încorporarea parafinei. Secțiunile de țesuturi cerebrale (5 μm) au fost imunizate cu anticorpul anti-total Aβ [33.1.1; 1: 1000 (Levites și colab., 2006a)] pe un autostainer DAKO. Sarcina plăcii corticale Aβ și numărul de plăci Thio S-pozitive au fost cuantificate așa cum s-a raportat anterior (Kim și colab., 2007). Au fost analizate trei până la șase secțiuni sagitale per creier, la distanță de 50 μm.
Sandwich Aβ ELISA.
Pentru ELβ Aβ cerebrale de la șoareci TgCRND8, hemi-forebrainele au fost omogenizate în SDS 2% cu 1 × amestec inhibitor de protează (Roche) dizolvat în H2O și apoi ultracentrifugat la 100.000 × g timp de 1 oră. Peptidele Ap insolubile în SDS au fost extrase folosind 70% acid formic (FA). Pentru ELβ Aβ cerebrale de la șoareci Tg2576 în vârstă de 2 luni, hemi-forebrainele au fost omogenizate în tampon de test radioimunoprecipitare (0,1% SDS, 0,5% deoxicolat, 1% Triton X-100, 150 mm NaCl și 50 mm Tris-HCl) și apoi ultracentrifugat la 100.000 × g timp de 1 oră. Pentru a măsura nivelurile endogene de Aβ la șoareci, hemi-forebrains ale coșmarilor netransgenici ai șoarecilor TgCRND8 care exprimă BRI2 au fost omogenizați în tampon dietilaminic 0,2% conținând 50 m m NaCI și 1 × amestec inhibitor de protează (Roche). Nivelurile endogen de Aβ de șoarece au fost măsurate utilizând sistemul ELISA Aβ specific pentru rozătoare validat anterior, așa cum sa raportat anterior (Eckman și colab., 2006). Pentru analiza Aβ plasmatică, sângele a fost colectat în tuburi acoperite cu EDTA după puncție cardiacă. Probele de sânge au fost centrifugate la 3000 rpm timp de 10 minute la 4 ° C, iar apoi plasma a fost alicotată și depozitată la -80 ° C până la utilizare. Nivelurile de Aβ au fost determinate de ELISA-uri tip sandwich Aβ uman, după cum s-a descris anterior (Kim și colab., 2007).
Șoarece anti-Aβ IgG ELISA.
Pentru a testa dacă șoarecii generează răspunsuri anticorp anti-Aβ, titrurile anticorpilor anti-Aβ IgG au fost determinate prin tehnici ELISA standard, așa cum s-a descris anterior (Das și colab., 2001). Pe scurt, plăcile de microtitrare (Maxi Sorp; Dynatech) au fost acoperite cu Aβ42 agregat la 2 μg/godeu. După spălări, s-au adăugat diluții plasmatice seriale (diluție 1: 500) și s-au incubat peste noapte la 4 ° C. După spălări cu PBS/0,1% Tween 20, IgG plasmatică a fost detectată folosind un anticorp IgG anti-șoarece conjugat cu HRP (1: 2000; Sigma) și substrat TMB (KPL).
Western blot.
Eșantioanele de creier anterior congelate rapid au fost omogenizate în tampon SDS 2% cu un amestec de inhibitori de protează 1 × (Roche). Omogenatul a fost centrifugat la 100.000 × g timp de 1 oră la 4 ° C. Concentrația de proteine în supernatante a fost determinată folosind kitul de testare a proteinei BCA (Pierce). Probele de proteine (20 μg) au fost rulate pe geluri Bis-Tris 12% XT (Bio-Rad) cu tampon XT-MES sau geluri Bis-Tris 4-12% XT (Bio-Rad) cu tampon XT-MOPS și transferate la 0,2 μm membrane nitrocelulozice. Bloturile au fost microundate timp de 2 minute în 0,1 m PBS de două ori și sondate cu anticorpul 82E1 (anti-Aβ1-16; 1: 1000; IBL), CT20 (anti-APP C-terminal 20 aa; 1: 1000; TE Golde) și ITM2b (GenWay). Bloturile au fost dezbrăcate și reprobate cu anti-actină β (1: 1000; Sigma) ca control de încărcare. Intensitatea relativă a benzii a fost cuantificată utilizând software-ul ImageJ (NIH).
Test in vitro de agregare Aβ folosind electroforeza pe gel nativ.
Aβ1-42 și Aβ1-40 sintetice, tratate cu hexafluoroizopropanol și uscate (Bachem), și peptidele Bri2-23 (Bachem) au fost dizolvate în DMSO și apoi diluate în TBS la rapoarte molare așa cum este indicat. Amestecurile peptidice Aβ1-42 și Bri2-23 au fost incubate timp de 3 ore la 0 ° C sau 37 ° C fără agitare. Amestecurile au fost rulate pe 4-20% geluri Tris-HCI în condiții de nedenaturare și transferate la membrană de fluorură de poliviniliden 0,4 μm așa cum s-a descris anterior (Klug și colab., 2003; Kim și colab., 2007). Blotul a fost sondat cu Ab9 (anti-Aβ1-16; 1: 1000; T. E. Golde). Intensitatea relativă a benzii a fost cuantificată utilizând software-ul ImageJ (NIH).
Test de agregare in vitro Aβ1-42 folosind tioflavina T și studii de microscopie cu forță atomică.
Peptidele Bri2-23 (Bachem) au fost reconstituite în 1 mg/ml Tris-HCI, pH 8,0. Aβ1-42 sintetic liofilizat (Instalația de sinteză peptidică Mayo Clinic) a fost dizolvat la 0,5-2,0 m m și 20 m m NaOH cu 15 minute înainte de cromatografia de excludere a dimensiunii pe coloana Superdex 75 HR 10/30 (GE Healthcare) pentru a elimina orice agregate Aβ preformate. Concentrația de Aβ monomerică a fost determinată prin absorbția UV cu un coeficient de stingere calculat de 1450 cm -1 × m -1 la 276 nm (Rangachari și colab., 2006). Reacțiile de agregare Aβ1-42 au fost inițiate în tuburi Eppendorf siliconate prin incubarea a 25-50 μm monomer Aβ1-42 proaspăt purificat în 10 m m Tris-HCI și 150 m m NaCl, pH 8,0, tampon fără agitare la 37 ° C. Procesul de agregare monomeric Aβ1-42 în prezența sau absența peptidelor Bri2-23 a fost monitorizat folosind un test de tioflavină T (ThT) așa cum sa raportat anterior (Rangachari și colab., 2006). Imaginile de microscopie cu forță atomică au fost obținute cu un controler NanoScope III cu un AFM multimod (Veeco Instruments) așa cum s-a descris anterior (Nichols și colab., 2005). Imaginile sunt afișate în modul amplitudine, unde luminozitatea crescândă indică o amortizare mai mare a oscilației în consolă.
Analiza HPLC/spectrometrie de masă a peptidelor Bri2–23.
Mediul condiționat sau CSF au fost filtrate printr-un filtru de seringă de 0,45 μm pentru a îndepărta particulele mari. O alicotă de 50 μl a probei a fost injectată într-o HPLC din seria Agilent 1100 cu o coloană Zobax Eclipse XDB-C8 și tampon de acetonitril/H2O (ACN: H2O) cu 0,1% acid trifluoroacetic (TFA) la un debit de 1 ml/min. Compoziția inițială a solventului a fost 20:80 ACN/H2O; această compoziție a fost menținută timp de 3 minute și apoi liniar rampată până la 37:63 ACN/H2O în următoarele 7 minute. O fracție a fost colectată între 9,4 și 10,4 min (deoarece s-a văzut că standardul BRI-23 eluează la 9,8 min) pentru un total de 1 ml.
Fracția colectată a fost apoi suflată în azot la 37 ° C până la ~ 100 μl în volum. O alicotă de 1 μl din această probă concentrată a fost aplicată pe un cip auriu Bio-Rad și a fost lăsată să se usuce la aer. După ce s-a uscat eșantionat, s-a aplicat 1 μl acid α-ciano-4-hidroxicinamic saturat (matrice MALDI) în 70:20:10 ACN: H2O: MeOH cu TFA 0,1% și s-a lăsat să se usuce la aer. Acest lucru a fost apoi analizat pe un sistem de timp de zbor Bio-Rad Ziphergen ProteinChip SELDI. O intensitate a laserului de 750 μJ a fost utilizată pentru a colecta spectre de la 3975 de fotografii cu laser, care au fost mediate în spectrele finale. Spectrele terminate au fost corectate în linia de bază.
analize statistice.
ANOVA unidirecțional cu test de comparație multiplă post-hoc Holm-Sidak sau testul t Student cu două cozi a fost utilizat pentru comparație statistică (versiunea SigmaStat 3.0). Dacă datele nu au îndeplinit ipotezele testului parametric, s-au efectuat statistici neparametrice, fie testul Kruskal - Wallis (ANOVA unidirecțională pe ranguri), urmat de procedurile de comparație multiplă post hoc Dunn, fie testul sumelor de rang Mann - Whitney (versiunea SigmaStat 3.0) . Variabilitatea estimărilor a fost raportată ca SEM.
Rezultate
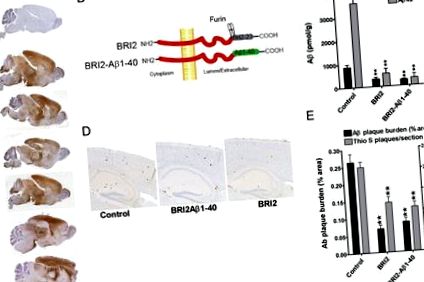
BRI2 și BRI2-Aβ1-40 suprimă depunerea amiloidă la șoarecii transgenici APP
Efectele transgenului BRI2-Aβ1-40 eliberat viral au fost comparate cu efectele transgenului BRI2 uman eliberat de rAAV1 și un control de neinjecție (Fig. 1 B). Expresia BRI2 a fost intenționată să servească drept al doilea control, deoarece am stabilit că livrarea rAAV1-hGFP și livrarea simulată a virusului nu au modificat depunerea Aβ în modelul de șoarece CRND8 APP (Levites și colab., 2006b). La trei luni după livrarea transgenă mediată de rAAV1, șoarecii au fost uciși, iar depunerea de creier Aβ a fost analizată folosind atât metode biochimice, cât și histochimice. Aceste analize au evidențiat un efect supresiv dramatic atât al transgenelor BRI2-Aβ1-40, cât și BRI2 asupra acumulării parenchimale Aβ1-40 și Aβ1-42 măsurate prin evaluări biochimice și histochimice ale nivelurilor de Aβ (Fig. 1 C - E).
Bri2-23 inhibă agregarea Aβ1-42 in vitro
Peptida Bri2-23 inhibă agregarea Aβ in vitro. A, Peptidele sintetice Aβ1-42, Aβ1-40 și Bri2-23 au fost amestecate la concentrațiile indicate și incubate la 0 sau 37 ° C timp de 3 ore. După incubare, amploarea agregării Aβ în agregate HMW a fost evaluată prin electroforeză pe gel nativ și Western blot cu anticorp Ab9 (anti-Aβ1-16) care recunoaște fibrile Aβ, oligomeri și monomeri. B, Analiza cantitativă a celui de-al doilea studiu doză - răspuns a arătat diferența dintre nivelurile monomerice Aβ1-42 între incubațiile de 37 și 0 ° C. n = 3 pentru fiecare condiție. * p m Aβ42 agregare (ANOVA). C, Aβ1-42 monomeric izolat prin cromatografie de excludere a mărimii a fost incubat în prezența sau absența peptidei Bri2-23. La momentele indicate, alicote de amestecuri de reacție de agregare au fost analizate pentru a determina gradul de agregare prin testul ThT. D, Analiza AFM a agregatelor la 72 h de incubație. Imaginile reprezentative, prezentate în modul înălțime, sunt de 10 × 10 μm. Bare de scară, 1 μm.
Secvența Bri2-23 este necesară pentru a suprima depunerea Aβ in vivo
Aceste observații au sugerat că efectul anti-amiloidogen al proteinei BRI2 este mediat de o interacțiune între Bri2-23 și Aβ. Pentru a testa în continuare această idee in vivo, am generat un ADNc care exprimă o proteină BRI2 trunchiată lipsită de peptida Bri2-23 (BRI2del244-266) (Fig. 4 A) și am folosit transferul genei rAAV pentru a livra această construcție șoarecilor TgCRND8 nou-născuți. Șoarecii transgenici pozitivi au fost uciși la vârsta de 3 luni și s-au examinat încărcăturile Aβ biochimice și histochimice. Analizele sarcinilor Aβ nu au arătat nicio diferență semnificativă între BRI2del244-266 și grupurile martor (Fig. 4 B - D). Analizele Western blot ale lizatelor cerebrale au demonstrat că metodologia transgenică a creierului somatic a produs niveluri de expresie aproximativ echivalente din constructele BRI2 și BRI2del244-266 și niveluri ceva mai ridicate din BRI2-Aβ1-40 (Fig. 4 E). Aceste date ulterioare și lipsa efectului anti-amiloidogen de la BRI2del244-266 demonstrează că secvența peptidică Bri2-23 este critică pentru efectul inhibitor al BRI2 in vivo. Împreună cu datele care demonstrează că Bri2-23 inhibă direct agregarea Aβ in vitro, aceste date susțin o funcție anti-amiloidogenă pentru BRI2 mediată de peptida Bri2-23.
Peptida Bri2-23 este prezentă în LCR uman
Datele noastre de la șoareci au sugerat că BRI2 endogen ar putea funcționa, cel puțin parțial, prin secreția peptidei Bri2-23 ca un partener de legare anti-amiloidogen al Aβ. Până în prezent, studiile de procesare și secreție BRI2 normale s-au bazat în principal pe versiunile peptidei Bri2-23 marcate cu epitop (Kim și colab., 1999; Choi și colab., 2004). Anticorpii de prima generație nu au fost suficient de sensibili pentru a detecta peptida Bri2-23 în probele biologice. Astfel, am dezvoltat o analiză bazată pe HPLC/spectrometrie de masă (HPLC/MS) pentru a detecta Bri2-23 secretat. Am validat această metodologie prin detectarea secreției peptidice Bri2-23 neetichetate din celulele H4 transfectate cu BRI2, dar nu și BRIdel244-266 (Fig. 4 F). Am testat apoi LCR uman normal și am putut detecta peptida Bri2-23 secretată endogen în toate probele testate (Fig. 4 G). Această constatare întărește noțiunea că efectele anti-agregare ale peptidei Bri2-23 din experimentele noastre pot fi relevante fiziologic pentru AD, FDD și FBD umane.
Discuţie
Am folosit tehnologia transgenică a creierului somatic pentru a livra transgenele BRI2 și BRI2-Aβ1–40 în creierele modelelor de șoarece APP. Studiile cu BRI2-Aβ1-40 au confirmat studii anterioare obținute folosind șoareci transgenici convenționali care exprimă BRI2-Aβ1-40 (McGowan și colab., 2005; Kim și colab., 2007). Astfel, studiile transgenice BRI2-Aβ1-40 asupra creierului somatic oferă o validare suplimentară pentru această metodă rapidă rentabilă de manipulare a expresiei genelor din creier (Levites și colab., 2006b).
Va fi necesar un studiu suplimentar al peptidei BRI2 și Bri2-23, precum și al peptidelor analogi eliberate din omologii BRI2 (care conțin motivul FxxxF conservat) pentru a înțelege pe deplin acțiunea lor anti-amiloidogenă și alte funcții. Efectul inhibitor robust al BRI2 asupra depunerii Aβ in vivo și agregării in vitro BRI2 indică faptul că BRI2 este un factor nou care modulează agregarea și depunerea Aβ. Aceste date susțin o abordare nouă a terapiei sau prevenirii AD bazată pe creșterea nivelurilor de BRI2 și mai specific peptidei Bri2-23 din creier.
- Modificări legate de vârstă ale depunerii de grăsime la nivelul mușchiului mijlociu al coapsei la relațiile femeilor cu metabolice
- Anastasia a slăbit 41 de lire sterline în 18 luni; Transformarea marți
- Avantajele ardeiului iute Iată cum poate provoca pierderea în greutate și prevenirea diabetului
- 30 minute - frigarui de miel condimentat gras
- Anastasia Trifonopoulous Vision Antrenament personal