Seong Joon Ahn
1 Departamentul de Oftalmologie, Universitatea Națională Seul Spitalul Bundang, Universitatea Națională Seul Colegiul de Medicină, Seongnam 463-707, Coreea.
2 Departamentul de Oftalmologie, Spitalul Capitalelor Forțelor Armate, Seongnam 463-040, Coreea.
Na-Kyung Ryoo
1 Departamentul de Oftalmologie, Universitatea Națională Seul Spitalul Bundang, Universitatea Națională Seul Colegiul de Medicină, Seongnam 463-707, Coreea.
Vezi Joon Woo
1 Departamentul de Oftalmologie, Universitatea Națională Seul Spitalul Bundang, Universitatea Națională Seul Colegiul de Medicină, Seongnam 463-707, Coreea.
Abstract
TOXOCARIASIS, TOXOCARIASIS OCHIAL
Toxocariaza este una dintre cele mai frecvente infecții zoonotice la nivel mondial cauzate în principal de Toxocara canis și mai rar de alte viermi rotunzi, cum ar fi Toxocara cati [1, 2]. Distribuția geografică a toxocariazei este la nivel mondial, iar seropozitivitatea anticorpului toxocara variază de la 2,4% [3] la 76,6% [4]. Din punct de vedere istoric, în 1952, Beaver și colab. [5] a identificat agentul etiologic, larvele T. canis, în granulomatele eozinofile în biopsiile hepatice luate de la trei copii. Patru ani mai târziu, Nichols [6] a demonstrat prezența larvelor în stadiul al doilea al T. canis în secțiuni histologice de 24 de ochi enuclerați sub suspiciunea de tumori maligne intraoculare. Aceste descoperiri conduc la o etiologie comună pentru bolile sistemice și oculare, toxocariaza umană.
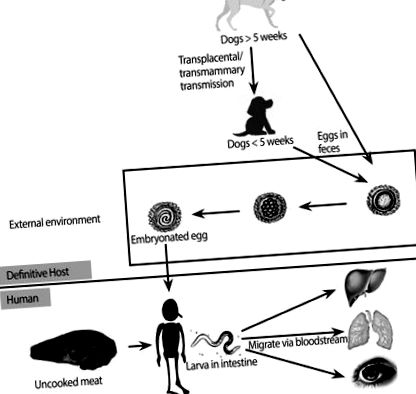
Indivizii se infectează cu Toxocara atunci când ingerează în mod neintenționat ouă sau larve embrionate care au fost vărsate în fecalele animalelor infectate sau gazdele paratenice nefierte (Fig. 1) [1, 2, 7]. După ce un om ingerează ouăle, larvele infecțioase sunt eliberate în intestinul subțire și ulterior acestea pătrund în peretele intestinal, intră în circulație și migrează către organe unde induc reacții inflamatorii și simptome [1, 2]. Spectrul clinic de toxocarioză la om variază de la infecție asimptomatică la leziuni severe de organ, în funcție de încărcătura parazitară, locurile de migrare larvară și răspunsul inflamator al gazdei [1]. În special, în funcție de organul implicat, pot apărea două sindroame clinice bine definite: toxocariaza sistemică (cunoscută și sub denumirea de larve viscere migrante) și toxocariaza oculară (OT) [1].
O figură simplificată care arată ciclul de viață al Toxocara canis și ruta de transmisie și migrația sa la om.
Deoarece OT rămâne relativ necunoscut publicului, precum și clinicienilor, caracteristicile clinice, diagnosticul, tratamentul și prevenirea OT sunt revizuite aici, cu accent pe noile evoluții în diagnosticul serologic și descoperirile noi din studiile clinice din literatura de specialitate.
CARACTERISTICI CLINICE
Vârsta la prezentare la pacienții cu OT poate varia de la unu la 77 de ani [9, 16, 17]. Majoritatea studiilor anterioare au raportat că este mai frecventă la bărbați, întrucât raportul bărbat/femeie a fost de obicei mai mare de 1: 1 [8, 12, 18, 19, 20, 21, 22], până la 4,5: 1 [23 ]. Majoritatea cazurilor au fost unilaterale, iar cazurile bilaterale au fost mai mici de 40% [20] în literatura de specialitate. Prezentările sale clinice pot fi clasificate în una dintre cele patru forme: granulom pol posterior, granulom periferic, endoftalmită nematodică și prezentări atipice [16].
Granulom pol posterior (fig. 2), o masă inflamatorie focală, albicioasă subretiniană sau intraretinală, de obicei mai mică de 1 diametru de disc cu sau fără pigmentare, prezentă în polul posterior cu sau fără semne de inflamație acută și vitros neclar [16]. Wilkinson și Welch [24] au arătat că această formă este cea mai comună formă de prezentare clinică, constând din 44% din cazurile de OT. Leziunile maculare sunt cel mai probabil să fie simptomatice și, prin urmare, determină pacienții să solicite asistență medicală, ceea ce explică posibil predilecția granulomului polului posterior.
Fotografii ale fundului de granulom de retină la un bărbat în vârstă de 67 de ani (A) și 31 de ani (B) cu toxocarioză oculară. (A) Granulomul polului posterior apare ca o leziune ovală, albă, în polul posterior al retinei. (B) Granulomul periferic se prezintă cu o masă albicioasă amorfă cu membrană tractională și detașare retiniană.
Granulomul periferic (Fig. 2), un nodul focal, ridicat, alb în periferia retinei, poate fi prezent cu diferite grade de membrane înconjurătoare și modificări pigmentare [16]. La unii dintre pacienții cu granulom periferic, inflamația poate fi difuză și poate apărea ca un „banc de zăpadă” [10]. Se pot observa benzi fibrocelulare care se îndreaptă spre retina posterioară sau nervul optic, formând uneori un pli al retinei. Tracțiunea localizată pe retină poate duce, de asemenea, la detașarea retiniană tractională sau detașarea retiniană regmatogenă prin generarea de găuri sau lacrimi retiniene.
Endoftalmita nematodică este un tip de panuveită care se manifestă ca un ochi roșu, dureros, cu inflamație intraoculară difuză [16]. Hipopionul și infiltratul celular dens în vitros pot fi observate în cazuri severe. Granulomul retinian poate fi observat prin ceața vitroasă pe măsură ce opacitatea vitroasă se curăță [24]; prin urmare, efortul meticulos pentru detectarea granulomului retinian este important pentru diagnosticul diferențial. Pacienții cu endoftalmită nematodică tind să fie puțin mai tineri decât cei cu granulom localizat.
Prezentările atipice includ inflamația și umflarea capului nervului optic (care se manifestă ca nevrită optică), larvele subretinale mobile și corioretinita difuză [1, 7, 10]. Se pot observa, de asemenea, descoperiri ale segmentului anterior, cum ar fi conjunctivita, cheratita, iridociclita, nodulii irisului focal și cataracta [1]. În raportul nostru recent, opacitatea mică, rotundă, asemănătoare granulomului alb, care se mișca în nivelul subcapsular al cristalinului a fost observată la ochi cu OT [25].
În plus față de inflamația oculară și prezentările asociate cu granulomul, afecțiunile comorbide la ochi cu OT necesită o analiză atentă, deoarece acestea pot fi alte surse de pierdere a vederii și pot evolua dacă nu sunt tratate. Astfel de comorbidități vitreoretiniene în OT includ membrană epiretinală, opacitate vitroasă, detașare retinală tractională/reumatogenă, edem macular, cataractă și gaură maculară [9, 10]. Deși prezentarea tipică a OT, granulom cu inflamație intraoculară, poate fi tratată medical, cazurile cu comorbidități vitreoretinale combinate necesită uneori un tratament chirurgical pentru recuperarea anatomică și vizuală.
Mai multe rapoarte au sugerat cauzele pierderii vederii la pacienții cu OT. Stewart și colab. [10] a raportat că vitrita este cea mai frecventă cauză a pierderii vederii în OT, urmată de edem macular cistoid, detașare retiniană tractională și membrană epiretinală. În plus, la ochii cu granulom macular, granulomul în sine poate duce la pierderi semnificative ale vederii, deoarece dăunează retinei implicate și fotoreceptorilor [9]. Astfel, cauzele pierderii vederii la ochi cu OT pot fi grupate în 3 categorii: leziuni ale retinei cauzate de granulom în sine, comorbidități ale retinei și inflamație intraoculară. În seria noastră de OT, acuitatea vizuală cea mai bine corectată medie a fost de 20/64 echivalent Snellen la momentul inițial, care a fost comparabil cu 20/56 echivalent Snellen la vizita finală, când inflamația intraoculară a scăzut în mare parte [9]. Aceasta indică faptul că, în cazurile de declin vizual, ar trebui luate în considerare și evaluate cu atenție alte cauze, cum ar fi afectarea retinei prin granulom sau alte afecțiuni comorbide, în timpul examenului clinic la pacienții cu OT.
În mod remarcabil, o caracteristică unică a OT, în comparație cu alte boli inflamatorii sau retiniene, este migrația intraoculară (Fig. 3) [9, 26, 27]. Două rapoarte de caz au demonstrat în mod individual migrația intraoculară a granulomului [26, 27]. Au existat două tipuri de migrație intraoculară, continuă (granulomul a migrat adiacent locației observate inițial) sau discontinuu (un granulom nou departe de locația inițială) [9]. În cursul cursului clinic, migrația continuă și discontinuă a granulomului a fost observată la 12,9% și, respectiv, 4,3% din ochii cu OT, respectiv [9]. Deoarece granulomul migrator este patognomonic pentru OT, această caracteristică unică poate fi utilă în diferențierea OT de alte boli ale retinei, cum ar fi toxoplasmoza oculară, sarcoidoza, tuberculoza și infecțiile fungice [9].
Două tipare de migrație ale granulomului Toxocara: continuu (A) și discontinuu (B). (A) Granulomul se deplasează în partea temporală la o lună după vizita inițială (A, stânga). Linia punctată din panoul A denotă o linie de referință care leagă două puncte de referință. (B) Comparativ cu linia de bază, apar două granuloame noi în macula și retina inferotemporală.
DIAGNOSTIC
Diagnosticul definitiv al toxocariazei oculare poate fi obținut prin demonstrarea histologică a larvei toxocarei sau a fragmentelor acesteia din biopsia țesutului infectat. Cu toate acestea, colectarea materialului adecvat pentru biopsie este riscantă și dificilă în ochii cu OT și rareori justificată din motive clinice. Astfel, diagnosticul actual al OT se face clinic prin identificarea semnelor oftalmologice tipice și prin prezența anticorpului seric la larvele Toxocara [1, 7, 16].
După cum sa menționat mai sus, prezentarea clinică a granulomului localizat în polul sau periferia retinei posterioare este tipică pentru stabilirea diagnosticului presupus de OT. În cazurile de endoftalmită nematodică în care examinarea fundului nu este posibilă din cauza opacității vitroase, testele auxiliare specifice, cum ar fi ultrasonografia (descrierea masei foarte reflectorizante cu sau fără bandă vitroasă) pot fi utile pentru diagnostic diferențial și prezența granulomului retinian ar trebui să fie re -evaluat pentru diagnostic clar atunci când vitrosul devine clar [1, 24].
Ca test auxiliar, rolul pentru detectarea anticorpului de imunoglobulină E (IgE) a fost identificat la pacienții cu toxocarioză umană [7, 34]. În ceea ce privește rolul în OT, seria noastră de cazuri pe OT a arătat 69,6% dintre pacienții diagnosticați clinic și serologic au prezentat niveluri crescute de IgE, sugerând că IgE poate oferi un rol suplimentar pentru diagnosticul de OT [9]. Mai mult, nivelurile de IgE au arătat o scădere după tratament în toxocariaza umană, indicând că poate fi utilă pentru monitorizarea efectului terapeutic. Acest lucru necesită investigații suplimentare cu privire la rolul anticorpului IgE în rândul pacienților cu OT.
Deși eozinofilia sistemică este o caracteristică importantă a toxocariazei sistemice [14, 35, 36, 37, 38], numărul eozinofilelor nu este de obicei crescut la pacienții cu otomatologie. De exemplu, seria noastră de cazuri a arătat doar 11,6% (10 din 86) dintre pacienții cu OT au avut eozinofilie [9]. Astfel, numărul eozinofilelor poate să nu fie la fel de util ca testul ELISA sau nivelul IgE total; totuși, eozinofilia poate indica posibilitatea apariției toxocariazei sistemice și oculare [1, 34], care necesită evaluare sistemică și tratament adecvat.
Mai mulți autori au sugerat că sensibilitatea îmbunătățită poate fi realizată utilizând o analiză ELISA a fluidelor intraoculare [17, 33, 39]. Cu toate acestea, folosind aceeași valoare de tăiere cu serul de anticorpi, ratele pozitive ale ELISA pe lichidul vitros au fost de până la 33% în rândul pacienților cu OT, ceea ce necesită investigații suplimentare cu privire la valoarea de tăiere adecvată pentru detectarea OT [9]. În cazurile tratate chirurgical, rămășițele organismelor Toxocara au fost ocazional detectate din specimene de vitrectomie obținute în timpul intervenției chirurgicale, care oferă dovezi directe ale infecției intraoculare a larvei Toxocara [40]. Examinarea citologică a umorului apos sau a probelor vitroase poate fi, de asemenea, utilă în confirmarea diagnosticului de OT. Cu toate acestea, în prezent nu există date disponibile cu privire la rata de detecție a citologiei vitroase sau a biopsiei la ochi cu OT și, prin urmare, citologia și biopsia pot fi rezervate pacienților cu suspectat OT preplanificat pentru chirurgie vitreoretinală.
TRATAMENT
Ochii cu OT pot fi tratați medical sau chirurgical, în funcție de gravitatea inflamației intraoculare și a afecțiunilor comorbide. În primul rând, terapia medicală trebuie luată în considerare în cazurile de inflamație activă. Tratamentul standard actual pentru toxocarioza oculară este administrarea de corticosteroizi la pacienții cu inflamație intraoculară activă. Corticosteroizii topici și sistemici sunt utili în gestionarea inflamației intraoculare și pot reduce opacificarea vitroasă și formarea membranei [9, 24, 39, 41, 42].
Rolul terapiei antihelmintice în OT rămâne controversat, deoarece nu au existat studii controlate randomizate privind utilizarea agenților antihelmintici pentru OT. Au fost publicate rezultatele din doar câteva studii controlate cu medicamente antihelmintice pentru toxocarioza sistemică [43, 44]. Deoarece vindecarea parazitologică nu poate fi evaluată exact, rezultatul utilizat în studiile publicate a fost pur și simplu o îmbunătățire a semnelor și simptomelor clinice. Albendazolul (400 mg administrat de două ori pe zi timp de 7-14 zile) este medicamentul standard recomandat pentru toxocariaza sistemică și pare a fi superior tiabendazolului (administrat la 50 mg/kg/zi timp de 3-7 zile) [43], care de asemenea inhibă puternic migrația larvelor [45]. Dietilcarbamazina (administrată la 3-4 mg/kg/zi timp de 21 de zile, începând de la 25 mg/zi pentru fiecare pacient adult și crescând doza progresiv) sa dovedit, de asemenea, eficientă pentru tratamentul toxocariozei sistemice [44].
Un raport în care există și larva subretinală mobilă distrusă prin fotocoagulare [46]. Într-un alt raport, ranibizumabul intravitreal s-a dovedit a fi eficient pentru tratamentul neovascularizației coroidiene secundare OT [47].
Terapia medicală cu corticosteroizi sistemici sau topici este eficientă pentru a reduce inflamația intraoculară și pentru a îmbunătăți simptomele asociate inflamației, dar are o eficacitate limitată pentru rezolvarea complicațiilor structurale din retină. Detașarea retinei, membrana epiretinală și opacitatea vitroasă persistentă sunt indicații chirurgicale frecvente pentru chirurgia vitreoretinală efectuată la ochi cu OT și mai mulți autori au raportat rezultatul tratamentului chirurgical. Giuliari și colab. [48] au raportat rezultate anatomice și funcționale bune ale tratamentului chirurgical la 45 de pacienți cu OT. În seria noastră de cazuri, 32 din 101 pacienți (31,7%) au necesitat tratament chirurgical, fiecare pentru membrana epiretinală (n = 19), opacitatea vitroasă (n = 9) și/sau detașarea retinei (n = 2). Rezultatul chirurgical de succes a fost atins la 68,4%, 88,9% și 50% dintre pacienții cu membrană epiretinală, opacitate vitroasă și respectiv detașare de retină, [9]. Prin furnizarea de modificări structurale, adică peelingul membranei, îndepărtarea opacificării vitroase sau atașarea retinei, intervenția chirurgicală în OT poate duce la stabilitate sau îmbunătățirea funcției vizuale.
PREVENIREA
În lipsa unei conștientizări suficiente a VT, creșterea gradului de conștientizare a publicului asupra toxocariazei și reducerea expunerii umane la speciile Toxocara sunt importante pentru prevenirea bolii. Pentru a reduce riscul de infecție, sursa de transmitere trebuie înțeleasă mai întâi.
Studiile anterioare au stabilit proprietatea asupra unui câine sau pisică ca factor de risc pentru infecția cu Toxocara. Contactul direct cu puii tratați și infectați a fost considerat o sursă importantă de transmitere. Cu toate acestea, sondajul la nivel național efectuat în Statele Unite a arătat că procentele de deținere a animalelor de companie în rândul pacienților OT au fost mai mici de 50% (45% pentru câine și 26% pentru pisică), sugerând că expunerea la puii netratați și infectați poate să nu explice suficient sursele de transmitere . Ingerarea accidentală a ouălor embrionate de către geofagie a fost, de asemenea, sugerată ca o altă sursă importantă de transmitere [1, 2, 7]. Deoarece boala apare de obicei la copii, ar trebui subliniate bunele practici de igienă, cum ar fi spălarea mâinilor, mai ales după expunerea la zone cu risc ridicat, cum ar fi cutii de nisip, parc în aer liber și locuri de joacă. Într-adevăr, lăzile cu nisip, parcurile în aer liber și locurile de joacă pot fi extrem de contaminate cu ouă embrionate de Toxocara, deoarece oamenii își plimbă în mod obișnuit animalele de companie în aceste locuri [2, 49, 50, 51, 52] și în condiții calde, ouăle embrionate pot rămâne viabile ani de zile [53]. De asemenea, proprietarii de animale de companie ar trebui sfătuiți să arunce fecalele cu promptitudine, să curețe frecvent zona de locuit a animalelor de companie și să-și ducă animalele la medicul veterinar pentru deparazitare regulată [16].
La pacienții adulți, sursa de transmitere poate fi oarecum diferită de cea a copiilor, deoarece ingestia accidentală de ouă embrionate este mai puțin probabilă să apară. Asocierea dintre carnea crudă, în special ficatul crud de vacă și toxocariaza a fost raportată recent la populația adultă [9, 14]. În unele țări asiatice, carnea nefiertă este consumată, mai ales de adulți, ceea ce poate crește numărul pacienților adulți cu toxocariază [15]. În Coreea, s-a găsit un istoric de ingestie de ficat de vacă crud la 60-90% dintre pacienții cu toxocarioză sistemică și la 80,8% din OT. Raportul de probabilități al VT a fost de 14,9 pentru ingestia de ficat de vacă crudă și 2,28 pentru ingestia de carne crudă [9]. Acest lucru indică faptul că sursa de infecție a toxocariazei și caracteristicile demografice ale pacienților pot diferi în funcție de tiparele geografice și comportamentale (în special, obiceiurile alimentare). Profesioniștii în sănătate publică ar trebui să ia în considerare contextul cultural local atunci când identifică sursele probabile de infecție la pacienții cu toxocariază și să-i educe pe oameni să nu mănânce carne nefierte pentru a preveni infecția cu Toxocara.
CONCLUZII
Înțelegerile noastre actuale cu privire la diagnosticul, tratamentul și prevenirea toxocariazei umane și a implicării oculare sunt limitate, deși este una dintre cele mai frecvente infecții zoonotice la nivel mondial. VT poate fi diagnosticat clinic cu semne specifice. Cu toate acestea, diagnosticul serologic care oferă dovezi cu privire la infecția cu Toxocara poate sprijini în mare măsură diagnosticul la pacienții cu prezumție OT. Astfel, este necesară îmbunătățirea diagnosticului suplimentar pentru o mai bună detectare și diagnosticarea promptă a OT. În special, cercetările viitoare ar trebui să exploreze sursele potențiale de infecție și să standardizeze tratamentul medical și chirurgical pentru OT, pentru a minimiza sechelele anatomice și funcționale. Educația publică și campania privind prevenirea digestiei alimentelor crude pentru animale, în special a ficatului, pot reduce, de asemenea, morbiditatea toxocariazei și a VT.
- Simptome de silicoză, cauze, diagnostic, tratament, prevenire
- Obezitatea la adulți - Simptome, diagnostic și tratament BMJ Best Practice
- Activitatea fizică în prevenirea și tratamentul hipertensiunii arteriale la obezi - PubMed
- Trauma glandei salivare O revizuire a diagnosticului și a tratamentului
- Obezitatea ficatului decât pentru a trata Obezitatea ficatului simptome, tratament și prevenire