Elisa Martini
1 Laborator de imunitate adaptivă, Centrul clinic și de cercetare Humanitas, Milano, Italia
Silvia Giugliano
2 Laborator de imunologie mucoasă și microbiotă, Centrul clinic și de cercetare Humanitas, Milano, Italia
3 Departamentul de Științe Biomedice, Universitatea Humanitas, Milano, Italia
Maria Rescigno
2 Laborator de imunologie mucoasă și microbiotă, Centrul clinic și de cercetare Humanitas, Milano, Italia
3 Departamentul de Științe Biomedice, Universitatea Humanitas, Milano, Italia
Marinos Kallikourdis
1 Laborator de imunitate adaptivă, Centrul clinic și de cercetare Humanitas, Milano, Italia
3 Departamentul de Științe Biomedice, Universitatea Humanitas, Milano, Italia
Abstract
Introducere: Funcția formelor selective de presiune în Treg
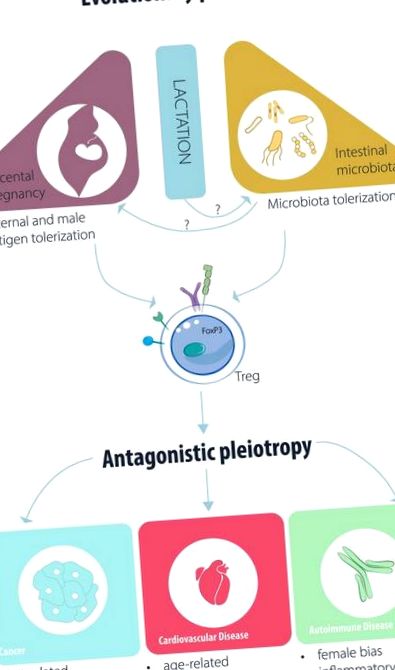
Sistemele biologice se dezvoltă ca soluții serendipitare la presiunea selectivă, conform teoriei evoluției. Evoluția celulelor T (Treg) reglatoare și a factorului de transcripție al regulatorului principal, foxp3 (1), trebuie să fi avut loc ca răspuns la presiunea selectivă care a conferit un avantaj vertebratelor care le dețin. În timp ce o formă timpurie de foxp3 există în peștele zebră (2), setul complet de domenii de foxp3 apare doar în ornitorincul mamifer non-placentar (3). În plus, elementul amplificator care este necesar pentru inducerea Treg indus (iTreg) în periferie, apare și în ornitorinc (4).
Ornitorincul este un mamifer care pune ouă, iar oul creează o barieră care separă antigenele paterne (care nu sunt de sine) de sistemul imunitar adaptiv matern. Absența unei bariere ar necesita un mecanism de suprimare a răspunsurilor materne anti-fetale, o cerință numită „paradox imunologic al sarcinii” de către pionierul transplantului Medawar (5). Pe de altă parte, toate mamiferele ulterioare (în ceea ce privește speciația) sunt placentare, au renunțat la ou, beneficiind de avantajul unui flux continuu de nutrienți către făt. Astfel, se poate specula că achiziția serendipită a unei subpopulații de celule T imunosupresoare ar fi putut permite eliminarea barierei de ou.
În sprijinul unei astfel de speculații, noi și alții am arătat că sarcina placentară cu un tată genetic diferit nu este posibilă în absența celulelor T reglatoare (6-8). Defectele celulelor Treg sunt asociate cu avort spontan crescut și preeclampsie la om (9, 10). Pe scurt, în timp ce un sistem imunitar adaptiv robust, așa cum s-a dezvoltat la vertebrate, este esențial în menținerea apărării sinelui împotriva agenților patogeni (11), evoluția celulelor Treg la mamiferele placentare ar fi putut permite gestionarea mai complexă a distincției dintre sine vs. „non-sinele aceleiași specii”. Recunoașterea non-sinelui aceleiași specii, care este centrală în sarcina placentară, este, în mod ironic, o problemă mult mai veche, deoarece Protochordatul care locuiește în mare, Botryllus, a trebuit să se ferească - și să nu tolereze - concurența indivizilor vecini din aceeași specie, procese moleculare nu prea diferite de cele ale celulelor Natural Killer (NK) (12). În sarcina mamiferelor, celulele NK uterine materne care interacționează cu molecule non-clasice de clasă I de histocompatibilitate majoră, cum ar fi HLA-G, independent de prezența sau absența aloantigenului, sunt esențiale pentru vascularizarea placentei, în special la începutul sarcinii (13)., 14).
Treg în timpul sarcinii: o populație fluctuantă, dar reglementată
Dovezile de la șoareci și oameni demonstrează că abundența celulelor Treg este modificată în timpul evenimentelor legate de sarcina placentară. Fluctuațiile periodice ale nivelurilor de Treg uterin (15) sau periferic (16) fac celulele mai abundente în timpul ferestrei fertile a ciclului menstrual/estru, astfel încât suprimarea poate avea loc în cazul unei sarcini. Aceste fluctuații sunt posibil determinate de estrogen, deoarece s-a demonstrat că estrogenul crește funcția Treg (17, 18), în timp ce ovariectomia care epuizează estrogenul reduce abundența celulelor Treg (19). Odată ce are loc fertilizarea, se poate observa o expansiune mult mai substanțială a celulelor Treg (6). În această expansiune, a fost demonstrat un rol pentru expansiunea Treg paternă și masculină a antigenului masculin; inițial ca răspuns la antigenele lichide seminale (20), precum și la antigenele paterne (8, 21), care pot explica expansiunea clonală a celulelor Treg în deciduă, dar nu și periferia la femeile gravide (10).
În mod curios, expansiunea asociată sarcinii poate fi întreruptă, în cazul în care apare o infecție uterină care ar putea pune în pericol fătul și mama (22). Dintr-o perspectivă evolutivă speculativă, ar fi selectate reduceri ale funcționalității Treg induse de agenți patogeni, deoarece ar scuti mama de agenți patogeni care s-ar putea extinde necontrolat într-un mediu imunosupresat. Un mecanism presupus poate implica recunoașterea agentului patogen de către celulele imune înnăscute producătoare de IL-6, blocând potențialul supresiv al Treg (23). Într-adevăr, IL-6 este asociată cu fertilitatea și patologiile legate de sarcină (24), iar citokina este, de asemenea, cunoscută pentru a media o conversie a celulelor Treg în celule pro-inflamatorii Th17 în artrita autoimună (25). Trebuie remarcat faptul că respingerea fetală indusă de semnalul de pericol poate fi mediată de limfocite invariante/semi-invariante, cum ar fi celulele iNKT (26), celulele T invariante asociate mucoasei (27) sau celulele T γδ (28).
Treg în Autoimunitate
Este rezonabil să ne întrebăm cum funcția cel mai adesea atribuită celulelor Treg, controlul autoimunității, se potrivește cu rolul lor în reproducerea placentară. Se știe că sarcina ameliorează temporar simptomele artritei reumatoide la majoritatea pacienților (29). Într-un model murin de artrită autoimună, am arătat că expansiunea Treg determinată de sarcină este într-adevăr responsabilă de această ameliorare (30).
Schiță a factorilor evolutivi putativi care afectează funcția Treg/iTreg și patogeneza bolii.
După menopauză și la bărbați: boli legate de vârstă
Treg și Rac
Legătura dintre inflamație și cancer este dublă. Pe de o parte, descoperiri ample au demonstrat că citokinele pro-inflamatorii pot spori șansele de carcinogeneză și instabilitate genetică (39). Suprimarea mediată de Treg a unei astfel de inflamații oncogene ar fi benefică. Astfel de evenimente se întâmplă în mod clar departe de condițiile observabile clinic ale pacienților cu cancer, al căror diagnostic apare mult după evenimentul cancerigen; acest lucru poate limita stimulentul de a studia rolul celulelor Treg în carcinogeneză. Cu toate acestea, chiar și în tumorile în creștere, dovezile au arătat că formarea capsulelor fibrotice care promovează tumora în jurul tumorilor de prostată are loc numai în prezența celulelor T proinflamatoare (40), a căror supresie selectivă ar fi benefică.
Pe de altă parte, cea mai importantă interacțiune clinică dintre imunitate și cancer este funcția anti-tumorală, pro-inflamatorie a imunosupravegherii (41), care a permis dezvoltarea imunoterapiei tumorale. Acesta din urmă, în cea mai aplicabilă formă de imunoterapie blocantă a punctului de control imun, se bazează pe reactivarea mediată de anticorpi a celulelor T proinflamatoare. Cu toate acestea, celulele Treg exprimă și utilizează moleculele țintă de imunoterapie CTLA-4 (42) și PD-1 (43), iar acțiunea supresivă a Treg poate inhiba imunitatea benefică antitumorală (44). De ce ar inhiba celulele Treg un răspuns antitumoral? Interpretată în funcție de semnalele pe care o celulă Treg le-ar fi putut evolua pentru a face față, o tumoare care exprimă auto-antigene și neo-antigene ar putea să nu fie atât de diferită de un făt, motorul supus selecției celulelor Treg. Genele și procesele care ajută la combaterea tumorilor solide nepediatrice, în creștere, nu au putut fi moștenite și selectate la mamifere, deoarece până foarte recent nu era posibil să supraviețuim și să ne reproducem după incidența cancerului.
Și totuși o soluție evidentă apare din studiul, desigur speculativ, al factorilor evolutivi ai funcției Treg. După cum sa presupus mai sus, suprimarea Treg s-ar putea prăbuși pentru a respinge un făt infectat, pentru a proteja mama de agentul patogen infectant. În acest context, așa cum a inițiat în principiu toxina Coley (45), strategiile de vaccinare care păcălesc sistemul imunitar în identificarea tumorii ca făt infectat pot reprezenta instrumente care sunt aliniate cu factorii evolutivi ai componentelor biologice pe care încercăm să le modulăm (46).
Treg și boala cardiovasculară
Mai recent, am identificat, prin secvențierea ARN cu o singură celulă, că celulele Treg s-au dovedit a fi infiltrarea în miocardul aflat în suferință, expres PD-1. Inhibarea PD-1 în inimile sănătoase a blocat supresia mediată de Treg, eliberând inflamația cardiacă, care, la rândul său, a dus la o reducere semnificativă a funcției cardiace (52). Acest lucru este interesant, întrucât s-a demonstrat că tratamentul anti-PD-1 la pacienții cu cancer uman duce ocazional la miocardită fulminantă mediată de celule T (53). Din fericire există o soluție, deoarece tratamentul cu CTLA-4-Ig al pacienților cu miocardită indusă de imunoterapie tumorală are un efect de salvare (54).
În IM care progresează către insuficiență cardiacă ischemică cronică, dovezi foarte recente sugerează că celulele Treg își pot pierde proprietățile imunosupresoare, devenind pro-inflamatorii și agravând rezultatul bolii (55). Rolul lor este oarecum mai puțin clar în faza incipientă a reparării post-MI, unde celulele T convenționale proinflamatorii pot fi utile pe termen scurt pentru a face față deteriorării extinse a țesutului (56, 57).
Treg și infecții
Treg poate diminua răspunsul împotriva agenților patogeni în timpul unei infecții, limitând daunele colaterale. În consecință, acest lucru duce și la persistența agentului patogen, care, la rândul său, mărește persistența imunității protectoare împotriva agentului patogen însuși (58). Totuși, simultan, inflamația asociată cu răspunsul limitează funcționalitatea celulelor Treg [59], o constatare care se potrivește cu inhibarea funcției Treg indusă de semnalele de pericol, menționată mai sus (23), sau într-adevăr de inflamația în sine, inclusiv în contexte de boli cardiovasculare (60).
Treg și Microbiota intestinală
Fătul care exprimă antigeni paterni nu este singurul „non-sine” pe care sistemul nostru imunitar adaptiv trebuie să-l tolereze prin intermediul celulelor Treg. Microbiota intestinală este esențială pentru supraviețuirea noastră și nu este respinsă (61), în ciuda atingerii unui număr foarte mare de celule în intestin (62). Tolerarea bacteriilor „benefice” poate fi mediată prin suprimarea mediată de Treg (63), în timp ce bacteriile „dăunătoare” pot fi atacate de subpopulațiile de celule T pro-inflamatorii (64). Dimpotrivă, atât celulele anti-inflamatorii iTreg cât și celulele pro-inflamatorii Th17 sunt induse în intestin, prezentând o plasticitate care depinde de microbiota (65, 66). De exemplu, sa demonstrat că capsula imunomodulatoare poliacaridă A (PSA) a Bacteroidetes fragilis induce celule Treg care secretă IL-10 în intestin, limitând inflamația intestinală (67). Mai mult, metaboliții bacterieni, cum ar fi acizii grași cu lanț scurt (SCFA), sunt implicați în diferențierea Treg (68-70).
Consecințele plasticității induse de microbiotă pot afecta patogeneza bolii. Efectul anti-tumoral, proinflamator al anti-CTLA-4 sau anti-PD-1, descris mai sus, a fost abolit în sistemele experimentale în care microbiota intestinală a fost eliminată (71, 72), demonstrând potența microbiotei mediată efecte. De acord cu aceste rezultate izbitoare, multiple studii translaționale au evidențiat acum modul în care microbiomul pacienților care răspund la tratamentul anti-PD-1 este semnificativ diferit de cel al celor care nu răspund (73) și modul în care tratamentul cu antibiotice în combinație cu anti-PD Imunoterapia -1/anti-PD-L1 poate avea un efect direct asupra ratei de supraviețuire a pacienților (74).
În mod similar, dovezile emergente demonstrează că microbiomul poate afecta în mod semnificativ patogeneza și rezultatul bolilor cardiovasculare. Alterarea microbiotei intestinale a fost asociată cu formarea leziunilor aterosclerotice, după cum a relevat analiza metagenomului intestinal la pacienți (75). SCFA produse de microbiote intestinale s-au dovedit chiar a afecta reglarea tensiunii arteriale (76). Descoperirile de mai sus exemplifică modul în care microbiota intestinală, posibil și prin efectele lor asupra populațiilor iTreg/Th17, au roluri de reglementare substanțiale, deși încă în mare parte neexplorate, asupra principalelor grupuri de boli care determină mortalitatea la nivel mondial.
Observații finale - Un rol evolutiv pentru flora intestinală a mamiferelor în amonte de Treg și sarcina placentară?
Interacțiunea dintre microbiota intestinală și Treg, mai ales dacă presupunerea că prima ar fi putut fi un motor pentru evoluția acesteia din urmă este valabilă, oferă noi mijloace de investigare a aspectelor funcționale ale celulelor Treg. Pe termen lung, s-ar spera că acest lucru va duce la strategii terapeutice inovatoare, în contextul autoimunității, cancerului și bolilor cardiovasculare.
Contribuțiile autorului
Toți autorii enumerați au adus o contribuție substanțială, directă și intelectuală la lucrare și au aprobat-o pentru publicare.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
- Boală hepatică grasă nealcoolică și risc cardiovascular
- Sarcina și boala celiacă Grupul de intoleranță la gluten
- Nutriția sarcinii cu Bump; Dincolo de nutriție de Rosie Letts
- Sarcina post-gastrectomie - fără stomac pentru cancer
- Celulele senescente ca o cauză a bolii hepatice grase legate de vârstă; Lupta împotriva îmbătrânirii!