Sandeep Chhabra
a Medicinal Chemistry and Drug Action, Monash Institute of Pharmaceutical Sciences, Monash University, 381 Royal Parade, Parkville, Victoria 3052, Australia
b Divizia CSIRO de tehnologii moleculare și de sănătate, 343 Royal Parade, Parkville, Victoria 3052, Australia
Janet Newman
b Divizia CSIRO de tehnologii moleculare și de sănătate, 343 Royal Parade, Parkville, Victoria 3052, Australia
Thomas S. Peat
b Divizia CSIRO de tehnologii moleculare și de sănătate, 343 Royal Parade, Parkville, Victoria 3052, Australia
Ross T. Fernley
b Divizia CSIRO de tehnologii moleculare și de sănătate, 343 Royal Parade, Parkville, Victoria 3052, Australia
Joanne Caine
b Divizia CSIRO de tehnologii moleculare și de sănătate, 343 Royal Parade, Parkville, Victoria 3052, Australia
Jamie S. Simpson
a Medicinal Chemistry and Drug Action, Monash Institute of Pharmaceutical Sciences, Monash University, 381 Royal Parade, Parkville, Victoria 3052, Australia
James D. Swarbrick
a Medicinal Chemistry and Drug Action, Monash Institute of Pharmaceutical Sciences, Monash University, 381 Royal Parade, Parkville, Victoria 3052, Australia
Abstract
6-Hidroximetil-7,8-dihidropterin pirofosfokinaza (HPPK) catalizează transferul dependent de Mg 2+ al pirofosfatului din ATP în 6-hidroximetil-7,8-dihidropterină (HMDP), formând 6-hidroximetil-7,8-dihidropterină pirofosfat, care este un pas critic în calea de novo acid folic-biosinteză. Cristalele de calitate a difracției de HPPK de la speciile relevante din punct de vedere medical de Staphylococcus aureus au fost crescute în prezența sulfatului de amoniu sau a malonatului de sodiu și difractate la o rezoluție mai bună de 1,65 Å. Cristalele au aparținut grupului spațial P21, cu parametrii unității celule a = 36,8, b = 76,6, c = 51,5 Å, α = γ = 90,0, β = 100,2 °. Cristalele conțineau două molecule pe unitate asimetrică, cu un volum pe greutate proteină (V M) de 2,04 Å 3 Da -1 și un conținut estimat de solvent de 39,6%.
1. Introducere
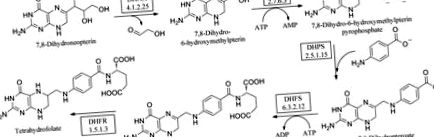
Folații sunt esențiali pentru toate celulele vii pentru creștere. În consecință, enzimele acestei căi (Fig. 1 () au fost validate ca ținte pentru antimicrobieni și antifungici. Forma redusă de folat, tetrahidrofolatul (THF), participă la mai multe transferuri importante cu un singur transfer, care sunt critice pentru biosinteza timidinei, glicinei și metioninei și vitale pentru replicarea ADN-ului (Schirch & Strong, 1989 ▶). Calea de novo folat-biosinteză convertește 7,8-dihidroneopterină în 7,8-dihidropteroat utilizând ATP și acid para-aminobenzoic (pABA). Acesta cuprinde trei enzime angajate, dintre care HPPK este a doua. Inițial, dihidroneopterin aldolaza (DHNA) catalizează reacția de epimerizare transformând 7,8-dihidronopterină în 6-hidroximetil-7,8-dihidropterină (HMDP). HPPK transferă apoi un pirofosfat din ATP legat, rezultând 6-hidroximetil-7,8-dihidropterin pirofosfat (HMDPP). DHPS condensează HMDPP cu pABA, formând 7,8-dihidropteroat (DHP; Bermingham & Derrick, 2002 (). Adăugarea enzimatică a glutamatului este urmată de reducerea cu DHFR, producând 5,6,7,8-tetrahidrofolat (THF). Aceste două reacții din urmă nu sunt specifice microbilor, plantelor sau protozoarelor. Cu toate acestea, în cazul diferențelor structurale DHFR între enzimele umane și bacteriene, au fost utilizate antimicrobiene selective (cum ar fi TMP) sau, în cazul enzimei umane, tratamente pentru cancer precum metotrexatul.
Calea folatului.
Aici, prezentăm o investigație cristalografică preliminară a enzimei S. aureus (SaHPPK) ca preludiu către înțelegerea mecanismului său catalitic și ca un pas inițial către proiectarea rațională a unor noi terapii.
2. Materiale și metode
2.1. Exprimarea și purificarea
O plasmidă pET28a care conține secvența SaHPPK sintetizată (Geneart) a fost donată cu o etichetă de hexahistidină N-terminală și un situs de clivare a trombinei. Celulele E. coli BL21 (DE3) transformate cu plasmida au fost crescute peste noapte în 10 ml mediu 2 × YT suplimentat cu 100 pg ml -1 kanamicină pentru selecție. Cultura peste noapte a fost apoi subcultivată în 2 × YT proaspete (1 l) și crescută la 310 K până când OD600 a ajuns la 0,5-0,8. S-a adăugat izopropil β-d -1-tiogalactopiranozidă (IPTG) la o concentrație finală optimizată de 0,3 mM și expresia a fost efectuată la 301 K timp de 5 ore. Culturile au fost centrifugate la 5000g și 278 K timp de 10 min și celulele au fost resuspendate în 100 ml de HEPES 50 mM, glicerol 5% pH 8,0. A fost adăugată o tabletă completă de cocktail-inhibitor de protează fără EDTA (Roche) împreună cu lizozima; acesta din urmă a fost adăugat la o concentrație finală de 0,2 mg ml -1. După 10 min, celulele au fost sonicate, celula de resturi a fost îndepărtată prin centrifugare la 18 000 g timp de 30 de minute și supernatantul a fost filtrat (filtru de 0,45 µm).
Supernatantul a fost încărcat pe o coloană Ni-NTA IMAC (Qiagen) și proteina nelegată a fost spălată cu 10 mM imidazol în 50 mM tampon HEPES - NaOH, 0,3 M NaCl pH 8,0. Proteina marcată a fost eluată din coloana IMAC cu 250 mM imidazol în tamponul HEPES - NaCI; proteina nemarcată a fost generată prin digestia pe coloană efectuată cu trombină pentru a elimina eticheta His N-terminală. O unitate de trombină (Sigma - Aldrich) a fost utilizată pe miligram de proteină marcată. Proteina scindată a fost eluată din coloană cu 10 mM imidazol în tamponul HEPES - NaCI. Ambele versiuni etichetate și neetichetate ale proteinei au fost purificate în continuare pe o coloană 16/60 cu excludere a dimensiunii Superdex 75 (GE Healthcare) și eluate cu 50 mM HEPES, 2 mM DTT pH 8,0. Fracțiile au fost analizate folosind un gel SDS-PAGE de 15% cu colorare Coomassie și fracțiunile care conțin proteine au fost reunite și concentrate la 4,5 mg ml -1 folosind un dispozitiv centrifugal de ultrafiltrare cu greutate moleculară de 3 kDa (Amicon). Randamentele de proteine marcate și clivate au fost în mod tipic ∼35-50 și respectiv ∼15-25 mg pe litru de cultură, respectiv. Toate probele au fost înghețate rapid și depozitate la 193 K.
2.2. Cristalizare
Experimentele de cristalizare a proteinelor (atât pentru proteinele marcate, cât și pentru cele neetichetate) au fost efectuate la nodul CSIRO al Centrului de Cristalizare Colaborativă Bio21 (C3), folosind inițial ecranele de cristal comerciale PACT și JCSG + Suite (Qiagen) la 281 și 293 K. Un ecran cu gradient de pH versus sare a fost, de asemenea, testat la ambele temperaturi. Toate ecranele au folosit metoda de difuzie a vaporilor cu picături de ședere cu picături constând din 250 nl soluție de proteină și 250 nl soluție rezervor și un volum rezervor de 50 ul. Cristalizările s-au efectuat în plăci SD-2 de așezare (IDEX Corporation) și au fost instalate folosind un robot Phoenix (Art Robbins Industries).
Cristale mici multiple sau înfrățite au fost observate după o săptămână în mai multe condiții de sulfat de amoniu și malonat de sodiu. O strategie secvențială de microsemănare a fost utilizată pentru a îmbunătăți dimensiunea și calitatea cristalelor. Semințele au fost create folosind un protocol de semințe (Luft & DeTitta, 1999 ▶; Newman și colab., 2008 ▶) și au fost introduse în picăturile de cristalizare la configurare utilizând protocolul multi-aspirat al unui robot Mosquito (TTP Labtech). Cu toate acestea, chiar și după mai multe runde de optimizare a microsemănării, aproape toate cristalele au fost încă parțial crescute. Am încercat, de asemenea, screening-ul aditiv cu ecrane aditive disponibile comercial (inclusiv Additive Screen HT de la Hampton Research și The OptiSalt Suite de la Qiagen), precum și adăugarea diferiților ioni metalici pentru a găsi condiții de cristalizare care să producă cristale unice.
2.3. Colectarea și analiza datelor
Pentru colectarea de date cu raze X, cristalele au fost crioprotejate prin adăugarea unei soluții de rezervor de reserl la picătură și adăugarea ulterioară a 1,2 APl AP/E Core 150 ulei (Mobil-Exxon) la picătură. Cristalele au fost criocoolizate într-un flux de azot după ce au fost trase prin interfața de ulei AP/E. Datele au fost colectate pe linia fasciculului de microfocus (MX2) al sincronului australian. 720 de imagini de oscilație de 0,5 ° au fost colectate folosind un detector ADSC Quantum 315. Distanța cristal-detector a fost de 250 mm și expunerea a fost de 1 s pentru fiecare imagine. Datele de difracție au fost prelucrate folosind MOSFLM (Leslie, 1992 și) și SCALA/TRUNCATE (Collaborative Computational Project, Numărul 4, 1994 (). Un model de difracție al SaHPPK este prezentat în Fig. 2 ▶ .
- Prognoza pieței agenților de încălzire a produselor cosmetice, analiza tendințelor și urmărirea concurenței - Global
- Exercițiul fizic și pierderea în greutate la adulții obezi în vârstă cu osteoartrita genunchiului, un studiu preliminar - PubMed
- ANALIZA DENSITOMETRICĂ A COMPOZIȚIEI CORPORALE REVIZUIREA UNOR ASUMĂRI CANTITATIVE - Brožek -
- Uleiul de semințe negre funcționează cu adevărat Analiza științifică a beneficiilor
- Suplimente alimentare Ce este într-un nume Ce este în sticlă Marcus - 2016 - Testarea și analiza medicamentelor