Abstract
fundal
Inflamația mușchilor scheletici indusă de obezitate este un factor major la pierderea/atrofierea mușchilor scheletici și este implicată în complicații metabolice, cum ar fi rezistența la insulină. Se știe că factorul de creștere a fibroblastelor 21 (FGF21) este un important regulator metabolic cu proprietăți antiinflamatorii. Cu toate acestea, efectul FGF21 asupra atrofiei mușchilor scheletici este neclar. În acest studiu, am investigat efectul deficitului de FGF21 asupra inflamației și atrofiei mușchilor scheletici indusă de obezitate la șoareci.
Rezultate
Expresia factorilor atrofici (MuRF1 și Atrogin-1) a fost reglată în sus la nivelurile de mARN și/sau proteine din mușchiul scheletic al șoarecilor obezi deficienți în FGF21 comparativ cu șoarecii obezi de tip sălbatic. Acest lucru a fost însoțit de o creștere a nivelurilor de citokine inflamatorii (TNFα și MCP-1) și o reducere a fosforilării AMPK. Tratamentul cu FGF21 a suprimat în mod semnificativ răspunsurile inflamatorii și atrofice mediate de TNFα în miotuburile cultivate, iar acțiunile FGF21 au fost tocite de compusul inhibitor AMPK C.
Concluzie
Aceste constatări sugerează că deficitul de FGF21 agravează inflamația indusă de obezitate și răspunsurile atrofice la nivelul mușchiului scheletic al șoarecilor obezi, iar FGF21 poate proteja atrofia mediată de inflamație prin calea AMPK.
fundal
Obezitatea este strâns asociată cu pierderea/atrofia masei musculare scheletice denumită sarcopenie, care contribuie la fragilitate/dizabilitate fizică [1, 2] și la complicații metabolice, cum ar fi rezistența la insulină și diabetul de tip 2 [3]. Inflamația mușchilor scheletici indusă de obezitate, caracterizată prin niveluri crescute de citokine inflamatorii, cum ar fi factorul de necroză tumorală α (TNFα) și interleukina-6 (IL-6), promovează un dezechilibru în sinteza și degradarea proteinelor musculare care duc la atrofia musculară [4]. În special, sistemul ubiquitin-proteazom, o cale majoră de degradare a proteinelor, este cunoscut ca fiind esențial pentru risipa musculară: sistemul degradează proteinele musculare în peptide mici, inclusiv atrofia musculară F-box (MAFbx, numită atrogin-1) și inelul muscular degetul 1 (MuRF1) prin reacții enzimatice dependente de adenozin trifosfat [5,6,7]. Se știe că TNFα induce direct calea ubiquitină-proteazom, prin activarea factorului nuclear-kappa B (NF-κB) în mușchiul scheletic [8, 9]. Cu toate acestea, moleculele implicate în atrofia mușchilor scheletici indusă de obezitate rămân evazive.
În acest studiu, am demonstrat că deficiența FGF21 agravează răspunsurile atrofice induse de obezitate și inflamația în mușchiul scheletic al șoarecilor hrăniți cu HFD. De asemenea, tratamentul cu FGF21 protejează răspunsurile atrofice induse de TNFα în celulele musculare, iar acest lucru a fost inversat de un inhibitor de proteină kinază (AMPK) activat de AMP.
Materiale și metode
Cultura și tratamentul celular
Linia celulară de mioblast murin C2C12 (5 × 105 celule/ml) a fost crescută la 37 ° C în 5% CO2 în DMEM (Life Technologies, Grand Island, NY, SUA) conținând 10% FBS (Life Technologies) și 1% penicilină -streptomicina (Life Technologies). La o confluență de 95-100%, mediul a fost înlocuit cu mediu de diferențiere [DMEM plus 2% ser de cal (Life Technologies)], care a fost schimbat după 2 zile. Pentru a examina efectele FGF21 asupra atrofiei musculare induse de TNFα, miotuburile diferențiate au fost tratate timp de 24 de ore cu 100 ng/ml de TNFα (Pepro Tech), rmFGF21 (Creative Biomart, Shirley, NY, SUA) sau ambele medicamente în combinație. Pentru a examina legătura dintre efectele FGF21 asupra atrofiei musculare induse de TNFα și AMPK, miotuburile C2C12 au fost tratate cu rmFGF21, 20 μM compus C (inhibitor AMPK, Sigma) și/sau 0,5 mM 5-aminoimidazol-4-carboxamidă ribonucleotidă ( AICAR, activator AMPK, Sigma).
Experiment pe animale
Șoarecii cu deficiență de FGF21 de corp întreg (knockout FGF21/KO) pe un fundal C57BL/6 au fost achiziționați de la Laboratorul Jackson (Bar Harbor, ME, SUA) și crescuți într-o unitate specifică pentru animale fără patogeni de la Universitatea din Ulsan. Șoarecii masculi cu deficit de FGF21 și tipul lor sălbatic (WT) la vârsta de 7 săptămâni au fost adăpostiți individual în cuști de plastic cu un ciclu de întuneric de 12 ore: 12 ore. Pentru a examina efectele FGF21 asupra atrofiei mușchilor scheletici la obezitate, șoarecii au fost hrăniți cu o dietă bogată în grăsimi (HFD) (60% din calorii ca grăsime din untură de porc și soia; Research Diets, New Brunswick, NJ, SUA) timp de 12 săptămâni și li s-a oferit acces gratuit la alimente și apă. Animalele au fost sacrificate prin asfixiere cu CO2, iar mușchii lor au fost disecați. Toate procedurile și îngrijirea animalelor au fost efectuate conform protocoalelor și liniilor directoare aprobate de Comitetul de îngrijire și utilizare a animalelor de la Universitatea din Ulsan (LNY-16-020).
Activitatea NF-κB
Activitatea de legare a ADN-ului NF-κB a fost evaluată utilizând un kit NAM-κB p65 TransAM (Active Motif, Rixensart, Belgia). Probele de omogenate tisulare sau miotuburi normalizate pentru conținutul de proteine au fost incubate cu oligonucleotide imobilizate conținând un site de legare consens NF--B. Activitatea de legare a ADN-ului a fost analizată cu anticorpi specifici pentru subunitățile NF-κB conform instrucțiunilor producătorului (motiv activ).
Analiza PCR în timp real
ARN-ul total a fost extras din miotuburi sau probe de țesut muscular cu tri-reactiv (Life Technologies, Carlsbad, CA, SUA). Două alicote de micrograme de ARN total au fost transcrise invers în ADNc utilizând transcriptaza inversă M-MLV (Promega, Madison, WI, SUA). Amplificarea PCR în timp real a ADNc a fost efectuată utilizând kitul SYBR premix Ex Taq (TaKaRa Bio Inc., Foster, CA, SUA) cu un termic Cycler Dice (TaKaRa Bio Inc., Otsu, Siga, Japonia). Toate reacțiile au fost efectuate conform aceluiași program: 95 ° C timp de 10 s, 45 de cicluri la 95 ° C timp de 5 s și 60 ° C timp de 30 s. Rezultatele au fost analizate folosind software-ul Real Time System TP800 (TaKaRa Bio Inc.) și toate valorile au fost normalizate la nivelurile genei de menaj, β-actină. Primerii utilizați în analiză sunt enumerați în Tabelul 1.
Analiza Western blot
Țesuturile și celulele au fost omogenizate în tampon de liză conținând 150 mM NaCI, 50 mM Tris-HCI, 1 mM EDTA, 50 mM NaF, 10 mM Na4P2O7, 1% IGEPAL, 2 mM Na3VO4, 0,25% cocktail inhibitor de protează și 1% inhibitor de fosfatază cocktail. Omogenatele au fost centrifugate la 12.000 g timp de 20 minute la 4 ° C. Probele care conțin 10
100 μg de proteine totale au fost supuse analizei Western blot folosind anticorpi policlonali specifici pentru MuRF1 (1: 1000, # sc-32,920, Santa Cruz Biotechnology, Santa Cruz, CA, SUA), Atrogin-1 (1: 1000, # AP2041, ECM Biosciences, Versailles, Kentucky, SUA), factor de inhibare eucariotă fosforilat 2 α (eIF2α, 1: 1000, # 3597, Cell Signaling Technology, Danvers, MA, SUA), eIF2α (1: 1000, # 9722, Cell Signaling), proteină kinază fosforilată cu ARN asemănător cu reticul endoplasmatic kinază (PERK, 1: 1000, # 12814, Signalway Anticody, College Park, MD, SUA), PERK (1: 1000, # 3192, Cell Signaling), fosforilată-AMPK (1: 1000, # 2531, Cell Signaling), AMPK (1: 1000, # 2332, Cell Signaling) și α-tubulin (1: 5000, ab7291, Abcam, Cambridge, MA, SUA). Benzile de proteine au fost detectate folosind un kit de chemiluminescență îmbunătățit (PerkinElmer, Waltham, MA, SUA) și au fost estimate folosind ImageQuant LAS4000 (GE Healthcare). Intensitățile proteinelor au fost cuantificate prin densitometrie utilizând software-ul Image J.
Analiza histologică
Țesuturile musculare scheletice (cvadriceps) au fost fixate peste noapte la temperatura camerei în 10% formaldehidă și încorporate în parafină. Țesuturile au fost secționate (8-μm grosime), colorate cu hematoxilin-eozină (H&E), montate pe lamele de sticlă. Secțiunile colorate au fost observate cu un microscop Axio-Star Plus (Carl Zeiss, Gottingen, Germania). Diametrele fibrelor musculare au fost determinate utilizând software-ul microscopului AxioVision. Patru câmpuri microscopice pentru probe au fost numărate la o mărire de 200x.
analize statistice
Rezultatele sunt prezentate ca medie ± SEM a valorilor obținute din experimente repetate. Toate experimentele au fost repetate de 3-4 ori. Analiza statistică a fost efectuată utilizând testul t Student sau ANOVA unidirecțional (analiza varianței) urmat de testul de comparație multiplă Newman-Keuls cu software-ul Prism 5.0 (Graphic Pad, San Diego, CA, SUA). Diferențele au fost considerate semnificative la P
Rezultate
Knockout-ul FGF21 induce răspunsuri atrofice în mușchiul scheletic al șoarecilor hrăniți cu HFD
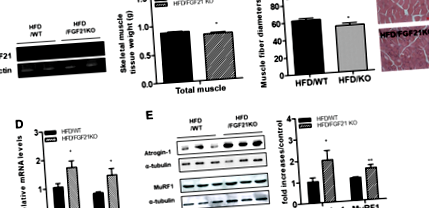
În acest studiu, am examinat dacă absența FGF21 induce un răspuns atrofic indus de obezitate în mușchiul scheletic. Am confirmat mai întâi că ARNm FGF21 a fost absent din mușchiul scheletic al șoarecilor cu deficit de FGF21 (Fig. 1a). Greutatea corporală a șoarecilor cu deficiență de FGF21 cărora li s-a administrat HFD nu a fost diferită de cea a șoarecilor WT hrăniți cu HFD (HFD/WT: 44,75 ± 1,65 g, HFD/FGF KO: 45,61 ± 1,09 g). Greutățile țesutului muscular scheletic au fost mai mici la șoarecii cu deficit de FGF21 alimentați cu HFD decât la șoarecii hrăniți cu HFD (Fig. 1b). Examenul histologic al secțiunilor transversale de cvadriceps a arătat că diametrul mediu al fibrelor musculare a fost mai mic la șoarecii deficienți cu FGF21 alimentați cu HFD decât șoarecii WT alimentați cu HFD (Fig. 1c). Apoi, am determinat răspunsurile atrofice la mușchiul scheletic al șoarecilor cu deficit de WT și FGF21 hrănite cu HFD. Așa cum se arată în FIG. 1d, nivelurile de transcriere ale genelor atrofice, cum ar fi MuRF1 și Atrogin-1, au fost reglate în sus în mușchiul scheletic al șoarecilor deficienți FGF21 alimentați cu HFD comparativ cu șoarecii WT alimentați cu HFD. Analiza Western blot a arătat că nivelurile de proteine atrofice (MuRF1 și Atrogin-1) au fost crescute la șoarecii cu deficit de FGF21 alimentați cu HFD comparativ cu șoarecii WT alimentați cu HFD (Fig. 1e).
Knockout-ul FGF21 induce inflamația și stresul reticulului endoplasmatic (ER) în mușchiul scheletic al șoarecilor hrăniți cu HFD
Apoi, am determinat efectul deficitului de FGF21 asupra răspunsurilor inflamatorii la șoarecii obezi HFD. Nivelurile de expresie ale citokinelor inflamatorii au fost semnificativ reglate în sus în mușchiul scheletic al șoarecilor deficienți de FGF21 alimentați cu HFD comparativ cu cei ai șoarecilor WT alimentați cu HFD (Fig. 2a). Ulterior, am confirmat că molecula de semnalizare inflamatorie estimată de activitatea subunității NF-κB p65 este îmbunătățită în mușchiul scheletic al șoarecilor deficienți FGF21 alimentați cu HFD (Fig. 2b). Împreună cu acest lucru, am observat niveluri ale mai multor markeri de stres ER (p-eIF2α și p-PERK) și expresia mARN a proteinei omoloage (CHOP) a proteinei de legare a amplificatorului CCAAT care au fost crescute în mușchiul scheletic al FGF21-alimentat cu HFD șoareci deficienți, comparativ cu șoarecii WT hrăniți cu HFD (Fig. 2c-d).
Efectele FGF21 asupra răspunsurilor atrofice induse de TNFα în miotuburi
Producția de TNFα este crescută în stările inflamatorii induse de obezitate și este implicată ca un mediator major al atrofiei musculare. Aici, am examinat mai întâi efectul tratamentului FGF21 asupra atrofiei musculare induse de TNFα în miotuburile C2C12 prin analiza modificărilor aspectului morfologic al miotuburilor C2C12 tratate cu TNFα. Tratamentul cu TNFα a redus semnificativ diametrul miotubului (Fig. 3a), în timp ce tratamentul cu FGF21 a restabilit complet reducerea diametrului miotubului indusă de TNFα (Fig. 3a). Ulterior, am examinat dacă FGF21 modifică sau nu expresia Atrogin-1 și MuRF1, care sunt markeri de atrofie musculară. Pentru aceasta, miotuburile au fost tratate cu TNFa, iar markerii atrofici au fost determinați prin RT-PCR și/sau analize Western blot. Tratamentul cu FGF21 a redus semnificativ nivelurile de transcripție ale Atrogin-1 și MuRF1 (Fig. 3b), precum și nivelurile reduse de exprimare a proteinelor Atrogin-1 și MuRF1 în miotuburile C2C12 tratate cu TNFα (Fig. 3c și d). În continuare am examinat dacă tratamentul FGF21 pe miotuburile C2C12 stimulate de TNFα a afectat stresul ER și căile de semnalizare NF-κB. Tratamentul FGF21 al miotuburilor C2C12 tratate cu TNFα a condus la scăderea fosforilării eIF2α (Fig. 3e) și la inactivarea NF-κB (Fig. 3f).
rmFGF21 a activat AMPK în celulele C2C12 și mușchiul scheletic al șoarecilor obezi hrăniți cu HFD
Pentru a confirma dacă efectul FGF21 asupra atrofiei musculare scheletice induse de obezitate a fost legat de AMPK, am investigat fosforilarea AMPK prin Western blot. Deficitul de FGF21 a scăzut semnificativ fosforilarea AMPK în mușchiul șoarecilor hrăniți cu HFD (Fig. 4a). Incubarea miotuburilor C2C12 cu rmFGF21 a dus la o creștere dependentă de doză a fosforilării AMPK (Fig. 4b). Mai mult, am investigat dacă AMPK este responsabil pentru medierea efectului rmFGF21. Compusul inhibitor AMPK C a suprimat acțiunile inhibitoare ale rmFGF21 asupra răspunsurilor atrofice induse de TNFα în miotuburi (Fig. 4c). Acest rezultat indică faptul că acțiunea FGF21 este mediată prin activarea AMPK.
Discuţie
Concluzie
În concluzie, demonstrăm că deficiența FGF21 agravează inflamația și atrofia mușchilor scheletici indusă de obezitate la șoarecii obezi hrăniți cu HFD, însoțită de activarea NF-κB și suprimarea fosforilării AMPK. Tratamentul FGF21 în celulele musculare protejează împotriva răspunsurilor atrofice induse de TNFα prin calea AMPK. FGF21 poate fi o țintă potențială în combaterea atrofiei musculare scheletice legate de obezitate.
Disponibilitatea datelor și a materialelor
Toate datele generate sau analizate în timpul acestui studiu sunt incluse în acest articol publicat.
- Frontiere care se adaptează la frig Un rol pentru factorul de creștere endogen al fibroblastelor 21 in
- Deficitul de hormon de creștere la adulți Cauze, simptome și tratament
- Efectele unei carențe dietetice de cupru asupra activităților factorului de coagulare plasmatică la bărbați și femei
- Performanța creșterii și caracteristicile carcasei Răspunsuri la boabele de distilatoare uscate cu soluții alimentate cu
- Efectul bromocriptinei asupra răspunsurilor insulinei, hormonului de creștere și prolactinei la arginină în obezitate