Omar M.E. Abdel-Salam
1 Departamentul de toxicologie și narcotice, Centrul Național de Cercetări, Cairo, Egipt
Eman R. Youness
2 Departamentul de Biochimie Medicală, Centrul Național de Cercetări, Cairo, Egipt
Nadia A. Mohammed
2 Departamentul de Biochimie Medicală, Centrul Național de Cercetări, Cairo, Egipt
Safaa M. Youssef Morsy
2 Departamentul de Biochimie Medicală, Centrul Național de Cercetări, Cairo, Egipt
Enayat A. Omara
3 Departamentul de patologie, Centrul Național de Cercetări, Cairo, Egipt
Amany A. Sleem
4 Departamentul de farmacologie, Centrul Național de Cercetări, Cairo, Egipt
Abstract
Introducere
Acidul citric (acidul 2-hidroxi-1,2,3-propan-tricarboxilic) este un acid organic slab găsit în cele mai mari cantități în citrice, cum ar fi lămâia, grapefruitul, mandarina și portocala. Sucurile de lămâie și lime sunt surse bogate. 9 Este folosit ca conservant natural și, de asemenea, pentru a adăuga un gust acid (acru) la alimente și băuturi răcoritoare. 10 Fiind o componentă a acidului tricarboxilic sau a ciclului Krebs, acidul citric se găsește în toate țesuturile animale ca substanță intermediară în metabolismul oxidativ. Studiile au indicat faptul că citratul scade peroxidarea lipidelor și reglează în jos inflamația prin reducerea degradării celulelor polimorfonucleare și atenuarea eliberării mieloperoxidazei, elastazei, interleukinei (IL) -1β și a factorului plachetar 4. 11-13 In vitro, citratul a îmbunătățit funcția endotelială prin reducerea inflamației inflamatorii. markeri și diapezeza neutrofilelor în scădere în hiperglicemie. 14 Mai mult, acidul citric s-a dovedit că reduce leziunile hepatocelulare evocate la șobolani de tetraclorura de carbon. 15 Acidul citric s-ar putea astfel dovedi valoros în scăderea stresului oxidativ.
Astfel, având în vedere efectele antioxidante și antiinflamatorii pentru citrat raportate chiar acum și deoarece anticoagularea citratului a fost utilizată la pacienții cu afecțiuni critice, s-a părut pertinent să se studieze efectul administrării acidului citric asupra stresului oxidativ și a leziunii țesuturilor într-un model a bolilor inflamatorii sistemice cauzate de administrarea intraperitoneală (ip) de lipopolizaharide (LPS) la șoareci. LPS este un component al pereților celulari ai bacteriilor gram-negative. Atunci când este administrat sistemic, LPS stimulează puternic celulele imune din periferie (prin intermediul proteinelor din membrana plasmatică, de exemplu, receptorul cu taxă 4 [TLR4] și CD14) pentru a elibera citokine proinflamatorii, cum ar fi factorul de necroză alfa (TNF-α), IL -1β și IL-6 în periferie și creier. Acest lucru are ca rezultat dezvoltarea sistemică și a neuroinflamării. 16-19 endotoxemie indusă de LPS este un model bine stabilit pentru infecția cu bacterii gram-negative și este utilizată pe scară largă pentru a studia efectele endotoxinei asupra țesutului/organelor periferice și a influenței inflamației sistemice asupra creierului.
Materiale și metode
Animale
Au fost folosiți șoareci albini masculi elvețieni care cântăresc 22-25 g (vârsta 5-6 săptămâni). Șoarecii au fost obținuți din colonia de animale a Centrului Național de Cercetare. Hrana și apa standard de laborator au fost furnizate ad libitum. Procedurile la animale au fost efectuate în conformitate cu Comitetul de etică al Centrului Național de Cercetare și au urmat recomandările Institutului Național de Sănătate Ghid pentru îngrijirea și utilizarea animalelor de laborator (Publicația nr. 85-23, revizuită 1985).
Droguri și substanțe chimice
S-a utilizat o endotoxină Escherichia coli purificată, liofilizată (Serotipul 055: B5; Sigma); a fost dizolvat în ser fiziologic steril, alicotat și congelat la -20 ° C. Aceleași soluții stoc au fost utilizate pentru toate experimentele. Acidul citric și toate celelalte substanțe chimice au fost de calitate analitică și au fost obținute de la Sigma. Doza de LPS (200 μg/kg) și timpul de prelevare a țesuturilor s-au bazat pe studii anterioare. 20
Design de studiu
Șoarecii au fost împărțiți în mod aleatoriu în cinci grupuri egale (câte șase șoareci fiecare). Șoarecii au fost tratați fie cu 0,2 ml de: ser fiziologic steril (grupa 1) sau acid citric la doze de 1, 2 și 4 g/kg, pe cale orală (grupele 2-4). Tratamentele au fost administrate chiar înainte de administrarea endotoxinei (LPS: 200 lg/kg, injectat intraperitoneal, 0,1 ml). Al cincilea grup a primit doar vehiculul, fără LPS (control negativ). Șoarecii au fost eutanasiați după 4 ore de LPS sau injecția vehiculului prin decapitare sub anestezie cu eter, unde creierul și ficatul fiecărui șoarece au fost apoi îndepărtați, spălați cu soluție salină tamponată cu fosfat rece ca gheața (PBS; pH 7,4), cântărită și depozitată la −80 ° C până la analizele biochimice. Țesuturile au fost omogenizate cu 0,1 M PBS la pH 7,4, pentru a da o concentrație finală de 0,1 g/ml pentru testele biochimice. Activitatea redusă GSH, malondialdehidă (MDA), oxid nitric (nitrit), GPx și paraoxonază 1 (PON1) a fost determinată în țesuturile creierului și ficatului. TNF-a a fost măsurat în țesutul cerebral. Alanina aminotransferază (ALT), aspartat aminotransferază (AST) și fragmentarea ADN au fost măsurate în țesutul hepatic.
Determinarea peroxidării lipidelor, niveluri reduse de GSH și de nitriți
Peroxidarea lipidelor a fost testată prin măsurarea nivelului de MDA în țesutul cerebral folosind metoda Ruiz-Larrea și colab. 21 GSH redus a fost determinat în țesut prin metoda lui Ellman. 22 Oxidul de azot măsurat ca nitrit a fost determinat folosind reactivul Griess, conform metodei Moshage și colab. 23
Determinarea activității GPx
Activitatea GPx în supernatante a fost determinată spectrofotometric la 340 nm prin analiza oxidării NADPH utilizând trusa de glutation peroxidază (Biodiagnostic). 24 O unitate de activitate GPx este definită ca cantitatea de proteină care a oxidat 1 mM NADPH pe minut. Activitatea GPx este exprimată ca mU/ml.
Determinarea activității paraoxonazei
Activitatea arilesterazei paraoxonazei a fost măsurată spectrofotometric în supernatante folosind acetat de fenil ca substrat. 25,26 În acest test, arilesteraza/paraoxonaza catalizează scindarea acetatului de fenil, rezultând formarea fenolului. Rata de formare a fenolului a fost măsurată prin monitorizarea creșterii absorbanței la 270 nm la 25 ° C. Reactivul de lucru a constat din 20 mM tampon Tris/HCI (pH 8,0) conținând 1 mM clorură de calciu și 4 mM acetat de fenil ca substrat. Se adaugă probe diluate 1: 3 în tampon și modificarea absorbanței este înregistrată după un decalaj de 20 s. Absorbanta la 270 nm a fost luată la fiecare 15 s timp de 120 s folosind un spectrofotometru de înregistrare UV-Vis (Shimadzu Corporation). O unitate de activitate arilesterază este egală cu 1 μM de fenol format pe minut. Activitatea este exprimată în kU/L, pe baza coeficientului de stingere al fenolului de 1310 M/cm la 270 nm, pH 8,0 și 25 ° C. Probele goale care conțin apă sunt utilizate pentru a corecta hidroliza spontană a acetatului de fenil.
Determinarea TNF-α, a fragmentării ADN și a enzimelor hepatice
TNF-a de țesut a fost determinat în țesutul cerebral în conformitate cu Chen și colab. 27 prin test imunosorbent legat de enzime folosind kituri TNF-α (Biosource International) și cititor de plăci de microtitrare (Fisher Biotech). Cuantificarea fragmentării ADN-ului în țesutul hepatic a fost făcută în conformitate cu metoda descrisă de Gercel-Taylor. 28 de activități ALT și AST în ficat au fost măsurate folosind kituri disponibile comercial (BioMérieux). 29.30
Evaluarea histologică a leziunii hepatice
Ficatul de la fiecare șoarece a fost îndepărtat rapid și fixat în formalină tamponată proaspăt 10% neutră, procesat în mod curent și încorporat în parafină. Secțiuni de 5 μm grosime au fost tăiate și colorate de hematoxilină și eozină (H&E) pentru examen histopatologic. Toate secțiunile au fost investigate cu microscopul cu lumină.
Imunohistochimie pentru caspază-3 și oxid de azot inductibil sintază
Secțiunile hepatice încorporate în parafină au fost deparafinate și hidratate. Imunohistochimia a fost efectuată cu o caspază-3 monoclonală de șoarece și oxid de azot sintază inductibil (iNOS) pentru detectarea clivajului caspazei și a activității iNOS. Secțiunile de parafină au fost încălzite într-un cuptor cu microunde (25 min la 720 W) pentru recuperarea antigenului și incubate fie cu anticorpi anti-caspază, fie cu iNOS (diluție 1:50) peste noapte la 4 ° C. După spălare cu PBS, urmată de incubare cu anticorpi secundari capră biotinilată anti-iepure-imunoglobulină G (diluție 1: 200; Dako Corp.) și complex streptavidină/fosfatază alcalină (diluție 1: 200; Dako) timp de 30 de minute la temperatura camerei, situsurile de legare ale anticorpului au fost vizualizate cu DAB (Sigma). După spălare cu PBS, probele au fost contracolorate cu H&E timp de 2-3 minute și deshidratate prin transferarea lor prin creșterea soluțiilor de etanol (30%, 50%, 70%, 80%, 95% și 100% etanol). După deshidratare, feliile au fost înmuiate de două ori în xilen la temperatura camerei timp de 5 minute, montate, examinate și evaluate cu microscop cu lumină de mare putere. 31
analize statistice
În schimb, nu s-a observat niciun efect semnificativ asupra MDA hepatică după tratamentul cu acid citric (1-4 g/kg; Fig. 1B).
GSH redus
După provocarea LPS, nivelul GSH a scăzut în țesuturile creierului și ficatului cu 72,1% (1,21 ± 0,07 față de 4,1 ± 0,28 μmol/g țesut) și 46,9% (4,16 ± 0,29 vs. 7,83 ± 0,36 μmol/g țesut), respectiv . Tratamentul cu acid citric (1-4 g/kg) nu a avut niciun efect semnificativ asupra creierului sau ficatului GSH (Fig. 2A, B).
În ficat, nitriții au scăzut semnificativ cu 17% de acidul citric administrat la 1 g/kg comparativ cu grupul martor LPS. Cu toate acestea, dozele mai mari de acid citric nu au reușit să modifice în mod semnificativ nitriții din țesutul hepatic (Fig. 3B).
Activitatea GPx
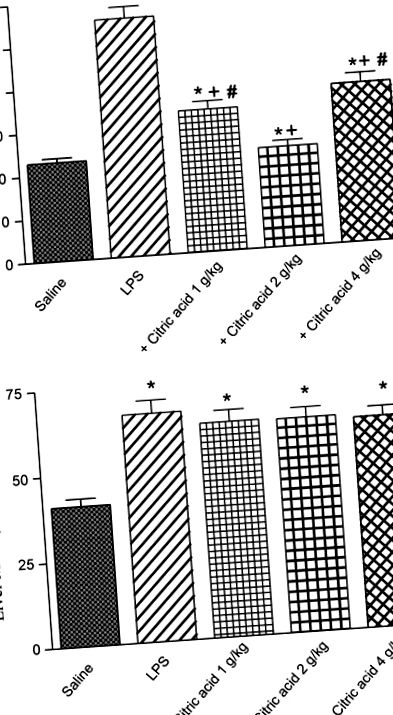
Activitatea glutation peroxidazei (GPx) în (A) creier și (B) ficatul șoarecilor după LPS sau LPS + acid citric (1-4 g/kg, p.o.). * P + P # P Fig. 5A, B). Activitatea PON1 a creierului a crescut cu 44,9% după tratamentul cu acid citric la 1 g/kg. Cu toate acestea, dozele mai mari nu au reușit să modifice în mod semnificativ activitatea PON1 (Fig. 5A). Pe de altă parte, activitatea PON1 hepatică a scăzut semnificativ cu 19,7% și 36,6% după tratamentul cu acid citric la 2 și respectiv 4 g/kg, comparativ cu grupul martor LPS (Fig. 5B).
Hematoxilină și eozină (H&E) - secțiuni hepatice colorate de la șoareci tratați cu (A) ser fiziologic (control). (B) LPS: infiltrare inflamatorie celulară leucocitară în jurul zonei portale (săgeată lungă), necroză (cap săgeată), sinusoide din sânge dilatate și congestionate și cromatină nucleară marinată (stea). (C) LPS: zona necrotică focală (capul săgeții), celulele Kupffer activate, sinusoidele din sânge dilatate și congestionate și nucleii pirotici (stea). (D) LPS + acid citric 1 g/kg: congestie a venei centrale (săgeată lungă), sinusoide din sânge dilatate și puține celule necrotice (vârf de săgeată). (E) LPS + acid citric 2 g/kg: venă centrală normală (săgeată lungă), sinusoide din sânge minim dilatate și puține celule Kupffer. (F) LPS + 4 g/kg de acid citric: congestie a venei centrale (săgeată lungă), semne de degenerescență hepatocitară, sinusoide din sânge congestionat dilatat și puține celule Kupffer (H & E × 400). Imagini color disponibile online la www.liebertpub.com/jmf
Examenul histologic al ficatului de la șoareci tratați cu LPS a relevat infiltrații de celule mononucleare, proliferarea căilor biliare în zonele periportale și mărirea minimă în zonele periportale. În grupul LPS am observat, de asemenea, dilatarea și congestia venei centrale și a sinusoidelor din sânge care au prezentat numeroase celule Kupffer. Hepatocitele au prezentat modificări necrotice sub formă de nuclei mici picnotici cu cromatină condensată sau marginată, lipsă de nucleoli și citoplasmă puternic acidofilă (Fig. 9B, C).
Pe de altă parte, examinarea histologică a secțiunilor hepatice de la șoareci tratați cu LPS + acid citric la 1 g/kg a arătat o arhitectură hepatică aproape normală. Lobulii hepatici au apărut cu venă centrală proeminentă cu o dilatare sinusoidală mai redusă și un număr scăzut de celule Kupffer comparativ cu grupul tratat numai cu LPS (Fig. 9D).
Ameliorarea aspectului histologic a fost mai pronunțată după tratamentul cu acid citric la 2 g/kg, evidențiată în apariția normală a lobulilor hepatici cu tulpini de hepatocite în comparație cu secțiunea grupurilor LPS (Fig. 9E).
În schimb, secțiunile de la șoareci tratați cu LPS și 4 g/kg de acid citric au prezentat o îmbunătățire ușoară cu zone portale dilatate. Hepatocitele au prezentat un anumit grad de regenerare histologică cu o dilatare sinusoidală mai redusă și cu un număr scăzut de celule Kupffer și mai puține celule necrotice (Fig. 9F).
Imunoreactivitatea Caspase-3 și iNOS
Marcarea caspazei-3 activată a fost specifică în delimitarea celulelor morfologic apoptotice. Expresia Caspase-3 și iNOS a fost localizată în citoplasma hepatocitelor. A existat imunopozitivitate neglijabilă caspază-3 (Fig. 10A-i) și iNOS (Fig. 10A-ii) la ficatul șoarecilor tratați cu vehicul. După tratamentul cu LPS s-a observat o expresie puternică a caspazei-3 (Fig. 10B-i) și iNOS (Fig. 10B-ii) comparativ cu grupul de control al vehiculului. În aceste secțiuni, imunoreactivitatea caspază-3 și iNOS a fost observată în principal în jurul venei centrale.
Efectul tratamentului cu LPS și acid citric asupra caspazei 3 hepatice (eu) și oxidul de azot inductibil sintază (iNOS) (ii) imunocolorare: (A) controlul ficatului; (B) LPS; (C) LPS + acid citric 1 g/kg; (D) LPS + acid citric 2 g/kg; (E) acid citric 4 g/kg (imunohistochimie caspază-3 și iNOS, hematoxilină contracolor × 400). Imagini color disponibile online la www.liebertpub.com/jmf
Imunopozitivitatea Caspase-3 și iNOS a scăzut în ficatul șoarecilor intoxicați cu LPS tratați cu 1 g/kg de acid citric (Fig. 10C) și respectiv 2 g/kg de acid citric (Fig. 10D), respectiv. În schimb, acidul citric în doza mare de 4 g/kg nu a fost eficient în reducerea expresiei caspazei-3 (Fig. 10E-i) și a expresiei iNOS (Fig. 10E-ii).
Discuţie
În fața creșterii radicalilor liberi și a speciilor reactive de oxigen, celulele sunt echipate cu o serie de mecanisme antioxidante, cum ar fi catalazele, GPx-urile, glutation transferaza, superoxidul dismutaza și GSH. 3 Administrarea LPS a fost asociată cu o creștere a peroxidării lipidelor și o scădere a nivelului GSH și a activității GPx în țesuturile cerebrale și hepatice, ceea ce indică generarea crescută de radicali liberi. La șoarecii tratați cu LPS, creierul și ficatul GSH nu au fost modificate de acidul citric. Între timp, tratamentul cu acid citric la 1 g/kg a fost asociat cu activități GPx crescute în țesuturile creierului și ficatului, posibil datorită efectului antioxidant al acidului citric. În studiul actual, s-a observat scăderea activității PON1 a creierului și ficatului după administrarea LPS. Enzima PON1 care joacă un rol important în metabolismul multor compuși xenobiotici a atras recent atenția asupra unui posibil rol în protejarea membranelor celulare împotriva peroxidării lipidelor. 25.26 În țesutul cerebral, activitatea PON1 a fost îmbunătățită prin acid citric administrat la 1 g/kg. Cu toate acestea, activitatea PON1 în țesutul hepatic a scăzut după doze mai mari de acid citric, reflectând posibil consumul sau inactivarea enzimei prin creșterea radicalilor liberi cu concentrație mare de acid citric.
O citokină proinflamatorie puternică este TNF-α, care este produsă în creier de către celulele gliale ca răspuns la diferiți stimuli și induce astrocitele și celulele microgliene să secrete mai mulți mediatori inflamatori, cum ar fi chemokine, mediatori lipidici, oxid nitric și alți radicali liberi. S-a demonstrat că TNF-α joacă un rol important în moartea celulară mediată de neuroinflamare a sistemului nervos central în diferite condiții neurodegenerative. 37.38 În prezentul studiu, citokina a fost semnificativ crescută în țesutul cerebral după administrarea LPS. Aici demonstrăm că tratamentul cu acid citric a fost asociat cu un efect inhibitor marcat asupra producției de TNF-α în țesutul cerebral după provocarea LPS. Această capacitate a acidului citric de a reduce producția patologică de TNF-α în creier ar putea avea o valoare relevantă pentru bolile neurodegenerative. Expresia TNF-α pare a fi reglată în sus în mai multe tulburări neurodegenerative, cum ar fi boala Alzheimer, boala Parkinson și scleroza laterală amiotrofică, iar manipularea farmacologică a TNF-α în creier a fost propusă ca o țintă potențială în tratamentul acestor afecțiuni și poate reprezenta o țintă valoroasă pentru intervenție. 39-41
Datele actuale indică faptul că acidul citric poate acționa direct asupra celulelor creierului pentru a inhiba producția lor de TNF-α și nitriți. LPS acționează asupra receptorilor TLR4 de pe macrofage, celule dendritice și alte celule imune pentru a elibera citokine proinflamatorii, cum ar fi TNF-α și IL-1β, care pot obține acces direct la creier prin bariera hematoencefalică sau semnal către creier prin nervul vag, așa-numita comunicare imună a intestinului - creierului. 42.43 Astfel, este de asemenea posibil ca efectele acidului citric asupra creierului să fie contabilizate prin modularea eliberării mediatorilor inflamatori din leucocite în periferie.
Trebuie menționat, totuși, că unele dintre efectele benefice observate pentru acidul citric în țesuturile cerebrale și hepatice au fost doar în intervalul de doze de 1-2 g/kg. Acest efect protector se pierde atunci când doza este crescută la 4 g/kg; de exemplu, activitățile GPX și PON1 au crescut doar cu 1 g/kg, iar TNF a scăzut doar cu 1-2 g/kg de acid citric; dozele care au fost cele mai eficiente în inhibarea nitritului creierului. Efectele protectoare asupra ficatului s-au pierdut, de asemenea, cu o doză mai mare de 4 g/kg, ceea ce a crescut și fragmentarea ADN-ului hepatic. Deoarece acidul citric se găsește în toate țesuturile animale ca intermediar în ciclul Krebs, nu a fost stabilită nicio limită a aportului zilnic acceptabil pentru oameni, nici pentru acid, nici pentru sare. 46 Este totuși posibil ca, la concentrații mai mari, acidul citric să acționeze ca un pro-oxidant. Mai mulți antioxidanți prezintă efecte pro-oxidante la doze/concentrații mai mari, de exemplu, carotenoizi, 47 vitamina E și vitamina C. 48.49 Compușii naturali prezintă, de asemenea, efecte dublu-tivite asupra reacțiilor inflamatorii, în funcție potențial de concentrațiile lor: doze fiziologice care duc la beneficii efecte în timp ce dozele mari pot duce la efecte dăunătoare. 50
Declarația de divulgare a autorului
Autorii declară că nu există conflicte de interese.
- Acid citric
- DETOX ȘI STRES OXIDATIV MAAX Life
- Efectele suplimentării dietetice a DL-metioninei asupra creșterii și a profilului de aminoacizi din întregul corp
- Efectele canagliflozinei asupra pierderii în greutate la șoarecii obezi cu conținut ridicat de grăsimi
- Utilizările acidului gamma aminobutiric și efectele secundare ale suplimentului GABA