1 Departamentul de Farmacognozie, Facultatea de Farmacie, Universitatea Mahidol, 447 Sri Ayudhya Road, Rajathevi District, Bangkok 10400, Thailand
2 Departamentul de produse farmaceutice și naturale, Institutul de cercetări științifice și tehnologice din Thailanda, Pathum Thani 12120, Thailanda
3 Divizia de Dermatologie, Departamentul de Medicină, Facultatea de Medicină, Spitalul Ramathibodi, Universitatea Mahidol, Rama VI Road, Bangkok 10400, Thailanda
4 Departamentul de Microbiologie, Facultatea de Medicină Spitalul Siriraj, Prannok Road, Bangkok Noi District, Bangkok 10700, Thailand
5 Departamentul de Patologie, Facultatea de Medicină Spitalul Ramathibodi, Universitatea Mahidol, Rama VI Road, Bangkok 10400, Thailanda
6 Departamentul de Chimie Medicinală, Colegiul Victorian de Farmacie, Universitatea Monash, Melbourne, VIC 3052, Australia
7 Departamentul de chimie farmaceutică și medicală, Institutul de științe farmaceutice, Universitatea din Freiburg, 79104 Freiburg, Germania
Abstract
1. Introducere
Gynura procumbens (Lour.) Merr. este menționat în medicina tradițională chineză ca remediu antiinflamator de actualitate [1]. În Asia de Sud-Est, Gynura plantele sunt larg distribuite. În Thailanda, G. pseudochina var. hispida (Denumirea thailandeză: Wan Mahakaan) este utilizat extern ca virus anti-mâncărime, antiinflamator și antiherpes [2]. În Singapore, Malaezia și Indonezia, planta a fost folosită în mod tradițional ca remedii pentru febra eruptivă, erupții cutanate, boli de rinichi, migrenă, constipație, hipertensiune, diabet zaharat și cancer [3]. Extractul de etanol din frunză a redus edemul urechii șoarecilor indus de uleiul de croton [4]. Studii fitochimice ale Gynura plantele au dus la descoperirea alcaloizilor pirrolizidinici [5-7], spirostanol [8], cumarine [7-9] și antocianine [10]. De cand G. procumbens până acum nu a fost explorată activitatea antiherpes virală, pe de altă parte, conform medicinei tradiționale thailandeze, utilizarea plantei poate fi asociată cu infecția virală herpesică; se efectuează investigarea componentelor plantei pentru activitatea antiherpetică.
2. Materiale și metode
Material vegetal. Gynura procumbens a fost colectată din provincia Chanthaburi, Thailanda, în octombrie 1994. Planta a fost identificată de dna. Leena Phupatpong, botanist expert la Forest Herbarium (BKF), Departamentul Royal Forest, Ministerul Agriculturii și Cooperativelor, Bangkok, Thailanda. Un exemplar de voucher (BKF nr. 127362) a fost depus în același loc.
Extracție și izolare. Părțile aeriene ale plantei (25 kg, proaspete) au fost spălate, tăiate în bucăți, uscate într-un cuptor cu aer cald (60 ° C) și măcinate, rezultând 1,7 kg de medicament sub formă de pulbere grosieră. A fost extras cu succes într-un aparat Soxhlet folosind eter de petrol (40-60 ° C), diclormetan și etanol. Solvenții au fost îndepărtați sub presiune redusă. Extractul de etanol uscat (114 g) a fost separat în continuare folosind coloane cromatografice cu diferite materiale de ambalare. Coloana MCI gel CHP20P a fracționat extractul în fracțiile F1 (apă), F2 (apă-metanol 1: 1), F3 (metanol) și F4 (acetat de etil). F2, F3 și F4 au fost active împotriva virusului herpes.
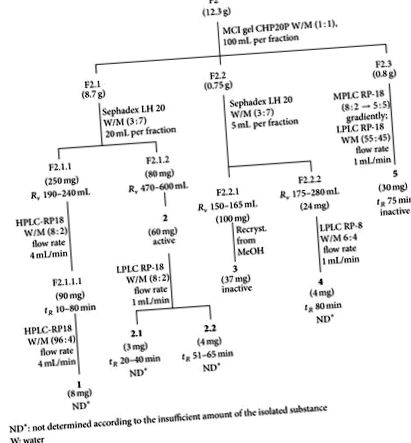
F2 (12,3 g) și F3 (6,4 g) au fost cromatografiate progresiv pe gel MCI CHP20P folosind metanol apos (1: 1) pentru F2 și metanol pentru F3 ca sisteme de solvent, rezultând F2.1 (8,7 g), F2.2 ( 0,75 g) și F2,3 (0,8 g) și F3,1 (2,0 g), F3,2 (3,0 g) și, respectiv, F3,3 (0,8 g). Compuși 1, 2, 3, 4, și 5 au fost izolate din F2 (Figura 1), în timp ce compușii 6, 7, 8, și 9 au fost izolate din F3 (Figura 2). F4 nu a fost studiat în continuare.
Linie celulara. Linia celulară Vero (celule renale de maimuță verde africană) a fost cultivată și menținută în mediul esențial minim (MEM) al Eagle suplimentat cu ser de vițel fetal 10% și antibiotice (
Virus. HSV-1, tulpina KOS și HSV-2, tulpina Baylor 186, au fost obținute de la Departamentul de Microbiologie, Facultatea de Medicină Spitalul Siriraj, Universitatea Mahidol, Bangkok, Thailanda. Cantitatea de 100 de unități de formare a plăcii (PFU) per ml a fost utilizată pentru experimente.
Evaluarea citotoxicității. Diluțiile seriale de 2 ori ale probei testate în mediul de întreținere au fost adăugate la monostratul Vero. După incubare la 37 ° C timp de 5 zile, citotoxicitatea a fost determinată prin colorare vitală cu 1% cristal violet în 10% formalină timp de 30 min. Cea mai mare concentrație a probei de testare care nu a prezentat citotoxicitate a reprezentat doza maximă netoxică (MNTD). Diluțiile seriale de 2 ori ale MNTD au fost utilizate pentru efectuarea testului antiviral.
Test antiviral. Activitatea antivirală a fost determinată prin testul de reducere a plăcii pe celule Vero confluente care cresc în plăci de cultură tisulară cu 96 de godeuri. Testul a inclus trei tratamente, adică inactivarea și pre- și posttratamente.
Inactivare (Pentru a determina activitatea neutralizantă a probei de testare împotriva infecțiozității virusului (acțiune virucidă)): virus (100 μL) a fost incubat cu proba de testare (100 μL) la 37 ° C timp de 1 oră. Amestecul a fost adăugat în godeuri duplicate de celule monostrat și incubat la 37 ° C timp de 1 oră. După spălarea celulelor, s-au adăugat medii MEM și semisolide (0,4% gumă tragacantă) la culturi, care au fost apoi incubate la 37 ° C timp de 3 zile și colorate cu cristal violet.
Pre-tratament (pentru a determina activitatea inhibitoare a adsorbției sau penetrării virale): eșantion de testare (100 μL) a fost adăugat la godeurile duplicate de celule monostrat și incubat la 37 ° C timp de 24 de ore. După spălarea culturii, celulele au fost infectate cu virus (100%) μL) și incubat la 37 ° C timp de 1 oră. Mediile semisolide au fost adăugate la godeurile duplicate ale celulelor monostrat după spălarea virusului non adsorbit. Culturile au fost incubate la 37 ° C timp de 3 zile și apoi colorate cu cristal violet.
Post-tratament (pentru a determina activitatea inhibitoare a replicării virale intracelulare): celulele monostrat au fost infectate cu virus și incubate la 37 ° C timp de 1 oră. După spălarea celulelor, proba de testare (100 μL) și mediile semisolide au fost adăugate în godeuri duplicate, incubate la 37 ° C timp de 3 zile și apoi colorate cu cristal violet.
Control. Controlul celulei: celulă monostrat în medii MEM și semisolide. Aciclovirul a fost utilizat ca martor pozitiv. Controlul virusului: celule monostrat infectate cu 100 PFU/ml de virus, MEM și medii semisolide.
Calculul capacității inhibitoare a plăcii: procentul reducerii plăcii comparativ cu cultura fără tratament (controlul virusului) a fost calculat. Concentrația de inhibare de 50% (IC50) a substanței active sau a probei a fost determinată ca fiind cea mai mică concentrație care a redus numărul de plăci cu 50% în culturile tratate comparativ cu culturile netratate.
Probele au fost dizolvate în dimetil sulfoxid (DMSO) și diluate cu mediul de întreținere. Concentrația finală de DMSO în proba de test a fost de 0,3%.
Cultura virală. Celulele Vero au fost cultivate în mediu de creștere, MEM (sare Earle’s, JR Scientific, Inc., Woodland, CA, SUA) suplimentată cu 10% ser fetal bovin (Gibco, Grand Island, SUA) și 100 unități/ml penicilină G și 100 μg/mL streptomicină (M&H Manufacturing Co., Ltd., Thailanda) și 0,01 M HEPES (acid N-2-hidroxietil-piperazin-N’-2-etan sulfonic) (Gibco, Grand Island, SUA). Mediile de întreținere au fost preparate ca medii de creștere, cu excepția concentrației serului bovin fetal a fost redusă la 2%.
Pregătirea extractului de plante, a plantelor și a gelurilor placebo. Planta a fost macerată cu etanol și evaporată ca un extract uscat, care a fost standardizat cu 7, ca un compus marker specific sau standard. Extractul standardizat de etanol a fost utilizat ca material medicamentos, care a fost preparat sub formă de geluri de plante 1 și 2%. Carbopol, substanța gelifiantă, a fost dispersată în apă fiartă rece și neutralizată cu soluție de hidroxid de sodiu. Extractul vegetal a fost dizolvat în propilen glicol, adăugat la gel și amestecat bine. Gelul placebo a fost preparat în mod similar, dar agentul colorant (caramel) a fost utilizat în locul extractului de plantă.
Pacienți și metodă. Acest studiu este un studiu placebo dublu-orb în tratamentul herpesului labial recurent cu G. procumbens gel comparativ cu placebo. A fost aprobat de Comitetul de compensare etică pentru drepturile omului legate de cercetările care implică subiecți umani. Studiul clinic a fost efectuat în conformitate cu ghidurile ICH-GCP și Declarația de la Helsinki. Pacienții au fost informați înainte de începerea studiului și au furnizat un consens scris cu privire la participare. A fost efectuat la trei spitale, adică la spitalele Ramathibodi, Chulalongkorn și Phra Mongkutklao.
Pacienții participanți au avut vârsta de peste 18 ani, diagnosticați ca herpes labial recurent, iar simptomul a apărut în 48 de ore. Criteriile de excludere au fost pacienții în timpul sarcinii sau alăptării și pacienții cu boli cronice și infecție cu HIV.
În prima zi (D0) a începerii procesului, au fost înregistrate istoricul și simptomele pacienților, iar leziunile infectate au fost fotografiate. Frotiul Tzanck și cultura virală au fost efectuate pentru a confirma diagnosticul. Examenul de laborator inițial a inclus examenul CBC, SGOT, SGPT, creatinină BUN și urină.
Pacienții au fost repartizați în trei grupuri prin randomizare în bloc. Au fost grupul A care a primit 1% gel din plante, grupul B care a primit 2% gel din plante și grupul C care a primit gelul placebo. Toți pacienții au primit tevi de gel identice.
Au fost sfătuiți să aplice gelul subțire pe zona infectată la fiecare două ore în prima zi și de patru ori pe zi în zilele următoare până la vindecarea leziunii. Severitatea durerii și a mâncărimii a fost înregistrată zilnic de pacient pe o scară analogică vizuală liniară de 0-10, de la nici una la foarte severă. Au fost, de asemenea, înregistrate date ale crustei complete și ale vindecării complete. Pacienții au fost evaluați de anchetatori în zilele 2 sau 4 și 7 și a doua zi după care leziunile au fost complet vindecate. Evaluarea fiecărei vizite de urmărire a inclus severitatea durerii și a mâncărimii, precum și zile de crustare completă și vindecare completă a leziunilor. Au fost, de asemenea, înregistrate reacțiile adverse sau orice plângeri ale pacienților. Pe D2 - D4 și D7, leziunile au fost fotografiate și s-au efectuat culturi virale. Sângele și urina au fost colectate și examinate din nou la ultima vizită.
Metode statistice. Am calculat că, dacă rata de succes a apărut la 80% dintre pacienții cu tratament medicamentos și la 50% pentru pacienții cu placebo, ar necesita 45 de pacienți tratați cu medicamente și 45 de pacienți cu placebo pentru a detecta rata de succes la un nivel de semnificație de 5% cu o putere de 80% . Am umflat dimensiunea eșantionului calculat la 50 de pacienți pentru a compensa 10% din rata de urmărire a pierderilor. Testul exact Fisher a fost utilizat pentru a compara rata de succes dintre grupurile tratate cu medicament și cele cu placebo. Statisticile descriptive au fost raportate ca fiind medii cu deviație standard. Analiza statistică a fost efectuată pe baza unui studiu finalizat.
3. Rezultate
Izolarea metanolului apos F2 și a fracțiunilor de metanol F3 a dus la patru componente antiherpetice, adică, 2 din F2 (Figura 1, Tabelul 1) și 7, 8, și 9 din F3 (Figura 2, Tabelul 1). Flavonoidele (un amestec de 3.1 și 3.2 și 5) care au fost izolate de F2 și 6 din F3 nu au avut activitate antivirală. Compuși 2, 7, 8, și 9 au fost identificate folosind metode spectroscopice, în special RMN cu tehnica gradientului de câmp [11-14].
2: Un amestec de acizi Dicaffeoylquinic (2.1 și 2.2)
2.1 (Figura 4): Acid 3,5-Di-O-cafeoilchinic. Pulbere galbenă amorfă; Rf 0,55, silicagel 60, CHCI3 (MeOH/H20) acid acetic/(21:15: 3: 1); UV (MeOH)
326 nm. 1 H-RMN (CD 3 OD, 300 MHz) δ 7,62, 7,58 (d, . = 16 Hz, H-7 ′, H-7 ′ ′, fiecare) 7,08, 7,06 (d, . = 8,2, H-2 ′, H-2 ′ ′, fiecare) 6,98, 6,96 (dd, . = 8,2 Hz, H-6 ′, H-6 ′ ′, fiecare) 6,78 (d, . = 8,0, H-5 ′, H-5 ′ ′, fiecare) 6,41, 6,30 (d, . = 16 Hz, H-8 ′, H-8 ′ ′) 5,55 (ddd, . = 10,2, 9,7, 6,0, H5ax) 5,38 (ddd, . = 3, 3, 3 Hz, H-3eq) 3,90 (dd, . = 7,3 Hz, H-4ax) 2,28 (dd, . = 15,1, 3,1 Hz, H-2).
2.2 (Figura 5): Acid 4,5-Di-O-cafeoilchinic. Pulbere galbenă amorfă, Rf 0,50, silicagel 60, CHCI3 (MeOH/H20) acid acetic/(21:15: 3: 1); UV (MeOH) 326 nm. 1 H-RMN (CD 3 OD, 300 MHz) δ 7,57, 7,49 (d, . = 16 Hz, H-7 ′, H-7 ′ ′, fiecare) 7,02, 6,98 (d, . = 2 Hz, H-2 ′, H-2 ′ ′, fiecare) 6,89, 6,86 (dd, . = 8,2 Hz, H-6 ′, H-6 ′ ′, fiecare) 6,73, 6,71 (d, . = 8 Hz, H-5 ′, H-5 ′ ′, fiecare) 6,26, 6,18 (d, . = 16 Hz, H-8 ′, H-8 ′ ′, fiecare) 5,69 (ddd, . = 10,3, 9,7, 7,0 Hz, H-5ax) 5,10 (dd, . = 10,0, 3,0 Hz, H-4ax) 4,31 (ddd, . = 3,0, 4,0, 3,0 Hz, H-3eq) 2,0–2,4 (m lat, H2-2, H2-6).
8: 1,2-bis-Dodecanoil-3-α-D-Glucopiranozil-sn-Glicerol (Monoglucozil diglicerid, Figura 13). Masă cerată incoloră, Rf 0,15, silicagel 60, CHCI3 (MeOH/H20) (20: 5: 0,5); 1 H-RMN (CD 3 OD), 300 MHz) δ 5,28 (dddd, . = 7,0, 6,4, 4,0, 4,1 Hz, H-2) 4,77 (d, . = 3,8 Hz, H-1 ′ ′ ′) 4,50 (m, H-1a) 4,14 (dd, . = 12,0, 7,0 Hz, H-1b) 4,00 (dd, . = 10,8, 6,4 Hz, H-3a; ddd, . = 9,8, 9,0, 3,4 Hz, H-5 ′ ′ ′) 3,60 (dd, . = 9,5, 9,0 Hz, H-3 ′ ′ ′) 3,56 (dd, . = 10,8, 6,4 Hz, H-3b) 3,41 (dd, . = 9,7, 3,8 Hz, H-2 ′ ′ ′) 3,28 (dd, . = 14,3, 9,7 Hz, H-6 ′ ′ ′ a) 3,19 (dd, . = 9,7, 9,0 Hz, H-4 ′ ′ ′) 3,00 (dd, . = 14,3, 3,4 Hz, H-6 ′ ′ ′ b) 2,30 (t, . = 7,6, 7,6 Hz, H-2 ′, 2 ′ ′) 1,57 (m, H-3 ′, 3 ′ ′) 1,25 (m, H-4′-13 ′, 4 ′ ′ - 13 ′ ′) 0,84 t, . = 6,4, 6,0 Hz, H-14 ′, 14 ′ ′); 13 C-RMN (CD 3 OD, 75 MHz): δ 192,31 (C-1 ′, 1 ′ ′) 99,08 (C-1 ′ ′ ′) 74,00 (C-3 ′ ′ ′, 4 ′ ′ ′) 73,00 (C-2 ′ ′ ′) 71,50 (C-2 ′ ′ ) 70,00 (C-5 ′ ′ ′) 66,00 (C-3a, 3b) 64,00 (C-1a, 1b) 61,00 (C-6 ′ ′ ′ a, 6 ′ ′ ′ b) 34,69 (C-2 ′, 2 ′ ′) 29.52–30.06 (C-4′-11 ′, 4 ′ ′ - 11 ′ ′) 25,27 (C-3 ′, 3 ′ ′) 23,02 (C-13 ′, 13 ′ ′).
Activitățile antiherpetice ale 1 și 4 nu au fost determinate din cauza cantității minime. Compușii 3, 5, și 6au fost inactive. Structurile chimice ale 1, 3, 4, 5, și 6 au fost identificate după cum urmează.
1: Acid 5-O-cafeoil-D-Quinic (Acid clorogenic, Figura 3). Pulbere amorfă incoloră; UV (MeOH) 326 nm, umăr la 299 nm; ESI MS (modul Ion poz.) m/z 355 [M + H] & lt; + & gt; (calculat pentru C16H18O9 354); 1 H-RMN (DMSO-d6, 300 MHz) δ 7.40 (d, . = 16,0 Hz, H-7 ′), 7,00 (d, . = 2,0 Hz, H-2 ′), 6,94 (dd, . = 8,0, 2,0 Hz, H-6 ′), 6,73 (d, . = 8,0 Hz, H-5 ′), 6,14 (d, . = 16,0 Hz, H-8 ′), 5,10 (ddd, . = 8,0, 7,0, 6,0 Hz, H-5ax), 3,90 (lat, H-3eq), 3,48 (dd, . = 7,0, 4,0 Hz, H-4ax), 1,97 (m, H-2a), 1,86 (m, H-6), 1,71 (m, H-2b); 13 C-RMN (DMSO-d6,75 MHz): δ 175,00 (C-7 ′), 165,90 (C-9 ′), 148,20 (C-3 ′), 145,47 (C-4 ′), 144,67 (C-7 ′), 125,56 (C-1 ′), 121,18 - 6 ′), 115,68 (C-5 ′), 114,70 (C-8 ′), 114,45 (C-2 ′), 73,20 (C-1), 71,50 (C-3), 71,19 (C-5), 69,52 (C-4), 36,92 (C-2).
- 10 Formularea dietei, efectele prelucrării, factorii care afectează consumul și creșterea alimentară
- O revizuire a valorii nutritive a leguminoaselor și a efectelor acestora asupra obezității și a acestora
- Efecte secundare antibiotice la copii - rapoarte ale consumatorilor
- Medicamentele antiherpetice pot reduce riscul de demență - Consilier pentru boli infecțioase
- Efectele anti-obezitate ale extractului de apă fierbinte și ale extractului de usturoi cu presiune hidrostatică ridicată la șobolani