Abstract
Microbiota este indispensabilă pentru sănătatea umană și pentru reglarea diferitelor funcții ale corpului, inclusiv metabolismul energetic. Diafragma armonică dintre microbiotă și bariera epitelială intestinală determină homeostazia intestinală și starea de sănătate la subiectul sănătos. Riscul de obezitate și diabet de tip 2 se explică, într-o oarecare măsură, prin modificări ale microbiotei. Deoarece datele recente indică faptul că populația de microorganisme intestinale poate influența absorbția nutrienților și stocarea energiei, astfel prevalența obezității și a tulburărilor metabolice. Mai mult, afecțiunile metabolice, cum ar fi obezitatea, pot fi stimulate de factori genetici, de mediu și de căi care leagă metabolismul de sistemul imunitar. Pe baza considerațiilor de mai sus, această revizuire compilează rezultatele actuale obținute în studii recente care indică contribuția microbiotei intestinale la dezvoltarea obezității.
Introducere
Prevalența obezității și a diabetului în societățile dezvoltate rămâne una dintre principalele probleme de sănătate publică la nivel mondial, iar incidența sa este în creștere. Obezitatea rezultă din acumularea de exces de țesut adipos; cu toate acestea, etiologia sa este complexă, iar simptomele sunt eterogene din cauza comorbidității ridicate cu boli metabolice, inclusiv diabetul de tip 2, care este o patologie concomitentă. S-a sugerat că dieta este importantă în echilibrul energetic și joacă, de asemenea, un rol fundamental în menținerea diversității și funcționării corecte a microbiotei noastre intestinale. Astfel, intervenția dietetică adecvată, cum ar fi dieta bogată în fibre, poate îmbunătăți starea de sănătate prin reglarea microbiotei la om [1]. În acest context, manipularea microbiotei de către prebiotice devine un posibil modificator al profilului microbian și poate îmbunătăți sănătatea gazdei, prin declanșarea de răspunsuri sistemice benefice și reducerea adipozității [2].
Compoziția microbiotei în intestinul uman
Comunitatea microorganismului locuită în corpul uman este cunoscută sub numele de microbiotă. Concentrația numărului de celule microbiene în lumen este de zece ori mai mare decât celulele eucariote gazdă, reprezentând 1-2 kg de greutate corporală [3]. Microbiota intestinală a fost clasificată în aproximativ 1000 de specii diferite [4]. Trei dominante distinctive filum a fost identificat în intestinul uman: Firmicutes, Bacteroidetes și Actinobacteria [5], care reprezintă aproximativ 90% din totalul bacteriilor din intestin, în principal în partea sa terminală, colonul. Activitatea biochimică diversă a acestor bacterii are contribuții metabolice vitale pentru corpul uman, în care organismul nu ar putea funcționa independent [6].
De asemenea, microbiota participă la homeostazia indivizilor, oferind o serie de funcții cheie, cum ar fi degradarea polizaharidelor dietetice nedigestibile, reglarea stocării energiei obținute, sinteza vitaminelor, modularea sistemului imunitar și are, de asemenea, un efect protector al bariera intestinală [13]. Prin urmare, orice factor sau eveniment care afectează una dintre aceste funcții are repercusiuni asupra altora și are un impact negativ asupra întregului organism. Luat împreună, acest articol își propune să compileze literatura științifică despre relevanța microbiotei pentru obezitate și posibilele mecanisme implicate în prevenirea sau tratarea pandemiei obezității.
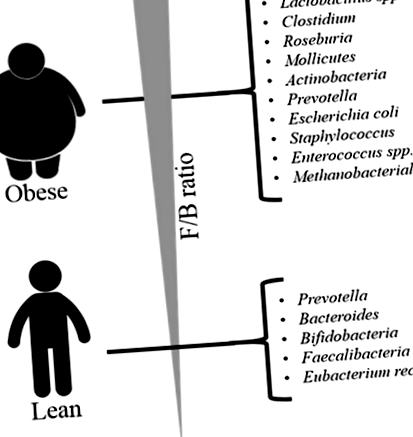
Modificarea profilului microbiotei intestinale la obezitate
Rezumatul creșterii compoziției microbiotei intestinale la subiecții obezi și slabi
Dovezile sugerează că intervenția dietetică ar putea ameliora obezitatea prin modificarea profilului microbiotei. Se pare că ceaiul verde și produsele sale procesate, cum ar fi negru, împreună cu ceaiul oolong, promovează metabolismul lipidic benefic și efectele obezității [25]. În conformitate cu aceste constatări, Seo și colab. au arătat efecte expozitive anti-obezitate ale extractelor de ceai verde fermentate (FGT; 500 mg/kg; dizolvate în 0,1% metilceluloză) la șoareci, în care șoarecii obezi hrăniți cu dietă bogată în grăsimi (HFD) au primit o administrare orală zilnică de ceai verde uscat frunze, fermentate de Bacillus subtilis, în timp ce grupurilor martor li s-a administrat 0,1% metilceluloză ca vehicul. Rezultatele au indicat administrarea de 8 săptămâni de FGT a scăzut dramatic Firmicutes/Bacteroidetes raport în timp ce scade nivelul glucozei plasmatice și al lipidelor. Mai mult, intervenția dietetică a redus expresia genelor lipogene și proinflamatorii, prevenind astfel hiperlipidemia [26, 27]. Luată împreună, se sugerează că modificarea microbiotei intestinale prin intervenție dietetică ar putea fi un adjuvant terapeutic promițător al obezității.
Corelarea microbiotei, obezității și a prebioticelor
Studiile efectuate pe modele animale de obezitate genetică sau indusă de dietă au arătat că prebioticele pot îmbunătăți funcția barierei intestinale, toleranța la glucoză și modularea metabolismului lipidic, reducând în același timp creșterea în greutate, masa grasă și starea inflamatorie. De asemenea, poate regla producția de hormoni intestinali prin efectul trofic care promovează mucoasa [21, 28,29,30]. Tabelul 2 prezintă rezumatul șoarecilor și studiilor prebiotice cheie umană.
Mai mult, studiile la șoareci au arătat relația dintre echilibrul energetic, dieta și compoziția microbiotei intestinale. S-a sugerat că microbiota intestinală este afectată de achiziția de nutrienți, stocarea energiei și o serie de căi metabolice [5]. Microbiota are efecte biologice dramatice asupra organismului uman; în ceea ce privește achiziția de nutrienți, microbiota metabolizează reziduurile alimentare nedigerabile, cum ar fi polizaharidele dietetice (de exemplu, oligozaharide, amidon rezistent și fructoză). În consecință, diferențele de activitate metabolică a microbiotei intestinale pot duce la variații ale caloriilor ingerate din substanțele dietetice, stocarea caloriilor în țesutul adipos și disponibilitatea energiei pentru proliferarea microbiană. Astfel de diferențe de microbiotă intestinală sunt, de asemenea, legate de variația absorbției de energie la om, explicând aspecte ale obezității care pot fi responsabile de predispoziția unui individ la tulburări metabolice [24].
Majoritatea modificărilor compoziției microbiotei sunt reversibile, sugerând că microbiota unui individ este o caracteristică înnăscută [20]. Cu toate acestea, aceste modificări la subiecții obezi (induse genetic sau dietetice) pot fi inversate prin transferul oral al microbiotei intestinale a șoarecilor slabi [9, 10] sau prin intervenția dietetică a administrării prebiotice [31]. Inflamația, diabetul, obezitatea și rezistența la insulină la șoareci pot fi îmbunătățite prin transplant de fecale [21].
Numai la animale, modularea compozițiilor de microbiote poate îmbunătăți greutatea corporală. Animalele obeze la șoareci fără germeni (GFM) și animalele slabe transplantul de microbiota are ca rezultat obezitate, în timp ce contrariul se observă prin transferul microbiotei de la animale slabe la animale obeze [11, 32, 33]. De exemplu, Turnbaugh și colab. a demonstrat că transplantul fecal de ob/ob în GFM a condus la creșterea greutății corporale pe o perioadă de 2 săptămâni [10]. La fel, Goodman și colab. a efectuat un studiu folosind șoareci care au fost transplantați cu microbiota umană de la indivizi slabi și hrăniți cu o dietă bogată în grăsimi-bogate în zahăr, rezultând o creștere a Firmicutes și o reducere a grupului Bacteroidetes atribuită fermentației bacteriene [34]. În conformitate cu aceste constatări, Bäckhed et al. a arătat că GFM C57BL/6 în urma colonizării de către șoareci convenționali microbiota distală, crește IMC cu 60% împreună cu rezistența la insulină după 14 zile, reducând în același timp consumul de alimente, a dezvăluit că microbiota intestinală promovează absorbția monozaharidelor, rezultând inducerea lipogenezei hepatice de novo.
Prebioticele sunt ingrediente fermentate selectiv pentru a promova modificări benefice în compoziția și/sau activitatea microbiotei gastrointestinale și, prin urmare, sunt capabile să confere beneficii pentru sănătate indivizilor [28, 35, 36]. Ele sunt de obicei elemente dietetice „nedigestibile”, dar sunt fermentate de microbiota intestinală, servind ca sursă de energie [37, 38]. Efectele prebioticelor asupra homeostaziei energetice și reglării sațietății sunt legate de o scădere a tulburărilor metabolice și a incidenței obezității [39, 40] (Fig. 2). Deși corelațiile exacte ale microbiotei intestinale și ale obezității nu sunt pe deplin cunoscute, manipulările microbiotei intestinale bazate pe dietă, în special prin prebiotice și fibre dietetice, pot fi o abordare potențială pentru inversarea sau prevenirea obezității.
Corelația suplimentării prebiotice cu microbiota intestinală și efectele sale asupra obezității și a sindromului metabolic
Producția de acizi grași cu lanț scurt prin microbiotă
Recent, fibrele alimentare au câștigat interes datorită exercitării unor funcții metabolice benefice, inclusiv producția de microbiote intestinale SCFA. SCFA afectează creșterea și diferențierea enterocitelor și colonocitelor. Energia extrasă din fibrele dietetice prin microbiota, devine disponibilă organismului și evită pierderea acestora în scaune. Fermentarea fibrelor dietetice de către microbiotă eliberează SCFA, cum ar fi acetat, propionat și butirat, ale căror concentrații totale pot ajunge la 130 mM în colon [41, 42]. În timp ce butiratul este metabolizat în principal de colonocite; acetatul și propionatul sunt absorbiți, atingând concentrații de 300 până la 450 μM în sângele portal și 50 și 100 μM în sângele periferic [16, 20, 43]. Acetatul este tipul dominant de SCFA la om și aceste SCFA par să joace un rol interesant în modularea activității protein kinazei (PKA) activată de proteina kinază activată 5'-AMP (AMPK) împreună cu infiltrarea macrofagelor în țesutul adipos [12].
În schimb, sinteza de novo a lipidelor sau glucozei este declanșată de propionat, acționând ca o sursă de energie pentru gazdă. Mai mult, butiratul și propionatul inițiază gluconeogeneza intestinală printr-o axă intestin-creier, promovând avantaje metabolice asupra reglării glucozei și a greutății corporale [43]. SCFA-urile pot funcționa ca semnale derivate din microbi care influențează metabolismul carbohidraților și fiziologia intestinală prin stimularea secreției de hormoni precum grelina și eliberarea peptidei mai mari tirozină tirozină (PYY) și a peptidei de tip glucagon-1 (GLP-1), în timp ce servesc ca sursă de energie a celulelor epiteliale intestinale (Fig. 3). Acetatul, în special, reprezintă un substrat preferat pentru gluconeogeneză și sinteza colesterolului și a trigliceridelor [28, 41, 44].
Interacțiunea dintre receptorii SCFA, GPR43 și GPR41. (1) Bacteriile din intestin interacționează cu carbohidrații alimentari complecși produși de SCFA prin hidroliză și fermentare; (2) Legarea dintre SCFA și receptorul GPR43 în enterocite promovează eliberarea GLP-1, crescând sensibilitatea la insulină; (3) Activarea GPR43 prin interacțiunile SCFA în adipocit suprimă eliberarea insulinei, inhibând depozitele de grăsime din țesutul adipos; (4) Legarea receptorului SCFAs-GPR41 crește eliberarea de PYY, reducând dezvoltarea obezității
În plus, din rolul lor în recuperarea energiei, SCFA sunt compuși ligandici pentru receptorul 2 al acidului gras liber cuplat cu proteina G (FFAR2/GPR43) și 3 (FFAR3/GPR41). Acetatul activează selectiv GPR43 in vitro; propionatul exercită o activare similară asupra GPR43 și GPR41; cu toate acestea, butiratul are o activitate de afinitate asupra GPR41 [45]. Acești receptori sunt implicați în reglarea apetitului și a metabolismului energetic care afectează rezistența la insulină și adipozitatea la indivizi. Potrivit lui Gao și colab. suplimentarea cu butirat la șoareci DIO a crescut SCFA-urile intestinale și circulante rezultând suprimarea creșterii în greutate, activarea AMPK și creșterea funcției mitocondriale. Aceste rezultate au indicat faptul că hrănirea unui HFD împreună cu suplimentarea cu butirat la șoarecii obezi induși de dietă, inversează și previne rezistența la insulină [46].
Alternativ, stimularea GPR43 promovează stocarea energiei prin creșterea adipogenezei, inhibarea lipolizei în adipocite și scăderea cheltuielilor de energie [44]. Propionat, modulează homeostazia energetică prin promovarea activării neuronilor simpatici mediați de GPR41, spre deosebire de corpurile cetonice [44]. În plus, comparativ cu tipurile sălbatice, animalele eliminabile pentru GPR41 sau GPR43 au mai puține trigliceride hepatice și colesterol plasmatic, o sensibilitate mai mare la insulină și o creștere în greutate mai mică atunci când sunt hrănite cu HFD [47]. Astfel, epiteliul intestinal sau ficatul utilizează foarte mult SCFA ca sursă de energie pentru a conferi beneficii metabolice gazdei, cum ar fi suprimarea consumului de alimente și stimularea secreției de hormon intestinal protejând în același timp împotriva intoleranței la glucoză și a creșterii în greutate induse de grăsimi.
Efecte prebiotice asupra sindromului metabolic și obezității
Mai mult, s-a sugerat că prebioticele ar putea exercita efecte anti-obezitate prin reducerea adipogenezei. Dewulf și colab. a observat că suplimentarea dietetică de 4 săptămâni a șoarecilor obezi cu fructan de tip inulină (0,2 g/zi/șoarece) a redus expresia mRNA GPR43 în țesutul adipos subcutanat, a scăzut dezvoltarea masei de grăsime indusă de HFD în timp ce a crescut lipoliza, îmbunătățind răspunsul la insulină tisulară Ulterior, activarea modulată a receptorului activat cu proliferatorul peroxizomului (PPAR-γ) și reducerea expresiei proteinei de legare a intensificatorului CCAAT (C/EBPα), lipoprotein lipazei (LPL) și proteinei de legare a acizilor grași (FABP/ap2). Aceste proteine sunt implicate în procesele de acumulare a lipidelor și diferențierea adipocitelor în adipogeneză și, prin urmare, au prezentat o corelație pozitivă cu reducerea dimensiunii adipocitelor și a masei grase. Prin urmare, administrarea fructanului de tip inulină la șoareci hrăniți cu HFD a dus la o creștere importantă a nivelurilor de Bifidobacterii și a contracarat toate modificările induse de HFD, inclusiv restabilirea activității PPAR-γ și a expresiei GPR43. Cu toate acestea, modulația specifică a microbiotei intestinale în care inulina contracarează PPAR-γ indusă de HFD rămâne evazivă [51].
Alte rezultate pozitive ale ingestiei prebiotice la obezitate la om au fost raportate de Genta și colab. în care femeile cu supraponderalitate și dislipidemie ușoară au fost supuse unui program de scădere în greutate timp de 120 de zile (dietă hipocalorică + activitate fizică); cei care au inclus sirop de yacon, bogat în fructo-oligozaharide (FOS) în dieta lor (suficient pentru a furniza 0,14 g de FOS/kg de greutate corporală/zi) au avut o reducere mai mare a greutății corporale, a IMC și a circumferinței taliei. În ceea ce privește variabilele biochimice, acest grup de femei a prezentat o reducere a valorilor HOMA-IR, insulinei de post și colesterolului lipoproteic cu densitate mică. Autorii subliniază că aceste rezultate nu pot fi atribuite exclusiv suplimentării cu FOS, cu toate acestea, efectul benefic a fost recomandat [60]. În ciuda prebioticelor, par a fi instrumente promițătoare în strategia nutrițională pentru reducerea riscului de obezitate sau ca adjuvant în tratamentul acestei afecțiuni clinice prin capacitatea lor de a promova secreția hormonilor gastrointestinali endogeni implicați în reglarea apetitului. Sunt necesare studii suplimentare la om pentru a confirma efectele fibrelor dietetice în reducerea adipozității, precum și a comorbidităților asociate obezității.
- Efectele experienței nutriționale în viața timpurie și adultă asupra performanței și obiceiurilor alimentare ale
- Exercițiu în dispunerea caloriilor dietetice - Reglarea lipoproteinelor și a colesterolului seric
- Efectele suplimentării cu calciu asupra greutății corporale și adipozității la adulții supraponderali și obezi A
- Ghid de ceai de păpădie Beneficii pentru sănătate, efecte secundare și profil de aromă; Barul de ceai Sencha
- Date vs Stafide - Beneficii pentru sănătate, Date nutriționale, Efecte secundare