Asieh Mansour
1 Departamentul de Nutriție Clinică și Dietetică, Facultatea de Nutriție și Tehnologia Alimentelor, Nutriția Națională și Tehnologia Alimentelor, Institutul de Cercetare Universitatea de Științe Medicale Shahid Beheshti, Teheran, Iran
2 Centrul de cercetare endocrinologie și metabolism, Institutul de științe clinice endocrinologie și metabolism, Universitatea de Științe Medicale din Teheran, Teheran, Iran
Mohammad Reza Mohajeri-Tehrani
2 Centrul de cercetare endocrinologie și metabolism, Institutul de științe clinice endocrinologie și metabolism, Universitatea de Științe Medicale din Teheran, Teheran, Iran
Sara Karimi
1 Departamentul de Nutriție Clinică și Dietetică, Facultatea de Nutriție și Tehnologia Alimentelor, Nutriția Națională și Tehnologia Alimentelor, Institutul de Cercetare Universitatea de Științe Medicale Shahid Beheshti, Teheran, Iran
Milad Sanginabadi
3 Departamentul de radiologie, Spitalul Shariati, Universitatea de Științe Medicale din Teheran, Teheran, Iran
Hossein Poustchi
4 Centrul de cercetare a bolilor hepatice și pancreatobiliare, Institutul de cercetare a bolilor digestive, Universitatea de Științe Medicale din Teheran, Teheran, Iran
Samaneh Enayati
5 Centrul de Cercetare a Tulburărilor Metabolice, Endocrinologie și Metabolism Institutul de Științe Celulare Moleculare, Universitatea de Științe Medicale din Teheran, Teheran, Iran
Saeedeh Asgarbeik
5 Centrul de Cercetare a Tulburărilor Metabolice, Endocrinologie și Metabolism Institutul de Științe Celulare Moleculare, Universitatea de Științe Medicale din Teheran, Teheran, Iran
Javad Nasrollahzadeh
1 Departamentul de Nutriție Clinică și Dietetică, Facultatea de Nutriție și Tehnologia Alimentelor, Nutriția Națională și Tehnologia Alimentelor, Institutul de Cercetare Universitatea de Științe Medicale Shahid Beheshti, Teheran, Iran
Azita Hekmatdoost
1 Departamentul de Nutriție Clinică și Dietetică, Facultatea de Nutriție și Tehnologia Alimentelor, Nutriția Națională și Tehnologia Alimentelor, Institutul de Cercetare Universitatea de Științe Medicale Shahid Beheshti, Teheran, Iran
Date asociate
Abstract
Introducere
Cafeaua este cea mai populară băutură din întreaga lume. Astfel, impactul său asupra corpului uman ar putea fi important la scară populațională. Cafeaua este produsă din semințele plantelor de cafea, genul Coffee, care conține peste 1000 de compuși bioactivi (Gomez-Juaristi și colab., 2018 [11]; Jeszka-Skowron și colab., 2015 [16]). Cei mai importanți compuși bioactivi ai cafelei sunt acizii clorogeni și cofeina; cu toate acestea, compozițiile biochimice ale cafelei finale sunt diverse, pe baza tipului de semințe și a metodelor de preparare.
Asocierea dintre consumul de cafea și mortalitatea cauzată de toate cauzele și cauzele specifice a fost investigată în mai multe studii observaționale. Majoritatea acestor studii au raportat o asociere inversă între mortalitatea cauzată de toate cauzele și cauzele specifice și consumul de cafea atât cu cofeină, cât și decofeinizat (Grosso și colab., 2016 [12]). Mai mult, asocierea negativă a consumului de cafea cu tulburările metabolice, gastrointestinale și hepatice a fost raportată anterior (Awaad și colab., 2011 [3]; Gutierrez-Grobe și colab., 2012 [13]; Hodge și colab., 2017 [ 14]; Kennedy și colab., 2016 [19]; Molloy și colab., 2012 [24]; Santos și Lima, 2016 [31]; Vitaglione și colab., 2012 [34]). O recenzie umbrelă recentă și meta-analiza privind asocierea dintre consumul de cafea și sănătate a concluzionat că asocierile benefice dintre consumul de cafea și rezultatele hepatice au dimensiuni ale efectului relativ mari și consistente comparativ cu alte rezultate (Poole și colab., 2017 [28]).
Există mai multe limitări în studiile anterioare care evaluează relația dintre consumul de cafea și tulburările cronice. În primul rând, majoritatea acestor studii au fost investigații observaționale. Astfel, nu au putut face afirmații cauzale. În al doilea rând, există mai multe variabile confuze în determinarea expunerii, inclusiv compoziția cafelei, metodele de preparare și neregularitatea obiceiurilor de consum de cafea.
Toate aceste limitări sugerează necesitatea efectuării de studii clinice controlate cu cantități cunoscute de componente de cafea pentru a găsi orice posibilă relație cauză-efect, abordând în același timp mecanismul de acțiune. Pe de altă parte, un studiu recent pe 16 subiecți sănătoși a raportat că 3 cani/zi consumul de cafea timp de 3 săptămâni a crescut numărul de Bifidobacterium spp. populație în eșantioane fecale de participanți (Jaquet și colab., 2009 [15]). Astfel, am presupus că asociațiile benefice ale consumului de cafea cu tulburări metabolice s-ar putea datora efectelor sale asupra microbiotei intestinale; cu toate acestea, componenta acționară probabilă a acesteia nu este cunoscută. Prin urmare, am proiectat acest studiu pilot pentru a evalua efectele a două componente principale ale cafelei, cafeina și acidul clorogenic, asupra microbiotei intestinale la pacienții cu boală hepatică grasă nealcoolică (NAFLD) și diabetul de tip 2.
Material si metode
Recrutarea și verificarea eligibilității
Pacienții cu vârste cuprinse între 30 și 65 de ani cu antecedente de diabet au fost identificați și recrutați dintr-o clinică de endocrinologie de la spitalul Shariati, Teheran, Iran. Diagnosticul NAFLD s-a făcut prin prezența steatozei la examenul cu ultrasunete (SUA), asociată cu steatoza de gradul 2 sau mai mult la examenul Fibroscan. Criteriile de excludere au fost consumul oricărui tip de antibiotice cu 2 săptămâni înainte și în timpul studiului, fiind sportiv profesionist, luând orice alte medicamente decât diabetele pe cale orală, hepatita virală, consumul de alcool, ciroza hepatică, alte cauze ale bolilor hepatice cronice, hipotiroidismul, tulburări intestinale și cardiovasculare, indicele de masă corporală (IMC)> 35 kg/m2, urmând o dietă specială, orice modificare a medicamentelor hipoglicemiante, tulburări psihiatrice care afectează capacitatea pacientului de a furniza consimțământul scris în scris, precum și sarcina, alăptarea.
Design de studiu
Au fost recrutați toți pacienții eligibili cu diabet de tip 2. După explicarea protocolului de studiu, pacienții au semnat un formular de consimțământ informat, care a fost aprobat de comitetul de etică al Institutului Național de Dezvoltare a Cercetării Medicale (NIMAD). Pacienții au fost supuși unui examen SUA. Dacă au existat dovezi ale steatozei hepatice de gradul 2 sau mai mult la examenul din SUA, acestea au fost efectuate prin testul Fibroscan. Acei pacienți care au avut steatoză de gradul 2 sau mai mult la examenul Fibroscan (scor controlat al parametrului de atenuare (CAP)> 263) au fost înscriși în acest studiu.
Participanții înscriși au fost repartizați aleatoriu în patru grupuri pentru a primi fie 200 mg cofeină plus 200 mg acid clorogenic (CFCA), fie 200 mg cofeină plus 200 mg placebo (amidon) (CFPL), fie 200 mg acid clorogenic plus 200 mg placebo), sau 200 mg placebo plus 200 mg placebo (PLPL) timp de 12 săptămâni. Listele de randomizare au fost generate de computer de către o statistică și au fost date intervievatorului. Subiecții, anchetatorii și personalul au fost orbi la atribuirea tratamentului până la sfârșitul studiului. La momentul randomizării, datele de bază au fost colectate, iar participanților li s-a oferit o ofertă de suplimente de 4 săptămâni. Participanții au fost urmăriți la fiecare 4 săptămâni pentru a-și evalua conformitatea. Aderența a fost evaluată cu numărul de capsule confirmat la fiecare vizită. Toate suplimentele au fost furnizate de Arjuna Natural Extract, India.
Evaluarea consumului clinic, paraclinic și dietetic
Măsurătorile antropometrice au fost făcute pentru toți participanții la începutul studiului și la a 12-a săptămână de intervenție. Indicele de masă corporală (IMC) a fost calculat prin împărțirea greutății pacientului în kilograme la înălțimea acestuia în metri pătrate. Circumstanța taliei a fost măsurată în conformitate cu recomandarea OMS (OMS, 2012 [36]).
La începutul și la sfârșitul studiului, au fost colectate probe de sânge și de scaun în repaus și au fost depozitate la congelator la -80 ° C până la analiză. Toate măsurătorile biochimice au fost efectuate la același laborator, de către același tehnician, folosind metode standard. Concentrația de glucoză în post a fost evaluată utilizând metoda GOD/POD. Concentrația de insulină în post a fost evaluată printr-un test imunosorbent legat de enzime (Mercodia AB, Suedia). Evaluarea modelului de homeostazie - rezistența la insulină (HOMA-IR) a fost utilizată pentru a determina gradul de rezistență la insulină utilizând următoarea formulă (Matthews și colab., 1985 [21]): HOMA-IR = [insulină la jeun (mU/L) × glicemie în jeun (mg/dL)]/405. γ-glutamiltransferaza (GGT) a fost măsurată utilizând test colorimetric enzimatic (Parsazmoun, Teheran, Iran). Concentrațiile de alanină aminotransferază (ALT) și aspartat aminotransferază (AST) au fost măsurate folosind testul fotometric (Reckon, Vadodara, India). Concentrația ridicată de proteină C reactivă sensibilă (hs-CRP) a fost măsurată utilizând un test imunosorbent legat de enzime (Diagnostics Biochem Canada Inc.).
Pentru a evalua aportul nutritiv, la începutul și la sfârșitul studiului au fost colectate înregistrări alimentare de trei zile, inclusiv o zi de weekend. Aporturile dietetice au fost apoi analizate folosind Nutriționistul 4 (First DataBank, San Bruno, CA), încorporând utilizarea cântarelor și modelelor alimentare pentru a spori acuratețea mărimii porțiunii. Activitatea fizică a fost, de asemenea, evaluată folosind chestionarul Metabolic Equivalent of Task (MET) (Ainsworth și colab., 2000 [2]) la începutul și la sfârșitul acestui studiu.
Cheltuielile de energie de repaus (REE) au fost măsurate la începutul și la sfârșitul studiului folosind analizorul metabolic FitMate ™ (Cosmed, Roma, Italia). Detaliile procedurii au fost descrise anterior (Shaneshin și colab., 2011 [32]). Compoziția corpului a fost evaluată cu ajutorul analizatorului de impedanță corporală (BIA) (Tanita, Illinois, SUA) la începutul și la sfârșitul studiului.
Analiza microbiană intestinală
Probele de fecale au fost colectate în recipiente sterile la începutul și la sfârșitul studiului. Probele au fost aduse la laborator congelate și au fost depozitate la -80 ° C până la analizare.
Extracția ADN din 1 gram de scaune a fost făcută utilizând QIAamp DNA Stool Mini Kit (Qiagen) conform instrucțiunilor producătorului.
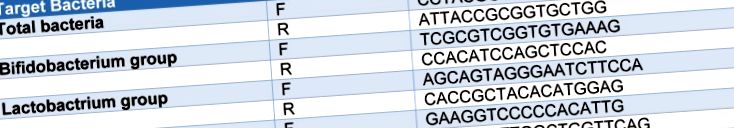
Analiza reacției în lanț a polimerazei cu transcriptază inversă (RT-qPCR) a fost efectuată utilizând un sistem Light Cycler 480 (Roche, Germania). Primerii specifici grupului și speciilor pentru PCR sunt enumerați în Tabelul 1 (Tab. 1) (Yoon și colab., 2014 [37]). Primerii au fost sintetizați comercial de Takapouzist (Teheran, Iran). PCR cantitativă a fost efectuată în plăci cu 96 de godeuri în volume finale de 20 μl constând din 1 μl de ADN fecal, 0,5 μl de primeri (10 pmol fiecare), 10 μl de SYBR Green I master (Roche, Germania) și 8 μl de H2O. Amplificare PCR implicată: pre-incubație la 94 ° C timp de 4 minute urmată de 55 de cicluri de amplificare (denaturare la 94 ° C timp de 15 sec, recoacere primer la 55 ° C timp de 15 sec și alungire la 72 ° C timp de 20 sec) . Curbele de topire au fost obținute prin încălzirea probelor de la 50 ° C la 90 ° C la o rată de 5 ° C/s.
analize statistice
Analiza a fost efectuată folosind SPSS 20.0 (pentru Windows SPSS Inc., Chicago, IL). Datele pentru variabilele distribuite în mod normal și categoriile sunt raportate ca medie ± deviație standard și respectiv procentul de frecvență. O analiză a varianței (ANOVA) a fost utilizată pentru a evalua diferențele între grupuri la momentul inițial. Comparațiile modificărilor (punctul final minus linia de bază) după intervenția între grupuri au fost făcute folosind ANOVA, în timp ce se utilizează testul Post Hoc Tukey pentru a compara modificările grupurilor. Pentru a controla variabilele de confuzie, s-a aplicat testul analizei covarianței (ANCOVA). Analiza ANCOVA a fost ajustată pentru valoarea inițială a fiecărei variabile, aportul alimentar de energie, cafea, ceai și fibre. Semnificația statistică a fost stabilită la p (Fig. 1). Niciunul dintre participanți nu a fost exclus din studiu în timpul a 12 săptămâni de urmărire. Toți participanții au consumat mai mult de 98% din suplimentele lor în funcție de numărul de capsule la fiecare vizită de urmărire. Caracteristicile inițiale ale pacienților din cele patru grupuri sunt prezentate în Tabelul 2 (Tab. 2). După cum se arată, toate brațele de testare au fost bine potrivite în ceea ce privește caracteristicile de bază. Tabelul 3 (Tab. 3) prezintă efectele fiecărei suplimentări asupra măsurătorilor antropometrice și biochimice după 12 săptămâni. Greutatea a redus semnificativ mai mult în grupul CFCA comparativ cu toate celelalte trei grupuri (p = 0,005 pentru PLPL; p = 0,023 pentru CAPL; și p = 0,031 pentru CFPL). Mai mult, IMC a scăzut în CFCA semnificativ mai mult decât grupurile PLPL și CAPL (p = 0,009, respectiv p = 0,033). Mai mult, aportul de energie a scăzut în grupul CFPL semnificativ mai mult decât grupul PLPL (p = 0,032). Nu au existat alte diferențe semnificative în modificările măsurătorilor biochimice și antropometrice între cele patru grupuri. În plus, aporturile dietetice de fibre, ceai, cafea, macronutrienți și micronutrienți nu au fost semnificativ diferite între și în cadrul grupurilor.
CF, acid clorogenic; CA, cofeina; PL, placebo
Numărul log10 de bacterii Bifidobacteria, Lactobacillus și Bacteriodes per gram de fecale înainte și după intervenție în fiecare grup este demonstrat în Figura 2 (Fig. 2). Deși numărul de Bifidobacterii intestinale a crescut în grupul CFCA, nu au existat diferențe semnificative statistic în interiorul și între grupuri în niciunul dintre numerele bacteriene. Nu au fost raportate efecte adverse în timpul studiului la niciun participant.
CF, acid clorogenic; CA, cofeina; PL, placebo
Pentru mai multe rezultate, consultați datele suplimentare.
Discuţie
Acest studiu pilot randomizat, controlat cu placebo, a demonstrat că suplimentarea cu acizi clorogeni 200 mg/zi plus 200 mg/zi timp de 12 săptămâni a fost eficientă în reducerea greutății la pacienții cu diabet zaharat și NAFLD, probabil datorită creșterii numărului de Bifidobacterii intestinale.
Suplimentarea cu cafeină și acid clorogenic (CFCA) a avut unele efecte benefice asupra tulburărilor metabolice ale participanților; cu toate acestea, efectul a fost semnificativ statistic numai în cazul pierderii în greutate. Studiile experimentale anterioare au raportat, de asemenea, efectele consumului de cafea asupra pierderii în greutate (Salomone și colab., 2017 [30]), dar studiile la om sunt limitate la voluntari sănătoși fără evaluarea pierderii în greutate (Wedick și colab., 2011 [35]) și cu rezultate controversate în evaluarea altor tulburări metabolice (Agudelo-Ochoa și colab., 2016 [1]; Kempf și colab., 2010 [18]; Lecoultre și colab., 2014 [20]; Moisey și colab., 2008 [22]; Papakonstantinou și colab., 2016 [26]). În studiul nostru, reducerea semnificativă a greutății s-ar putea datora creșterii bifidobacteriilor intestinale (Karbaschian și colab., 2018 [17]; Mokhtari și colab., 2019 [23]; Rashvand și colab., 2018 [29]). Dacă dozele suplimentelor noastre nu au fost suficiente pentru a induce un efect semnificativ asupra tulburărilor metabolice sau dacă alte componente ale cafelei ar putea fi eficiente pentru a obține rezultate benefice, a rămas să fie clarificat în studiile viitoare.
Cel mai important avantaj al acestui studiu este că este primul studiu clinic randomizat, controlat cu placebo, la pacienți cu NAFLD și diabet care evaluează efectele a două componente principale ale cafelei asupra microbiotei intestinale. Deoarece a fost un studiu pilot, a avut unele limitări, cum ar fi dimensiunea redusă a eșantionului, durata scurtă a studiului și limitarea dozelor de suplimente și numărul de bacterii măsurate; cu toate acestea, ar putea arunca o lumină asupra viitorului parcurs al studiilor clinice pentru a evalua efectele cafelei și ale componentelor sale la pacienții cu NAFLD și/sau diabet.
Concluzie
În concluzie, studiul nostru a arătat că consumul de 12 săptămâni de 200 mg/zi cofeină plus 200 mg/zi acid clorogenic este eficient în reducerea greutății la pacienții cu NAFLD și diabet fără efecte secundare. Aceste efecte pot fi cel puțin parțiale prin creșterea bifidobacteriilor intestinale. Acest studiu pilot a oferit un indiciu pentru viitoarele studii clinice la acești pacienți.
Abrevieri
NAFLD, boală hepatică grasă nealcoolică; WC, circumferința taliei; IMC, indicele de masă corporală; MET, echivalent metabolic al sarcinilor; ALT, alanină aminotransferază; AST, aspartat aminotransferază; GGT, γ-glutamil transferază; FBS, zahăr din sânge în post; LDL-C, lipoproteină cu densitate mică; HDL-C, lipoproteine de înaltă densitate; hs-CRP, proteină C reactivă cu sensibilitate ridicată; REE, cheltuieli energetice de repaus; CF, cafeina; CA, acid clorogenic; PL, placebo.
Mulțumiri
Studiul a fost susținut de Institutul Național pentru Dezvoltarea Cercetării Medicale (NIMAD) către AH cu un număr de grant de 963356.
Contribuțiile autorilor
AM, MRM și AH au dezvoltat propunerea, au obținut aprobări etice, au solicitat finanțare, au supravegheat colectarea datelor și au pregătit primul proiect. AM și AH au conceput ideea, au oferit expertiză în proiectarea și analiza studiului. SK, MS, HP, SE și SSA au fost implicate în experimente și analize de studiu.
Aprobarea eticii și consimțământul de participare
Autorizarea etică a fost luată de la Institutul Național pentru Dezvoltarea Cercetării Medicale (NIMAD) cu numărul IR-NIMAD-REC.1396.191. Consimțământul informat a fost luat de la toți participanții.
Interese concurente
Autorii declară că nu au interese concurente.
- Efecte secundare Polysorb Frecvente, severe, pe termen lung
- Efecte fără text complet ale nutrienților suplimentului sinbiotic asupra microbiotei intestinului uman, compoziție corporală
- Înot legat - recenzie pe termen scurt Forum Triathlon Forum Slowtwitch Forums
- Rituximab Efecte secundare Frecvente, severe, pe termen lung
- Ar trebui să beți cafea înainte de a alerga