Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Biochimie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de boli vasculare și metabolice, Hoffmann-La Roche, Elveția
Facultatea de Medicină, INSERM, Nisa, Franța
Departamentul de Medicină, Divizia de Biochimie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Biochimie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Fiziologie, Facultatea de Medicină, Universitatea din Geneva, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Biochimie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de boli vasculare și metabolice, Hoffmann-La Roche, Elveția
Facultatea de Medicină, INSERM, Nisa, Franța
Departamentul de Medicină, Divizia de Biochimie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Biochimie, Universitatea din Fribourg, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Departamentul de Fiziologie, Facultatea de Medicină, Universitatea din Geneva, Elveția
Departamentul de Medicină, Divizia de Fiziologie, Universitatea din Fribourg, Elveția
Abstract
Raportăm aici studii care integrează datele privind frecvența respiratorie de la mușchiul scheletic al șoarecilor ca răspuns la leptină și interferența farmacologică cu metabolismul intermediar, împreună cu teste pentru fosfatidilinozitol 3-kinaza (PI3K) și proteina kinază activată AMP (AMPK). Rezultatele noastre sugerează că efectul direct al leptinei în stimularea termogenezei în mușchii scheletici este mediat de ciclul substratului între lipogeneza de novo și oxidarea lipidelor și că acest ciclu necesită atât semnalizarea PI3K, cât și AMPK. Acest ciclu de substrat care leagă metabolismul glucozei și lipidelor de termogeneză oferă un mecanism termogen nou prin care leptina protejează mușchii scheletici de depozitarea excesivă a grăsimilor și de lipotoxicitate.
1. Introducere
2. Materiale și metode
2.1 Șoareci și preparate de țesut muscular
Mușchii intacti au fost obținuți de la șoareci BALB/cByJIco masculi în vârstă de 7 până la 8 săptămâni (Charles River Laboratories, L'Arbresle, Franța). Pentru măsurători calorimetrice ex vivo, mușchii solei și/sau extensorii digitorului lung (EDL) au fost disecați cu atenție intact împreună cu tendoanele lor și eliberați de țesutul conjunctiv slab atașat. Au fost apoi așezați pe un cadru din oțel inoxidabil, la o lungime de repaus fiziologic, în camerele de testare a unui microcalorimetru dublu indirect perifuzat cu tampon Krebs - Ringer bicarbonat la 30 ° C, așa cum a fost descris anterior [7] .
2.2 Măsurarea ratei de respirație a țesuturilor
Rata respiratorie (MO2) al mușchiului scheletic a fost măsurat printr-o metodă care implică determinări repetate ale absorbției de O2, așa cum este descris de Barde și colab. [10]. Presiunea parțială O2 a unei faze lichide fără bule închisă într-o cameră de Lucite cu pereți groși a fost măsurată de un electrod Clark O2 conectat la un circuit polarografic, a cărui tensiune de ieșire este direct proporțională cu presiunea parțială O2. La intervale de aproximativ 10 minute, o pompă peristaltică schimbă parțial soluția cu una proaspătă în decurs de 2-3 minute. Toate valorile pentru MO2 au fost luate în timpul respirației la starea de echilibru. Pentru fiecare hormon sau medicament, acest lucru a corespuns la 90-120 de minute după administrare. Starea de echilibru bazală MO2 a fost luat 120-150 min după plasarea preparatelor musculare în camerele experimentale.
2.3 Fosforilarea AMPK Thr172, testele PI3K și anticorpii receptorilor de leptină
2.4 Analiza lipogenezei musculare de novo
Rezervele de patru mușchi ai piciorului stâng și patru mușchi ai piciorului drept de la aceleași animale au fost incubate separat în tampon conținând 5 mM glucoză suplimentată cu d - [14 C] -glucoză pentru control și, respectiv, reacții de tratament cu insulină. După incubare timp de 2 ore la 30 ° C, lipidele musculare au fost extrase și separate prin cromatografie în strat subțire pe silicagel dezvoltat cu hexan: etil eter: acid acetic 80: 20: 1. Metaboliții lipidici marcați 14 C au fost detectați prin imagistica cu fosfor și comparați cu standardele lipidice, și anume: palmitat marcat cu 14 C și amestec de mono-, di- și tri-oleoilglicerol neetichetat care au fost detectați colorimetric.
2.5 Produse chimice și medicamente
Toate substanțele chimice au fost achiziționate de la Fluka (Buchs, Elveția). Leptina murină recombinantă a fost achiziționată de la Insight Biotechnology Ltd. (Middlesex, Marea Britanie), Wortmannin și Hydroxy - citrate din Calbiochem (Luzern, Elveția), Cerulenin din Fluka (Buchs, Elveția), 5 - aminoimidazol - 4 - carboxamidă ribonucleozidă (AICAR) din Toronto Research Chemicals (TRC, Toronto, Canada) și Adenina 9 - β‐ d - arabinofuranozidă (araA) de la Sigma (St. Louis, MO, SUA). Etomoxirul a fost un dar generos de la Prof. W. Langhans (Zurich, Elveția).
3. Rezultate
3.1 Cerința pentru semnalizarea PI3K
3.2 Cerința pentru axa AMPK-ACC-CPT-1 și semnalizarea PI3K
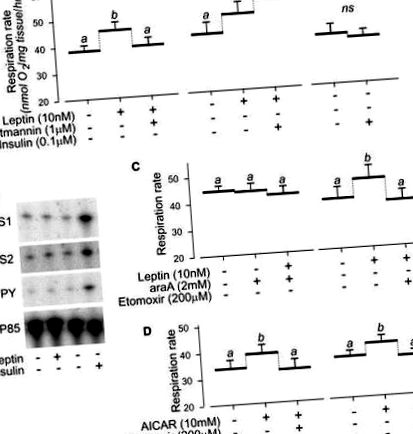
Deoarece în timpul postului, oxidarea substratului în mușchii glicolitici se schimbă de la glucoză la acizi grași însoțită de o activitate CPT-1 crescută, s-a pus întrebarea dacă EDL ar putea avea potențialul de a răspunde la leptină în mușchii de la șoareci la post. Într-adevăr, la mușchii EDL de la șoareci cu post de 16 ore, leptina a fost eficientă în creșterea ambilor MFosforilarea O2 și AMPK, iar acestea cresc în MDe asemenea, s-a constatat că O2 este inhibat de inhibitorul PI3K, wortmannin și de inhibitorul CPT-1, etomoxir (Fig. 2B). Luate împreună, aceste studii din mușchii solei și EDL subliniază cerința pentru activitatea bazală PI3K și activarea AMPK în efectul termogenic direct al leptinei în mușchiul scheletic.
3.3 Cerință pentru glucoză și lipogeneză de novo
Arătăm aici că incubația preparatelor noastre musculare în tampon conținând glucoză marcată cu 14 C a dus la producerea de lipide marcate cu 14 C corespunzătoare acizilor grași liberi, diacilglicerol și triacilglicerol atunci când a fost analizată prin cromatografie în strat subțire (Fig. 3B) și că insulina a crescut sinteza lipidelor din glucoză în mușchiul soleului și, într-o măsură mai mică, în mușchii EDL (datele nu sunt prezentate). Acest experiment demonstrează că lipogeneza de novo poate apărea în mușchii scheletici și că poate fi indusă de insulină, ca și în ficat și țesutul adipos [17]. Pentru a ști dacă este necesară o nouă lipogeneză pentru termogeneza indusă de leptină în mușchiul scheletic, am testat dacă creșterea indusă de leptină în MO2 din mușchiul soleului este inhibat prin adăugarea de inhibitori ai punctelor cheie de control în conversia glucozei în lipide. Arătăm aici că OH - citrat, care inhibă enzima citrat liasă sau cerulenina, un inhibitor al acidului gras sintază, poate estompa inducția leptinei de MO2 în mușchiul solei (Fig. 3C). Luate împreună, aceste date indică faptul că atât metabolismul glucozei, cât și lipogeneza de novo sunt necesare pentru efectul termogen direct al leptinei în mușchiul scheletic.
4. Discutie
Semnalizarea AMPK și PI3K ar putea orchestra acest ciclu „inutil” între sinteza de novo a acizilor grași și oxidarea acizilor grași. Pe de o parte, activarea AMPK, prin fosforilarea ACC, va contrabalansa acțiunea stimulatoare a citratului asupra ACC pentru a duce la reducerea concentrației de malonil-CoA, dezinhibarea CPT-1 și oxidarea crescută a acizilor grași, care la rândul său va duce la producerea de acetil - CoA și, prin urmare, supraîncărcarea ciclului Krebs. Pe de altă parte, activitatea PI3K (bazală sau stimulată de insulină) va crește intrarea glucozei și va permite citratului în exces să pătrundă pe căile care conduc la sinteza acizilor grași. Acest lucru ar avea loc în ciuda reducerii induse de AMPK a malonil-CoA, deoarece se știe că fosforilarea completă a ACC de către AMPK are ca rezultat o inhibare a activităților ACC doar cu 50-60% [19, 20]. Se așteaptă ca o astfel de inhibare parțială a ACC să redirecționeze fluxul de acetil - CoA și malonil - CoA către oxidarea acizilor grași, dar ar permite totuși o rată substanțială de sinteză a acizilor grași, în special în prezența nivelurilor ridicate de citrat.
Acest substrat care circulă între lipogeneza de novo și oxidarea lipidelor constituie, prin urmare, un efector termogen în mușchiul scheletic. Teoretic, sinteza unei molecule de acid palmitic din acetil-CoA și reoxidarea acestuia în acetil-CoA ar costa cel puțin 14 molecule de ATP. Dovezile care susțin existența ciclului acestui substrat ca efect efect termogen în mușchi se bazează pe datele noastre privind etichetarea metabolică în mușchiul schelet intact, care arată apariția lipogenezei de novo (Fig. 3B), și pe datele noastre calorimetrice care arată că efectele termogene directe ale leptinei în mușchiul scheletic sunt inhibate de interferența cu punctele cheie de control în acest flux de substraturi (Fig. 4), și anume: (i) cu metabolismul glucozei folosind 2 - dezoxiglucoză, (ii) cu conversia citratului în acetil - CoA utilizând OH - citrat, un inhibitor al citratului liază, (iii) cu conversia malonil-CoA în acizi grași utilizând cerulenină, un inhibitor al acidului gras sintază și (iv) cu intrarea acidului gras în calea de oxidare β-mitocondrială folosind etomoxir, un inhibitor al CPT-1.
Mai mult, dovezile că rata acestui ciclu de substrat ar putea fi orchestrată de semnalizarea PI3K și AMPK se bazează pe datele noastre de aici, care arată că: (a) termogeneza mediată de leptină necesită CPT - 1, care este efectorul final al leptinei - AMPK - ACC - Axa CPT - 1, (b) efectul termogen al leptinei este inhibat de inhibarea farmacologică a activării AMPK, (c) există o corelație puternică între activarea AMPK și termogeneza în mușchii solei și/sau EDL ca răspuns la leptină, (d) efectele termogene ale leptinei sunt inhibate de inhibitorul PI3K, wortmannina și (e) insulina, un stimulator al activității PI3K, potențează efectele termogene ale leptinei asupra mușchilor scheletici și induce lipogeneza de novo, așa cum se arată în experimentele noastre de etichetare metabolică. De fapt, o dublă cerință pentru semnalizarea AMPK și PI3K este puternic susținută de constatările noastre că administrarea de insulină singură nu stimulează termogeneza musculară (Fig. 1A) și că activarea AMPK de către AICAR duce la o creștere a termogenezei care este abolit de inhibitorul PI3K wortmannin (Fig. 1D).
Acest ciclu de substrat de disipare a energiei care leagă metabolismul glucozei și lipidelor de termogeneză oferă un mecanism molecular nou prin care leptina protejează mușchiul scheletic de depozitarea ectopică a grăsimilor și de lipotoxicitate. Deși creșterea ratei metabolice musculare indusă de leptină (aproximativ 20%) poate să nu fie considerată, a priori, a fi mare, trebuie subliniat faptul că rezistența periferică la acest efect termogenic al leptinei poate duce, în timp, la acumularea de lipidele intramiocelulare sau porțiunile lipidice, care chiar și în cantități modeste, pot duce la rezistență la insulină și lipotoxicitate [3]. Abordările care sporesc acest ciclu de substrat de disipare a energiei în mușchii scheletici pot avea astfel o valoare terapeutică pentru obezitate și diabetul de tip 2.
Mulțumiri
Mulțumim Dorothée Rohrer pentru suport tehnic excelent și prof. Wolfgang Langhans (Zurich) pentru darul său generos de etomoxir. Această lucrare a fost susținută de subvențiile nr. 3157129.991 și 3200B0‐102156 al Fundației Naționale Elvețiene pentru Științe.
- Secretomul celulelor musculare scheletice O revizuire sistematică - ScienceDirect
- Proteine suplimentare în sprijinul masei musculare și sănătății Advantage Whey - Devries - 2015 - Jurnal
- Suplimentul Spotlight Fii mărunțit cu mușchii arzătorilor de grăsime; Fitness
- Fundamentele auto-programării care sparg mușchiul
- Anatomia și funcția musculaturii Gluteus Medius