Abstract
fundal
Omentina, eliberarea de către țesutul adipos poate fi legată de metabolismul glucozei. Nivelurile circulante ale omentinei și expresia ARNm aferentă în țesutul adipos visceral sunt diferite în tipuri de diabet și funcția exactă a acestei molecule este încă necunoscută. Scopul acestui studiu a fost de a examina omentin expresie genică în țesuturile adipoase ale șoarecilor diabetici de tip 1 și tip 2 pentru investigarea efectelor metabolismului masei grase și insulinei - glucozei.
Metode
În acest studiu, 36 șoareci C57BL/6 au fost împărțiți în patru grupuri experimentale, inclusiv control, diabet de tip 1 (indus de streptozotocină), diabet de tip 2 cu obezitate [dietă bogată în grăsimi + doză mică de streptozotocină [HFD + STZ ]), și tip-2 cu greutate normală (dietă cu peleți normali + doză mică de streptozotocină [NPD + STZ]). Prezentul studiu a implicat măsurători ale testului oral de toleranță la glucoză și nivelurile parametrilor biochimici, inclusiv glucoza din sânge, omentina, insulina, profilul lipidic, precum și aminotransferazele. In plus omentin Expresia ARNm a fost evaluată prin reacție în lanț în timp real a polimerazei.
Rezultate
Rezultatele omentin analiza expresiei genelor a arătat o diferență semnificativă între expresiile ARNm în grupurile experimentale. Nivelurile de omentină plasmatică au fost semnificativ mai mari în grupul cu diabet zaharat de tip 1 și mai mici în diabetul de tip 2 cu NPD + STZ; cu toate acestea, nivelurile plasmatice ale omentinei nu au fost modificate în grupul HFD + STZ. În plus, constatările analizei biochimice serice au relevat diferențe semnificative, în comparație cu grupul de control.
Concluzii
omentin expresia poate fi afectată de nivelurile de insulină și glucoză în diferite tipuri de diabet mai mult decât de grăsime și, datorită activității locale, omentina serică poate să nu respecte expresia genică.
fundal
Rata de prevalență a diabetului paralel cu supraponderalitatea și obezitatea crește în întreaga lume la o rată alarmantă [1, 2]. Creșterea morbidității și mortalității după diabet a transformat-o într-una dintre cele mai importante probleme de sănătate și economice [2, 3]. Principala cauză a diabetului de tip 1 (T1D) este distrugerea autoimună a celulelor beta din insula pancreatică [4, 5]. Aproximativ, există 95% dintre pacienții cu diabet zaharat cu diabet de tip 2 (T2D), care se ilustrează în principal prin hiperglicemie datorată defectelor secreției de insulină, acțiunii insulinei sau ambelor [4, 6].
Obezitatea, în special obezitatea abdominală sau viscerală, este unul dintre factorii de risc majori pentru tulburările metabolice, cum ar fi rezistența la insulină, T2D, dislipidemia și bolile cardiovasculare [7]. De fapt, relația dintre obezitate și T2D se referă la activitatea și funcția țesuturilor adipoase [8]. Studii multiple au demonstrat că țesutul adipos secretă multe substanțe biologic active, precum adipokine cunoscute, cum ar fi leptina [9], adiponectina [10] și omentina [11].
Prin urmare, datorită rolului potențial probabil al omentinei ca sensibilizant la insulină, expresia predominantă a omentin în țesutul adipos și prezența acestuia în circulație, s-a decis să se determine nivelurile serice de omentină și expresia genei aferente în modele animale ca subiecți normali, T1D, T2D cu greutate normală, precum și obezitate și să se analizeze relația dintre omentin niveluri de expresie genică cu glucoză plasmatică, insulină, omentină și alți parametri biochimici.
Materiale și metode
Animalele studiază
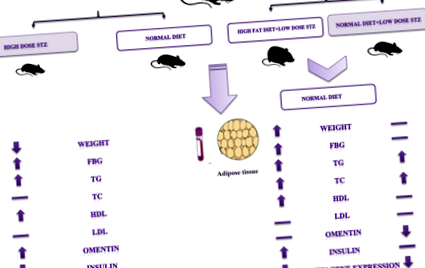
Acest studiu a fost realizat pe un total de 36 șoareci masculi C57BL/6 (Institutul Pasteur, Iran) cu vârsta de 8 săptămâni și aproximativ 20-25 g. Toate procedurile au fost aprobate de Comitetul de Etică al Universității de Științe Medicale din Khorasanul de Nord (cod etic: IR.nkums. REC.1396.24). Animalele au fost ținute într-o cușcă curată în condiții controlate (25 ± 2 ° C) și umiditate (50%) cu un ciclu de lumină/întuneric de 12/12 h. Toți șoarecii au fost hrăniți cu o dietă normală cu pelete (NPD) și apă gratuită cu 1 săptămână înainte de inițierea experimentului și au fost lăsați să se aclimatizeze la mediul de laborator. Toți șoarecii au fost împărțiți în patru grupuri, cu doisprezece animale în grupul martor și opt animale pentru fiecare grup experimental, după cum este prezentat mai jos: control pentru șoareci T2D, grupați (2) șoarecii cu T1D induși de doze mari de streptozotocină (STZ), grupați (3) șoarecii cu T2D induși prin dietă bogată în grăsimi + STZ (HFD + STZ) și grupați (4) șoarecii cu T2D induși de NPD + STZ (NPD + STZ).
Inducerea diabetului de tip 1
Diabetul de tip 1 a fost indus la șoareci anesteziați și la jeun peste noapte din grupa 2 printr-o singură injecție intraperitoneală de STZ (65 mg/kg) într-o soluție 2% (greutate/volum) de tampon citrat 0,1 M (pH 4,5), în timp ce grupul a primit exclusiv tampon citrat [20]. După 1 oră, animalele au fost hrănite cu alimente standard și apă. După 72 de ore de injecție, nivelurile de glucoză din sânge au fost estimate și monitorizate în fiecare săptămână în timpul experimentului până la 9 săptămâni folosind glucometrul Accu-Chek. Șoarecii tratați cu STZ cu niveluri de glucoză din sânge mai mari de 11,1 mmol/L au fost considerați diabetici și utilizați pentru prezentul studiu.
Inducerea diabetului de tip 2
Șoarecii au fost împărțiți în două grupuri dietetice, și anume HFD + STZ și NPD + STZ. După 7 săptămâni de manipulare a dietei, intraperitoneal cu o doză mică de STZ (45 mg/kg) a fost injectat la șoareci din fiecare grup dietetic [21]. Aportul alimentar, greutatea corporală și glicemia în repaus au fost măsurate în fiecare săptămână până la 12 săptămâni. Criteriul de includere a fost șoarecii cu un nivel de glicemie în jeun mai mare de 8,3 mmol/L la 4 săptămâni după injectare.
Test de toleranță la glucoză
La patru săptămâni după injecția STZ, s-a efectuat un test oral de toleranță la glucoză după 14 ore de repaus alimentar în grupurile 3 și 4. Concentrațiile plasmatice de glucoză au fost măsurate în probe de sânge prelevate din coadă folosind glucometrul Accu-Chek la 0, 15, 30, 60 și 120 min după administrarea de glucoză (3 g/kg) [22].
Măsurători biochimice
La sfârșitul experimentului, a fost colectat un specimen de sânge în repaus alimentar din fiecare grup pentru a determina glucoza, insulina, omentina și parametrii biochimici, inclusiv profilul lipidic, aspartatul aminotransferază (AST) și alanina aminotransferaza (ALT). Probele de plasmă au fost menținute la - 80 ° C până la test. Glucoza din sânge, colesterolul total, trigliceridele și colesterolul lipoproteic cu densitate ridicată (HDL-C) au fost măsurate folosind metode enzimatice (PishtazTeb, Iran). Ecuația Friedewald a fost utilizată pentru a calcula colesterolul lipoproteic cu densitate mică. Nivelurile de insulină plasmatică (Abnova, Taiwan) și omentină (MyBioSource, SUA) au fost măsurate prin testul imunosorbent enzimatic (ELISA) urmând protocoalele producătorului, respectiv.
Extracția ARN și reacția în lanț a polimerazei cantitative în timp real
analize statistice
Toate rezultatele sunt prezentate ca medie ± SD și au fost analizate folosind SPSS 18. Diferențele dintre grupuri au fost calculate folosind fie testul Student Student, fie analiza ANOVA (testul Tukey). Asocierea între variabile a fost calculată utilizând Pearson pentru variabila parametrică și testul de corelație Spearman Rho pentru non-parametric. Valorile P
Rezultate
Parametrii biochimici și masa corporală
Rezultatele nu au arătat diferențe semnificative în nivelul greutății corporale, FBG și alți parametri biochimici la începutul studiului. În timp ce 72 de ore după injecția STZ, șoarecii tratați cu STZ (grupa 2) au prezentat hiperglicemie semnificativă comparativ cu grupul martor (12,31 ± 1,85 vs. 5,16 ± 0,48 mmol/L) (P = 0,001) (Fig. 1a). La trei săptămâni după apariția diabetului, greutatea corporală în grupul diabetic de tip 1 a fost semnificativ redusă în comparație cu grupul de control și a continuat până la sfârșitul experimentului (24,31 ± 0,5 g, vs. 32,21 ± 1,7 g), respectiv (P = 0,001) ( Fig. 1b). În plus, aportul de apă și alimente a crescut, dar datele nu sunt prezentate.
Concentrația glicemiei (A) și greutatea corporală (b) pe parcursul a 9 săptămâni după injectarea STZ în grupul diabetic de tip 1 comparativ cu grupul martor
Hrănirea șoarecilor cu dietă bogată în grăsimi timp de 12 săptămâni a arătat creșteri semnificative ale FBG și ale greutății corporale în grupul 3 în comparație cu grupul 4. Cu toate acestea, injectarea STZ (45 mg/kg) în săptămâna a 7-a a indus hiperglicemie și a scăzut greutatea corporală a HFD + STZ și respectiv NPD + STZ, în timp ce greutatea corporală și FBG în grupul HFD + STZ au fost încă semnificativ mai mari decât NPD + STZ (Fig. 2).
Concentrația glicemiei (A) și greutatea corporală (b) pe parcursul a 12 săptămâni după injectarea HFD și STZ în a 7-a săptămână în grupurile de diabet zaharat de tip 2 comparativ cu martorul
Modificările nivelurilor altor parametri biochimici, precum și ale nivelului plasmatic de omentină și insulină au fost evaluate la toate grupurile la sfârșitul experimentului și ilustrate în Tabelul 1.
În timpul studiului prezent, creșterea glicemiei, a consumului de apă și a urinării a indicat inducerea cu succes a T1D. Șoarecii T2D care au fost hrăniți cu HFD au crescut greutatea corporală, trigliceridele și concentrațiile circulante ale colesterolului, comparativ cu grupul martor. În plus, concentrația de glucoză plasmatică și nivelurile de insulină au fost crescute la șoareci cu HFD, care împreună prezintă o toleranță redusă la glucoză și rezistență la insulină.
Deoarece rezultatele au arătat că glicemia în jeun a crescut după inducerea diabetului. Trigliceridele serice au fost crescute în mod semnificativ la șoarecii diabetici T1D, HFD + STZ și NPD + STZ de tip 2. Serul total de colesterol a crescut, de asemenea, semnificativ la șoarecii HFD + STZ. Nivelurile LDL-C nu au fost modificate în diferite grupuri, în timp ce nivelurile HDL-C au fost crescute semnificativ la șoarecii diabetici de tip 2 T1D și HFD + STZ. Nivelurile serice de omentină au fost crescute în T1D (P = 0,01), în timp ce nivelurile de omentină au fost reduse la șoarecii NPD + STZ (P = 0,001), dar nu și în HFD + STZ, în comparație cu grupul de control. Mai mult, aminotransferazele serice ALT au fost crescute la șoarecii diabetici T1D (de 14 ori) și T2D (de două ori). Mai mult, valorile AST au crescut semnificativ în grupul T1D (dublu), dar nu și în celelalte grupuri de studiu.
Nivelurile de glucoză din sânge după un test de toleranță orală la glucoză la șoareci T2D și grupurile sale de control au fost menționate în Tabelul 2. Deoarece concentrațiile de glucoză din sânge au fost similare în ambele grupuri, prin urmare, OGTT au fost efectuate pentru a compara rezistența la insulină. Rezultatele au arătat că rata dispariției glucozei în alimentarea cu NPD a fost semnificativ mai mare decât în alimentarea cu HFD.
Expresia genei Omentin
Am examinat modificările exprimării genice a omentin în modelele T1D și T2D includ stările HFD + STZ și NPD + STZ. După cum rezultatele au arătat omentin expresiile genetice au scăzut la șoarecii T2D, care au fost induse de HFD și NPD hrănind cu doze mici de STZ, omentin expresie crescută în urma T1D (P Fig. 3
Legat de țesutul adipos omentin expresia genelor la modelele de șoareci diabetici de tip 1 și tip 2. Valorile sunt medii ± SD. Grup de control: chow regulat (Grupa 1); T1D: diabet de tip 1 (grupa 2), T2D (HFD + STZ): dietă bogată în grăsimi cu doză mică de STZ (grupa 3), T2D (NPD + STZ): dietă normală cu pelete cu doză mică de STZ (grupa 4)
Discuţie
În prezentul studiu, omentin expresia genică a fost examinată în țesuturile adipoase ale modelelor de șoareci T1D și T2D care au fost induse de doze mai mari și mai mici de STZ cu dieta normală cu pelete și HFD pentru investigarea efectelor masei grase asupra metabolismului insulinei în diferite tipuri de diabet. Multe studii au încercat să detecteze asocierile dintre nivelurile serice de omentină și diferite tipuri de diabet. Cu toate acestea, s-au efectuat câteva studii pentru a găsi mecanismul molecular al variației omentin expresia genelor în diferite tipuri de diabet și relația sa cu parametrii biochimici serici în T1D și T2D.
Rezultatele obținute ale acestui studiu au arătat că nivelurile de insulină plasmatică au fost semnificativ reduse la șoarecii diabetici de tip 1. În plus, a existat o creștere semnificativă a nivelurilor de insulină la șoarecii diabetici HFD + STZ tip 2. Cu toate acestea, nu a fost observată nicio diferență semnificativă la șoarecii diabetici de tip 2 NPD + STZ, comparativ cu grupul martor.
În ceea ce privește nivelurile plasmatice de omentină, a existat o diferență semnificativă în modelul T1D și NPD + STZ al T2D; cu toate acestea, nivelurile de omentină în T2D cu HFD + STZ nu au fost semnificative statistic. Cu toate acestea, ancheta de omentin expresia genică în țesuturile adipoase din grupurile studiate a arătat că omentin nivelul de expresie a fost semnificativ mai mare la șoarecii T1D; Însă omentin expresia a dus la o reducere semnificativă a ambelor modele de șoareci T2D.
În ciuda diferențelor semnificative ale nivelurilor plasmatice de omentină în diabetul HFD + STZ de tip 2, rezultatele obținute au arătat că nivelurile de omentină ale șoarecilor HFD + STZ au fost mai mici decât cele ale T1D. În plus, expresia genică a omentin în țesuturile adipoase ale șoarecilor HFD + STZ au fost semnificativ mai mici decât cele ale grupurilor T1D și ale grupului martor. Aceste rezultate au sugerat că concentrațiile de omentină circulante nu pot fi întotdeauna asociate cu masa țesutului adipos, iar rolul fiziologic/hormonal al omentinei poate fi local în semnalizarea insulinei.
S-a demonstrat că administrarea dependentă de doză de glucoză și insulină la țesuturile adipoase omentale umane are ca rezultat o reducere a omentin-1 expresie. În plus, perfuzia de insulină - glucoză la persoanele sănătoase poate reduce semnificativ concentrația plasmatică de omentină-1. Prin urmare, rezultatele menționate mai sus au arătat că producția de omentină-1 este sub reglarea glucozei și a insulinei [23].
A demonstrat că indivizii subponderali aveau niveluri mai ridicate de omentină-1 plasmatică decât cei care erau supraponderali. Mai mult, omentina-1 plasmatică este invers corelată cu indicele de masă corporală și rezistența la insulină; cu toate acestea, a fost asociat pozitiv cu nivelurile HDL-C. De asemenea, a arătat că omentin expresia genică a scăzut odată cu obezitatea. Luate împreună aceste rezultate arată în mod clar că obezitatea reduce concentrația serică de omentină-1 la adulți și adolescenți [3].
S-a raportat că omentina este exprimată preferențial în celulele Paneth intestinale de șoarece [13]. Cu toate acestea, rezultatele mai multor studii au arătat că omentin gena se exprimă în principal în țesutul adipos visceral uman. Mai mult, a observat că omentin este greu exprimată în țesutul adipos visceral de șoarece. Aceste descoperiri sugerează că omentina poate juca un rol mai important în țesutul adipos al oamenilor decât la șoareci [12, 24].
În studiul de față, s-a demonstrat că omentin a fost exprimată în țesuturile adipoase ale șoarecilor C57BL/6 și expresia sa este modificată în diferite tipuri de diabet. Conform rezultatelor prezentului studiu, s-a dezvăluit că omentin Nivelurile de ARNm în modelul T1D au crescut de 3,68 ori și au avut o corelație pozitivă cu nivelurile serice de omentină. Mai mult, omentin Nivelurile de ARNm în modelele T2D, inclusiv HFD + STZ și NPD + STZ, au fost atenuate la 0,31 și respectiv 0,15 ori. De asemenea, nu a existat nicio corelație semnificativă între nivelurile de ARNm aferente și nivelurile serice de omentină. Cu toate acestea, s-a observat o asociere negativă între omentin ARNm și nivelurile serice de ALT în modelul HFD + STZ.
Pe baza rezultatelor obținute ale prezentului studiu, s-a arătat, de asemenea, că omentin expresia genică a avut o corelație pozitivă cu greutatea animalului, în timp ce a avut o relație negativă cu glicemia în repaus alimentar în modelul NPD + STZ. Aceste descoperiri au reflectat că nu numai omentin a fost exprimat în șoareci țesut adipos visceral, dar, de asemenea, se poate modifica în funcție de diferite condiții metabolice.
Se raportează că concentrația serică de omentină a fost semnificativ mai mică la copiii cu T1D decât la copiii martori [5]. Cu toate acestea, în studiul actual, concentrațiile serice de omentină la șoarecii T1D au crescut, urmate de creșterea expresiei genetice în țesuturile adipoase.
S-a demonstrat că nivelul seric al omentinei este semnificativ redus la șoarecii obezi, comparativ cu cei neobezi [18]. Cu toate acestea, un alt studiu a demonstrat că nivelurile serice de omentină au fost similare între grupurile obeze și non-obeze [26]. În mod similar, nu a existat nicio diferență semnificativă între șoarecii diabetici obezi și controalele normale non-obeze din acest studiu.
A demonstrat că nivelurile serice de omentină au crescut la șobolanii diabetici induși cu STZ [27]. În mod similar, ambele țesuturi adipoase au legătură cu omentin expresia genică și nivelurile serice de omentină în modelul T1D au fost crescute în studiul actual. Deoarece producția de insulină a fost suprimată la șoarecii T1D, a emis ipoteza că omentin expresia genelor și nivelurile sale serice cresc pentru a compensa deficitul de insulină în diabetul de tip 1.
Într-un studiu care a fost efectuat la T2D experimental la șobolani, nu a existat nicio modificare a nivelurilor de omentină în grupurile care includ HFD și doza mică de STZ [28]. În mod similar, nivelurile serice de omentină la șoarecii C57BL/6 T2D induși cu HFD și o doză mică de STZ nu s-au modificat semnificativ în prezentul studiu.
Rezultatele obținute ale prezentului studiu au arătat că omentin Nivelurile de ARNm pot fi afectate de modificări ale masei țesutului adipos la modelul șoarecilor. Mai mult, modificările nivelurilor serice de omentină ar putea depinde de diferite condiții metabolice. Pe de altă parte, sursa omentinei serice poate fi diferită în funcție de starea de sănătate și de boală.
Concluzii
Rezultatele obținute au arătat că șoarecii țesutul adipos au avut un rol important în producerea omentinei. În plus, omentina circulantă se poate modifica, urmată de condiții diferite și ar putea fi legată de masa de grăsime viscerală. Țesutul adipos înrudit omentin expresia genică și nivelurile serice de omentină ale șoarecilor diabetici de tip 1 și NPD + STZ model 2 crescute și, respectiv, reduse. Cu toate acestea, șoarecii model diabetic HFD + STZ de tip 2 nu au prezentat diferențe semnificative în nivelurile serice de omentină. Cu toate acestea, adipocitul a fost legat omentin expresia genică a scăzut semnificativ. A crescut omentin expresia genică a arătat o corelație semnificativ negativă cu nivelurile serice de insulină la șoarecii T1D. Cu toate acestea, a scăzut omentin expresia genelor s-a corelat pozitiv cu nivelurile serice de insulină în modelele T2D. În consecință, s-a ajuns la concluzia că creșterea masei grase și a metabolismului insulinei-glucozei pot juca un rol important în exprimarea omentin. Mai mult, este posibil ca omentina serică să nu respecte întotdeauna expresia genică și efectul variațiilor insulinei-glucoză în diferite tipuri de diabet asupra omentin expresia genică poate fi mai mult decât o masă crescută de grăsime.
Disponibilitatea datelor și a materialelor
Partajarea datelor nu se aplică acestui articol.
- Hipertiroidismul experimental scade expresia genică și nivelurile serice ale adipokinelor în obezitate
- Morfologia intestinului și expresia genelor în obezitate Scurtă analiză și perspective - ScienceDirect
- Profilul de expresie genică hepatică timpurie a metabolizării lipidelor la șoareci la o dietă bogată în grăsimi după tratament
- Obezitate indusă de dietă și modificări ale expresiei genei hepatice la șoareci cu deficit de C57BL6J și ICAM-1
- Glucoza, insulina, obezitatea și diabetul de tip 2 Care este conexiunea comună E