1 Departamentul de Medicină Internă, Școala de Medicină Botucatu, Universitatea din statul São Paulo, 18618-000 Botucatu, SP, Brazilia
2 Departamentul Sport, Centrul de Educație Fizică și Sport, Universitatea Federală din Espirito Santo (UFES), 29075-910 Vitória, ES, Brazilia
Abstract
1. Introducere
Hormonii tiroidieni influențează metabolismul energetic [1] și joacă un rol central în reglarea metabolismului țesutului adipos [2]. Perturbările acestor hormoni sunt asociate cu modificări ale greutății corporale și ale cheltuielilor de energie [3]. Deși este bine cunoscut faptul că hipertiroidismul duce la scăderea în greutate, iar hipotiroidismul este asociat cu creșterea în greutate, modificările funcției tiroidiene sunt discutate controversat în obezitate [4].
Hormonii tiroidieni sunt implicați în reglarea țesutului adipos, în timp ce hormonii produși de țesutul adipos, cum ar fi rezistina, adiponectina și leptina, sunt implicați în reglarea echilibrului energetic [18]; cu toate acestea, relația dintre acești hormoni în obezitate este controversată și abia abordată. În acest context, obiectivul nostru în acest studiu a fost de a analiza influența dozei suprafiziologice de T3 asupra expresiei genice și a concentrației serice de leptină, rezistină și adiponectină la animalele obeze.
2. Materiale și metode
2.1. Animale și protocol experimental
Acest studiu a folosit bărbați Wistar șobolani, cu o greutate de aproximativ 150 g, furnizate de Centrul pentru animale al Laboratorului Experimental de Medicină Clinică de la Universitatea de Stat „Júlio de Mesquita Filho” Paulista din Botucatu, Sao Paulo, Brazilia. Animalele au fost inițial împărțite în două grupuri: martor (C) - alimentat cu chow comercial ad libitum - și obez (OB) - alimentat cu o dietă hipercalorică, așa cum s-a descris anterior [19], pentru a induce obezitatea. După inducerea obezității, animalele OB au fost randomizate în două grupe: animale obeze (OB,
) și animalelor obeze li s-a administrat o doză suprafiziologică de T3 (OT) la o concentrație de 25 μg/100 g greutate corporală (BW) [20]. T3 a fost administrat prin injecții subcutanate, o dată pe zi, în ultimele 2 săptămâni [21, 22]. Volumele adecvate de ser fiziologic au fost administrate, prin injecții subcutanate, grupurilor OB și C. Animalele au fost adăpostite în cuști individuale sub temperatură ambiantă controlată (22-26 ° C) și iluminare (ciclu lumină-întuneric de 12 ore). Consumul dietetic a fost controlat zilnic și greutatea a fost evaluată săptămânal. Protocolul experimental a fost aprobat de Comisia pentru Etică în Experimentarea Animalelor de la Botucatu - Școala de Medicină UNESP și a urmat „Liniile directoare pentru îngrijirea și utilizarea animalelor experimentale”.
2.2. Grăsime corporală totală
Grăsimea corporală totală a fost măsurată ca suma depozitelor de grăsime epididimală, retroperitoneală și viscerală [23]. Acest punct de date a fost utilizat pentru a confirma obezitatea la animale. În plus, a fost calculat indicele de adipozitate (grăsimea corporală totală împărțită la greutatea corporală finală înmulțită cu 100, adaptat de Boustany și colab. [24]).
2.3. Analiza biochimică a serului
Animalele au fost postite timp de 12 până la 15 ore, anesteziate cu pentobarbital de sodiu, 50 mg/kg/ip și sacrificate prin decapitare. Sângele a fost colectat în tuburi uscate și centrifugat la 3000 rpm timp de 10 minute. Serul a fost depozitat la -80 ° C. Concentrațiile serice de glucoză și triacilglicerol (TG) au fost testate folosind truse specifice (CELM, São Paulo, Brazilia). Acizii grași liberi (FFA) au fost determinați utilizând un kit comercial (WAKO, WAKO Pure Chemical Industries Ltd., Osaka, Japonia). Dozarea a fost analizată prin metoda enzimatică colorimetrică automată (Technicon, RA-XT System, Global Medical Instrumentation, Minnesota, SUA).
2.4. Măsurători hormonale
Concentrațiile serice de insulină, leptină, rezistină, adiponectină, T3 liber, T4 liber și TSH au fost măsurate la toate animalele. Măsurătorile au fost efectuate prin imunoanaliză, măsurată cu un cititor de microplăci (Spectra Max 190 - Molecular Devices, Sunnyvale, CA, SUA). Kituri comerciale au fost utilizate pentru măsurarea leptinei, insulinei, adiponectinei (kit ELISA-Millipore, St. Charles, MO, SUA), rezistină (kit ELISA-B-Bridge International Inc., Mountain View, CA, SUA) și tiroidă hormoni (kit ELISA-USCN Life Science & Technology Company, Wuhan, China).
2.5. Expresia genelor
ARN întreg a fost extras din țesutul adipos retroperitoneal folosind reactivul Trizol (Invitrogen, Sao Paulo, Brazilia), conform instrucțiunilor producătorului. Sistem de sinteză First-Strand SuperScript II pentru RT-PCR Kitul (Invitrogen, Sao Paulo, Brazilia) a fost utilizat pentru sinteza a 20 μL de ADN complementar (ADNc) de la 1000 ng de ARN întreg. Nivelurile de ARNm de leptină (test Rn 00565158_mL - Applied Biosystems), rezistină (test Rn 00595224_mL - Applied Biosystems) și adiponectin (test Rn 00595250_mL - Applied Biosystems) au fost determinate de PCR în timp real. Măsurătorile cantitative au fost făcute cu kitul comercial TaqMan qPCR (Applied Biosystems), conform instrucțiunilor producătorului, în sistemul de detectare Applied Biosystems StepOne Plus. Condițiile de ciclism au fost după cum urmează: activarea enzimei la 50 ° C timp de 2 min, denaturarea la 95 ° C timp de 10 min, produsele ADNc au fost amplificate pentru 40 de cicluri de denaturare la 95 ° C timp de 15 s și recoacere/extensie la 60 ° C timp de 1 min. Expresia genică a fost cuantificată în raport cu valorile grupului C după normalizare printr-un control intern (test de ciclofilină Rn 00690933_mL - Biosisteme aplicate) prin metodă
, după cum s-a descris anterior [25].
2.6. Analize statistice
Modificările greutății corporale au fost evaluate cu un interval de încredere de 95%. Expresia genelor, biochimia și datele hormonale au fost analizate folosind analiza varianței (ANOVA) completată de testul lui Bonferroni. Datele sunt exprimate ca medie ± deviație standard. A fost adoptat un nivel de semnificație de 5%.
3. Rezultate
3.1. Evoluția greutății corporale
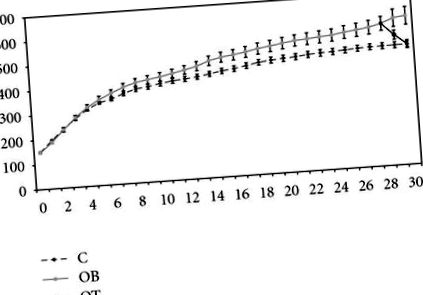
Toate animalele aveau BW similar la începutul studiului. Până în săptămâna 13, animalele OB erau mai grele decât grupul C. După 30 de săptămâni de experiment, BW al grupului OB (604 g ± 36 g) a fost statistic mai mare decât cel al grupului C (488 g ± 11 g). BW al grupului OB + T3 (489 g ± 16 g) a fost semnificativ mai mic decât grupul OB, dar nu semnificativ diferit de grupul C (Figura 1).
), și obezi cu 25 μg T3/100 g BW (OT,
3.2. Grăsime corporală totală
Dieta hipercalorică a crescut depunerile de grăsimi și indicele de adipozitate. Administrarea de T3 a scăzut depunerile de grăsime retroperitoneală, viscerală și epididimală. În mod similar, administrarea T3 a scăzut indicele total de grăsime corporală și adipozitate (Tabelul 1).
g T3/100 g BW. Date exprimate ca medie ± deviație standard. A fost utilizată ANOVA, completată de testul lui Bonferroni. Utilizarea acelorași litere reprezintă
; diferite litere reprezintă
3.3. Analiza biochimică
Tabelul 2 prezintă valorile pentru glucoză, TG și FFA. Dieta hipercalorică nu a modificat parametrii biochimici în comparație cu grupul C. A existat o creștere a nivelurilor de glucoză și FFA, dar nu a existat nicio diferență statistică în nivelurile TG în grupul OT în comparație cu grupul OB.
g T3/100 g BW. Date exprimate ca medie ± deviație standard. A fost utilizată ANOVA, completată de testul lui Bonferroni. Utilizarea acelorași litere reprezintă
; diferite litere reprezintă
3.4. Măsurători hormonale
Dieta hipercalorică nu a modificat profilul tiroidian; cu toate acestea, s-a observat o creștere a nivelurilor de leptină și rezistență și o scădere a concentrației serice de adiponectină. În grupul OT, nivelurile T3 au fost crescute, dar concentrațiile serice de T4 și TSH libere au fost diminuate (Tabelul 3). Administrarea T3 a redus nivelurile serice ale adipokinelor, a evaluat leptina (Figura 2 (a)), rezistina (Figura 2 (b)) și adiponectina (Figura 2 (c)).
g T3/100 g BW. Date exprimate ca medie ± deviație standard. A fost utilizată ANOVA, completată de testul lui Bonferroni. Utilizarea acelorași litere reprezintă
; diferite litere reprezintă
); VT: obez cu 25 μg T3/100 g BW (
). Date exprimate ca medie ± deviație standard. A fost utilizată ANOVA, completată de testul lui Bonferroni. Utilizarea acelorași litere reprezintă
; diferite litere reprezintă
3.5. Expresia genelor
Folosind PCR în timp real, expresia genică a fost analizată folosind 6 animale pe grup. Probele au fost normalizate printr-un control intern (ciclofilină), iar grupul C a fost normalizat de 1. Expresia genică a leptinei (Figura 3 (a)) și a rezistinei (Figura 3 (b)) a fost crescută în grupul OB, dar diminuat în grupul VT. Comparativ cu grupul C, expresia genei adiponectinei (Figura 3 (c)) a fost redusă prin dieta hipercalorică. Comparativ cu grupul OB, administrarea T3 a scăzut nivelul de expresie a adiponectinei.
); VT: obez cu 25 μg T3/100 g BW (
). Date exprimate ca medie ± deviație standard. A fost utilizată ANOVA, completată de testul lui Bonferroni. Utilizarea acelorași litere reprezintă
; diferite litere reprezintă
4. Discutie
Obezitatea este o afecțiune care a atins niveluri epidemice în ultimii ani [6]. Este o boală complexă, în care stilul de viață interacționează cu susceptibilitatea genetică pentru a produce fenotipul obez. În zilele noastre, creșterea substanțială a indicilor de obezitate pare a fi cauzată de stilul de viață al populației, în special din cauza dietelor inadecvate și a lipsei de activitate fizică [4]. Stilul de viață este extrem de recunoscut ca jucând un rol central în etiologia bolilor cronice [26]. Mai mult, obezitatea este asociată cu mai multe boli cronice, inclusiv boli coronariene, hipertensiune arterială, diabet zaharat de tip 2 și unele forme de cancer [5].
Comportamentul omogen al animalelor nu este asigurat în studiile experimentale, chiar și atunci când acestea sunt menținute în condiții de laborator. În acest context, șobolanii, având în vedere rații normocalorice sau hipercalorice în modele de obezitate indusă de dietă, pot prezenta răspunsuri diferite cu caracteristici comune [27]. Astfel, pot apărea erori de clasificare, astfel încât animalele supuse unei diete normocalorice să poată fi clasificate drept controale, atunci când de fapt prezintă răspunsuri similare animalelor care au devenit obeze printr-o dietă hipercalorică sau invers. Din acest motiv, devine necesar să se stabilească un criteriu care să permită separarea animalelor în control sau obezitate. Un studiu efectuat în laboratorul nostru a arătat că cel mai bun indicator al obezității este adipozitatea corporală, dar acest indice este obținut după ce animalul este eutanasiat [27]. Cu toate acestea, BW, evaluat in vivo, prezintă o bună corelație cu indicele de adipozitate [27]. În acest context, grupurile de control și obezitate au fost constituite prin aplicarea BW ca criteriu de clasificare a studiului.
Administrarea de doze suprafiziologice de T3 a crescut concentrația serică de T3 [28]. La animalele OT, nivelurile libere de T4 și TSH au fost diminuate în comparație cu animalele OB, nu este surprinzător deoarece T3 exogen suprimă secreția endogenă de TSH și T4 de către tiroidă [29], demonstrând eficacitatea tratamentului.
Dietele hipercalorice induc creșterea în greutate și adipozitatea accentuate. Consumul de diete bogate în grăsimi nu mărește oxidarea lipidelor în aceeași proporție, ceea ce duce la creșterea greutății corporale datorită depunerii de triacilglicerol în țesutul adipos [30, 31]. Dozele suprafiziologice de T3 au scăzut greutatea animalelor OB și au redus indicele de adipozitate (Figura 1, Tabelul 1). Hormonii și citokinele induc răspunsuri metabolice distincte în diferite depozite de grăsime [32], iar acest studiu arată o mobilizare similară a tuturor depozitelor de grăsime din grupul OT (Tabelul 1).
Hormonii tiroidieni reglează metabolismul lipidelor [33] și că excesul lor, printre alte efecte, mărește lipoliza, concentrația plasmatică a lipidelor intermediare și peroxidarea lipidelor [34]. Concentrațiile de acizi grași liberi sunt folosite pentru a indica mobilizarea grăsimilor [35]. În prezentul studiu, administrarea T3 crește lipoliza în grupul OT, dar nu a modificat nivelurile TG (Tabelul 2). Aceste date sunt în acord cu alte rapoarte ale nivelurilor de TG care nu sunt influențate de hormonul tiroidian [36].
Excesul de hormoni tiroidieni mărește nivelul glucozei plasmatice [37]. Administrarea de T3 a produs o diminuare semnificativă a nivelurilor de insulină plasmatică la animalele tratate (date neprezentate). Cu toate acestea, influența exactă a hormonilor tiroidieni asupra sensibilității la insulină și a metabolismului glucozei rămâne controversată [38]. Cu toate acestea, un factor important de subliniat în acest studiu este că hormonii tiroidieni induc pierderea în greutate într-o manieră legată de îmbunătățirea rezistenței la insulină (date neprezentate) [39].
Leptina poate influența interacțiunea dintre gene și factorii de mediu. Dietele bogate în grăsimi cresc nivelul de leptină pot afecta în mod diferit compoziția corpului, chiar și în cazul unor diete similare. Cu toate acestea, creșterea nivelului de leptină este mai bine explicată de o creștere a grăsimii corporale [31]. Studiile experimentale sugerează că sensibilitatea la leptină poate fi controlată de factori hormonali și nutriționali [40]. Literatura de specialitate arată o corelație pozitivă clară între țesutul adipos și expresia leptinei. Obezitatea indusă de dietă ridică expresia genică a leptinei [41, 42]. Cu toate acestea, efectele T3 asupra expresiei genetice a leptinei prezintă rezultate inconsistente; în ciuda datelor in vitro care arată că T3 produce o creștere dependentă de doză a expresiei leptinei [43], datele noastre arată că, în urma hipertiroidismului in vivo, expresia genei leptinei a fost redusă. În concordanță, Pinkney și colab. [2] și Zabrocka și colab. [28] a observat o diminuare a expresiei leptinei ca răspuns la tratamentul cu T3.
Rolul fiziologic al adiponectinei nu a fost încă complet elucidat. Datele experimentale sugerează că adiponectina mărește sensibilitatea la insulină și poate prezenta proprietăți antiaterogene și antiinflamatorii [44]. Este bine stabilit că nivelurile de adiponectină sunt invers proporționale cu gradul de adipozitate [45], iar pierderea în greutate ridică producția endogenă de adiponectină [46]. Aici demonstrăm că grupul OB a scăzut nivelurile serice de adiponectină în comparație cu grupul C, iar administrarea de T3, în mod interesant, chiar diminuând masa de grăsime corporală, a prezentat niveluri mai scăzute de adiponectină (Figurile 2 (c) și 3 (c) ). Confirmarea acestor date Cabanelas și colab. [47] prezintă expresie redusă a genei adiponectinei în explanții inghinali ai șobolanilor normali; De asemenea, am demonstrat recent că nivelurile de adiponectină au scăzut la șobolanii obezi cu restricții calorice [48]. Cu toate acestea, în contrast, un studiu experimental al șobolanilor cu hipertiroidism a arătat o creștere importantă a adiponectinei serice [49]. Datele noastre arată că dozele T3 suprafiziologice modifică expresia adiponectinei în obezitate, sugerând că T3 provoacă efecte nedorite asupra țesutului adipos.
Rezistina prejudiciază homeostazia glucozei și acțiunea insulinei la șoareci [50, 51]. Astfel, rezistina poate îndeplini un rol intermediar între obezitate și rezistența la insulină la rozătoare, deși acest rol este încă pus la îndoială la om [52]. În acest studiu, o dietă hipercalorică crește nivelurile serice de rezistină, în timp ce tratamentul cu T3 scade. Diminuarea semnificativă a rezistinei serice în grupul OT confirmă primul studiu efectuat pe oameni, în care pacienții cu hipertiroidism au prezentat concentrații scăzute de rezistență serică [53]. Cu toate acestea, aceste constatări inițiale contrastează cu studiile ulterioare care raportează niveluri ridicate de rezistină la pacienții cu hipertiroidism [54, 55], arătând o divergență în date. Cu toate acestea, expresia genei rezistinei este aproape nedetectabilă la șobolanii cu hipertiroidism [56]. Rezultatele noastre arată că administrarea dozelor suprafiziologice de T3 scade expresia rezistinei la nivelurile grupului C (Figura 3 (b)).
5. Concluzie
Tratamentul exogen cu T3 este eficient în creșterea nivelurilor serice de T3 liber și în scăderea concentrațiilor de T4 liber și TSH. Administrarea de T3 favorizează pierderea în greutate și scade adipozitatea. După administrarea T3, a existat o scădere a concentrației serice de leptină, rezistină și adiponectină, precum și o reducere a expresiei genice. Datele noastre demonstrează că T3 acționează, direct sau indirect, asupra adipokinelor derivate din țesutul adipos, care pot influența homeostazia întregului corp. Acest raport oferă noi perspective cu privire la relația dintre T3 și adipokine în modelul obezității.
Mulțumiri
Autorii îi mulțumesc pe Sandra Fábio, José Georgete, Mário Bruno și Sueli Clara pentru asistența lor tehnică. Sunt recunoscători lui Dijon HS Campos și Ricardo L Damatto pentru contribuția lor la eutanasierea animalelor. De asemenea, mulțumesc FAPESP pentru sprijinul financiar (procese: 06/58177-0 și 07/50041-4). Acest manuscris a fost corectat și editat de vorbitori nativi de limbă engleză cu experiență în corecția BioMed. Toți autorii declară că nu există conflicte de interese.
Referințe
- Morfologia intestinului și expresia genelor în obezitate Scurtă analiză și perspective - ScienceDirect
- Efectul metabolismului insulinei - glucozei în comparație cu obezitatea asupra expresiei genei omentinei adipoase în
- Obezitate indusă de dietă și modificări ale expresiei genei hepatice la șoareci cu deficit de C57BL6J și ICAM-1
- Exercițiul fizic, dar nu pierderea în greutate indusă de dietă scade expresia genei inflamatorii ale mușchilor scheletici în
- Efectele dependente ale dexametazonei asupra depunerii asupra expresiei genei la omul și omul abdominal