Editorii noștri vor examina ceea ce ați trimis și vor stabili dacă să revizuiți articolul.
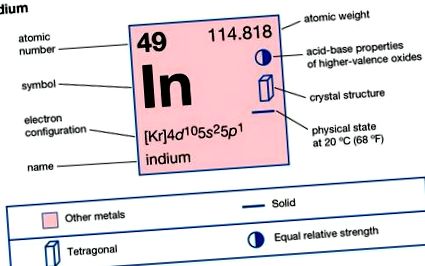
Indiu (în), element chimic, metal rar din grupa principală 13 (IIIa sau grup de bor) din tabelul periodic. Indiul are un luciu alb-argintiu strălucitor. A fost descoperită (1863) de chimiștii germani Ferdinand Reich și Hieronymus Theodor Richter în timp ce examinau probe de minereu de zinc. Prezența unei linii spectrale predominante indigo a sugerat numele. Indiul este mai moale decât plumbul și destul de plastic. Poate fi zgâriat cu unghia și poate suferi o deformare aproape nelimitată. La fel ca staniu, metalul pur emite un „strigăt” puternic atunci când este îndoit. Indiul este la fel de rar ca argintul. Crusta pământului conține în medie aproximativ 0,05 părți pe milion de indiu în greutate. Elementul nu apare necombinat sau în minerale independente, dar apare ca o urmă în multe minerale, în special cele de zinc și plumb, din care este obținut ca produs secundar.
Indiul are proprietatea neobișnuită când se topește de a se agăța de (umectează) sticla curată și alte suprafețe; acest lucru îl face valoros pentru producerea de sigilii ermetice între sticlă, metale, cuarț, ceramică și marmură. Indiul este utilizat la acoperirea rulmenților motorului aeronavei, deoarece îmbunătățește rezistența la coroziune și permite suprafeței să rețină o peliculă de ulei mai aderentă. Este un ingredient din unele aliaje cu topire redusă, utilizate în capetele de aspersoare, legăturile de la ușile de foc și dopurile fuzibile. Metalul este utilizat pe scară largă la fabricarea dispozitivelor semiconductoare și la lipirea diferitelor părți ale tranzistoarelor și redresoarelor de germaniu. Indiul este, de asemenea, utilizat pentru a măsura fluxul de neutroni termici al reactoarelor nucleare și pentru a monitoriza neutronii pentru protecția personalului și a echipamentelor. Indiul natural este un amestec de doi izotopi: indiu-113 (4,28 la sută) și indiu-115 (95,72 la sută).
Indiul metalic nu este afectat de aer la temperaturi obișnuite, dar la o căldură roșie arde cu o flacără albastru-violet pentru a forma oxidul galben In2O3. Acest oxid este ușor redus la metal și, la încălzire puternică, pierde oxigen pentru a da monoxidul, In2O, unde indiul este în starea de oxidare +1. Hidroxidul de indiu se dizolvă atât în acizi, cât și în alcalii.
Indiul este un element amfoteric; se dizolvă în acizi pentru a da săruri de indiu și, de asemenea, se dizolvă în alcalii concentrați pentru a da indați. Cu toate acestea, nu este afectat de hidroxid de potasiu sau apă clocotită. Când este încălzit în prezența halogenilor sau a sulfului, are loc o combinație directă. Deși au fost preparați câțiva compuși autentici ai indiului (de exemplu, halogenuri) în care elementul este în starea de oxidare +1, indiul prezintă în mod obișnuit starea +3 în compușii săi. Cu elementele principale ale grupului 15 (Va), indiul formează compuși (nitrură de indiu, fosfură de indiu, arsenidă de indiu, antimonidă de indiu) care au proprietăți semiconductoare. Au fost dezvoltați compuși nani structurați cu indiu, inclusiv nanoroduri de nitrură de indiu (InN) pentru tranzistoare cu efect de câmp de mare viteză și diode emițătoare de lumină (LED), care pot fi utilizate în televizoare și afișaje de computer.
Toți derivații de indiu anhidri cu încărcare triplă, cu excepția trifluorurii de indiu (InF3), sunt covalenți. Există o tendință marcată ca doi dintre electronii externi ai atomului de indiu (electronii externi 5s 2) să nu fie utilizați în legătură; această circumstanță are ca rezultat compuși de indiu încărcați individual.
- Furnizori de L-Carnitină, China Furnizori de L-Carnitină-TNJ Chemical Industry Co., Ltd.
- Mao Zedong - Revoluția culturală britanică
- N-Butanol derivat din căile biochimice și chimice O revizuire - ScienceDirect
- Moderare O provocare din elementul Pământ; Medicina Douăsprezece Râuri
- Recenzii chimice intracelulare Ca2 - și Mn2 - ATPaze de transport