Divizia de Hipertensiune și Cercetare Vasculară, Departamentul de Medicină Internă, Spitalul Henry Ford, Detroit, Michigan
Departamentul de Fiziologie, Facultatea de Medicină a Universității de Stat Wayne, Detroit, Michigan
Adresa pentru cereri de retipărire și alte corespondențe: A. B. Jaykumar, 6001 Forest Park Rd., ND7.202, Dallas, TX 75235 (e-mail: [e-mail protejat]).
Divizia de Hipertensiune și Cercetare Vasculară, Departamentul de Medicină Internă, Spitalul Henry Ford, Detroit, Michigan
Divizia de Hipertensiune și Cercetare Vasculară, Departamentul de Medicină Internă, Spitalul Henry Ford, Detroit, Michigan
Departamentul de Fiziologie, Facultatea de Medicină a Universității de Stat Wayne, Detroit, Michigan
Abstract
Abilitatea de a detecta și urmări molecule unice prezintă avantajul vizualizării comportamentului complex al proteinelor transmembranare cu o rezoluție de timp și spațiu care altfel s-ar pierde cu tehnicile de marcare tradiționale și biochimice. Dezvoltarea de noi sonde de imagistică a oferit o metodă robustă pentru a studia traficul și dinamica suprafeței acestora. Această mini-revizuire se concentrează pe tehnologia actuală disponibilă pentru marcarea unei singure molecule a proteinelor transmembranare, avantajele și limitările acestora. De asemenea, discutăm aplicarea acestor tehnici la studiul traficului de transport renal în lumina cercetărilor recente.
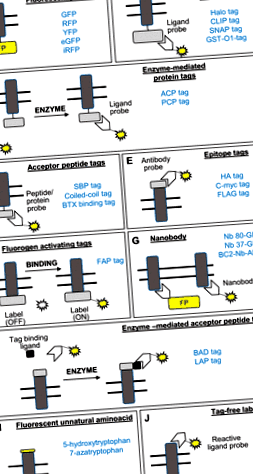
Dezvoltarea proteinelor fluorescente verzi și a altor proteine fluorescente verzi (FP) roșii/galbene/îmbunătățite, împreună cu versiunile sensibile la pH ale etichetelor (3), au oferit progresul inițial în capacitatea de a eticheta proteinele transmembranare, cum ar fi sodiul renal - cotransportor bicarbonat, cotransportor renal de sodiu-fosfat-2a), transportor renal de glucoză-4 (sau GLUT4), printre altele (2, 6, 18, 26, 36, 46, 50, 90, 91, 95, 96) 1A). Modificările ulterioare ale secvenței de codare FP și-au îmbunătățit proprietățile spectrale și biochimice. Proprietățile fluoroforului, cum ar fi coeficientul de extincție, randamentul cuantic, fotostabilitatea și sensibilitatea pH-ului (72) trebuie luate în considerare pentru diferite aplicații imagistice, cum ar fi transferul de energie prin rezonanță fluorescentă (24), microscopie confocală (79), microscopie fluorescentă cu reflexie internă totală (51) sau super -microscopie de rezolvare (62, 78). Cu toate acestea, există dezavantaje majore ale utilizării FP pentru etichetarea proteinelor de membrană, cum ar fi interferența cu activitatea endogenă a proteinei marcate din cauza supraexprimării (1), oligomerizarea cauzată de FP (68) și dimensiunea mare a etichetei.
30 kDa) (100). Aceste dificultăți au fost ocolite într-o oarecare măsură de strategii care reduc supraexpresia (4), optimizarea designului și lungimii linkerului și alegerea locului pentru inserarea secvenței FP (5, 48, 100). În ciuda contribuției inițiale enorme a FP standard în a face posibilă microscopia cu rezoluție superioară, proprietatea lor de a suferi o albire fotovoltaică ireversibilă, o fotostabilitate scăzută și un randament cuantic limitează utilizarea lor pentru experimentele la scară lungă. Cu toate acestea, proteinele fluorescente nou proiectate, cum ar fi proteinele fluorescente în infraroșu apropiat pe bază de fitocrom, au un raport semnal/zgomot și fotostabilitate mult mai ridicate, permițând astfel imagini mai profunde în țesuturi, ceea ce este, prin urmare, relevant pentru animalele vii sau excizate - modele de țesut (33).
FIG. 1.Reprezentarea diagramă a metodelor de etichetare cu o singură moleculă discutate în revizuire. Dreptunghiul în gri reprezintă o proteină transmembranară, liniile duble reprezintă bistratul fosfolipidic, iar o linie galbenă reprezintă o entitate fluorescentă. ACP, proteină purtătoare de acil; BAD, domeniul acceptor de biotină; BC2, epitop liniar scurt corespunzător 16-27 reziduuri de β-catenină; eGFP, proteină fluorescentă verde îmbunătățită; FAP, peptidă activatoare de fluorogen; GFP, proteină fluorescentă verde; GST-O1, glutation-s-transferază omega1; HA, hemaglutinină; LAP, peptida acceptorului acidului lipoic; PCP, proteină purtătoare de peptidil; RFP, proteină fluorescentă roșie; SBP, peptidă de legare a streptavidinei; TC, tetracysteine; UAA, aminoacid nenatural; YFP, proteină fluorescentă galbenă; α-BTX, α-bungarotoxină. Alte nume de etichete utilizate în exemple sunt nume de mărci comerciale, cum ar fi eticheta Halo, eticheta CLIP, eticheta SNAP și eticheta FLAG.
O alternativă la FP include Halo Tag (87), SNAP Tag (80, 89), CLIP Tag (101) și glutation-S-eticheta transferază-omega-1 (GST-O1) (59, 88) (Fig. 1B). Aceste etichete sunt încorporate genetic în proteina de membrană și au fost utilizate pentru a studia traficul receptorului factorului de creștere derivat din trombocite (87), al receptorului peptidului-1 de tip glucagon și al traficului de membrană în liniile celulare epiteliale ale rinichilor (80, 89), Receptorul β2-adrenergic și receptorul orexinei-1 (101), receptorul canabinoid și receptorul factorului de creștere epidermic (59, 101) în alte modele de celule. Marcajele sunt apoi modificate ulterior pentru a permite legarea prin legături covalente sau cu afinitate ridicată la un fluorofor organic cu fotostabilitate și luminozitate ridicate (10, 20). Aceste etichete au fost utilizate pentru a imagina simultan proteine cu două membrane (30, 101). Mai recent, s-au eliberat sonde SNAP-tag pentru a adăuga versatilitate în studiul endocitozei și reciclării (19). Aceste abordări chimice necesită de obicei mai mulți pași de spălare pentru a elimina fluoroforul nereacționat pentru a minimiza semnalul de fundal. Pentru a ocoli această problemă, a fost dezvoltată o sondă fluorogenă SNAP care fluorescă numai la legarea etichetei (75, 92). Rămân limitări suplimentare, cum ar fi supraexprimarea, care poate fi redusă prin utilizarea promotorilor cu expresie redusă (69) și greutatea moleculară mare a etichetei (
20-30 kDa). Această ultimă problemă a fost îmbunătățită prin dezvoltarea de etichete mai mici (
8 kDa), cum ar fi eticheta proteinei purtătoare de acil (15, 50) și eticheta proteinei purtătoare de peptidil (108), printre altele (109) (Fig. 1C). Acestea au fost folosite pentru a studia traficul de receptori de transferină (108) și receptori mirositori într-o linie de celule renale, unde rolurile lor încep să fie apreciate (50). Cu toate acestea, aceste etichete mai mici necesită în continuare adăugarea sau exprimarea unei enzime exogene pentru a atașa covalent fluoroforul.
S-a realizat o reducere semnificativă a mărimii etichetei prin adăugarea unor secvențe scurte de acceptori de peptide (
Acestea constau din încorporarea genetică a epitopilor precum hemaglutinina (HA), FLAG sau c-Myc în domeniile extracelulare și apoi utilizarea anticorpilor pentru marcare (Fig. 1E). Eticheta HA a fost utilizată pentru a studia traficul pe membrană al canalului renal de potasiu ROMK (29) și al proteinelor de membrană la alte modele de celule de mamifere (32, 52, 76). Eticheta FLAG a fost utilizată pentru a studia traficul pe membrană al receptorului renal de vasopresină de tip 2 și al receptorului gustului dulce T1R2/3 în modelul celulelor renale, în care rolul său începe să fie apreciat (11, 85) și eticheta c-myc de studiat acumularea de suprafață a aquaporinei-2 la stimularea vasopresinei în membranele rezistente la endocitoză din celulele renale (11). Cu toate acestea, sunt necesari timpi prelungiți de etichetare și mai multe etape de spălare pentru a îndepărta fluoroforul nelegat cu aceste metode, limitând utilizarea lor în microscopie cu intervale de timp.
Sunt fragmente variabile recombinante sau codificate genetic, specifice antigenului, ale anticorpilor cu lanț greu camelid, care sunt fie fuzionați genetic cu FP, fie conjugați cu coloranți sau enzime cromogene (83) (Fig. 1).G). Mărimea lor redusă, stabilitatea, replierea reversibilă, solubilitatea în soluție apoasă și capacitatea de a-și recunoaște țintele endogene într-o conformație tranzitorie specifică cu afinitate subnanomolară (73) le face exploatabile pentru urmărirea unei singure particule și manipularea cineticii de trafic de proteine de membrană (25, 40, 41, 47, 58, 61, 71, 97, 83, 97, 103).
O abordare recentă minimizează efectul nedorit al etichetelor de dimensiuni mari asupra funcției proteinelor prin utilizarea mutagenezei direcționate către sit pentru a permite încorporarea unui singur aminoacid fluorescent nenatural (UAA).Eu). Această metodă a fost utilizată pentru a studia traficul de receptor nicotinic ACh (70). Cu toate acestea, necesită coexprimarea perechilor adecvate de ARNt și aminoacil-ARNT sintetaze care recunosc UAA (100).
Această metodă permite etichetarea proteinelor în starea lor nativă (94, 98) (Fig. 1).). Este nevoie de un ligand cunoscut pentru proteina de suprafață (de exemplu, bradikinina), un aminoacid nucleofil expus la suprafață și un ligand de inginerie chimică pentru a transfera o sondă (biotină sau fluorescentă) la proteina de interes, pe baza unui tipic reacție de substituție nucleofilă a acilului (65).
Această lucrare a fost susținută, parțial, de premiul de bursă predoctorală American Heart Association 16PRE27510032 acordat Ankitei B. Jaykumar și National Institutes of Health Grant 1R01DK107263 01A1, precum și o Asociație Americană a Inimii acordată de Dr. Pablo A. Ortiz.
Autorii nu declară niciun conflict de interese, financiar sau de altă natură.
A.B.J. și P.S.C. figura pregătită; A.B.J. manuscris redactat; A.B.J., P.S.C. și P.A.O. manuscris editat și revizuit; A.B.J. și P.A.O. versiunea finală aprobată a manuscrisului.
MULȚUMIRI
Adrese actuale: A. B. Jaykumar, Departamentul de farmacologie, Univ. din Texas Southwestern Medical Center, Dallas, TX 75235; P. S. Caceres, Departamentul of Oftalmologie, Weill Cornell Medical College, New York, NY 10021.
- Răspunde Efect de pierdere în greutate asupra FVC în testele de fibroză pulmonară idiopatică Nintedanib American Journal
- Variabilitatea pe termen scurt a greutății corporale prezice creșterea în greutate pe termen lung The American Journal of
- Metabolismul proteinelor după vătămarea cu terebentină un model de șobolan pentru traume clinice American Journal of
- Sinteza peptidelor catalizate de proteaze pe Solid Support Journal al American Chemical Society
- Polimorfismul untului de cacao - Wille - 1966 - Journal of the American Oil Chemists; Societate - Wiley