1 Departamentul de Biofizică, Universitatea Federală din São Paulo, 04023-062 São Paulo, SP, Brazilia
2 Școala de Arte, Științe și Științe Umaniste, Universitatea din Sao Paulo, Avenue Arlindo Bettio 1000, 03828-000 São Paulo, SP, Brazilia
3 Departamentul de Imunologie, Laboratorul de Imunobiologie a Transplanturilor, Institutul de Științe Biomedice, Universitatea din São Paulo, 05508-900 São Paulo, SP, Brazilia
4 Departamentul de nutriție, Școala de nutriție, Universitatea Federală din Pelotas, 96010-610 Pelotas, RS, Brazilia
Abstract
1. Introducere
Inflamația cronică, de grad scăzut, este asociată cu rezistența la insulină, diabetul de tip 2 și mai multe tipuri de cancer [1, 2]. Aceste condiții dăunătoare sunt, de asemenea, asociate cu obezitatea [3]. Pe măsură ce adipocitele viscerale și subcutanate cresc în dimensiune, monocitele și celulele T CD4 + și CD8 + migrează către țesutul adipos (AT) [4] inițierea eliberării mediatorilor proinflamatori (de exemplu, IL-1)
, IL-6, RANTES, MCP-1 și IL-18) inducând rezistență locală la insulină [5]. Astfel, AT-urile extinse și populațiile lor de celule imune rezidente constituie principalul microambient în care citokinele proinflamatorii sunt produse și eliberate în organism [6].
Activitatea fizică și restricția calorică (CR) sunt ambele strategii nonfarmacologice recomandate pentru reducerea obezității [7]. Deși efectele benefice ale exercițiilor fizice sunt bine descrise la nivelul mușchilor scheletici și al ficatului, același lucru nu este valabil pentru AT [7-9]. În plus, există puține informații cu privire la efectele ambelor strategii de reducere a greutății asupra populațiilor de celule imune care locuiesc în AT. În raport cu CR, deși importanța sa în reducerea greutății corporale este incontestabilă, consumul unei diete sănătoase necesită modificări atât de marcate ale stilului de viață încât mulți indivizi nu sunt în măsură să se conformeze uneia dintre ele.
Astfel, este important să se investigheze dacă exercițiul fizic și CR sunt capabile să promoveze un stil de viață sănătos, menținând în același timp o dietă bogată în grăsimi (IC). Scopul acestui studiu a fost investigarea efectului exercițiului fizic sau CR asupra celulelor imune AT la șoarecii obezi induși de dietă.
2. Materiale și metode
2.1. Animale
, 5 per grup) șoareci (cu vârste cuprinse între 8-12 săptămâni; 23-26 g) au fost obținuți de la unitatea de îngrijire a animalelor de la Universitatea Federală din São Paulo (UNIFESP). Toate animalele erau adăpostite în cuști individuale standard și aveau acces la apă și hrană. Pentru a examina modificările populației de celule vasculare stromale în țesutul adipos în condiții de obezitate indusă de dietă, am împărțit șoarecii C57BL/6 în patru grupuri și le-am hrănit fie cu o dietă standard de chow (6% grăsime, Nuvilab mod. CR-1) sau o dietă bogată în grăsimi (D12451, 45% Kcal grăsime, Research Diets). La 16 săptămâni, șoarecii au fost în continuare împărțiți în următoarele grupuri: (1) un grup de control alimentat cu un chow normal, cu conținut scăzut de grăsimi (LF); (2) un grup de control alimentat cu o dietă bogată în grăsimi (HF); (3) un grup de restricție alimentară alimentat cu o dietă bogată în grăsimi de 30% (HFREST); și (4) un grup de exerciții a hrănit o dietă bogată în grăsimi care a participat la 60 de minute de înot (HFEX). Consumul de alimente era controlat în fiecare zi. Pe baza cantității de chow dietetic bogat în grăsimi consumat și folosind compoziția macronutrienților ca referință, am calculat aportul de energie. Restricția calorică de 30% a fost concepută luând ca referință consumul de HF.
Toate procedurile au fost anterior revizuite și aprobate de comitetul etic intern al instituției.
2.2. Exercițiu Protocol
Animalele HFEX au fost supuse sesiunilor de înot într-un sistem de înot adaptat pentru șoareci cu apă încălzită la 30 ° C. Rezervorul de 300 litri avea 10 benzi și era echipat cu pompe de aer care mențineau șoarecii în mișcare constantă. Ședințele de înot au început cu 15 minute în prima săptămână și au crescut treptat în lungime până când șoarecii au reușit să înoate timp de 60 de minute pe zi. În acest moment, șoarecii HFEX au fost supuși la sesiuni de înot de 5 ori pe săptămână timp de 6 săptămâni. Atât exercițiul, cât și grupurile de restricție dietetică au fost supuse intervenției lor respective timp de 6 săptămâni.
Șoarecii au fost anesteziați cu ketamină/xilazină pentru recoltarea sângelui prin plex venos retroorbital și apoi uciși prin luxație cervicală. Sângele a fost centrifugat la 1000 g timp de 10 minute. Serul a fost îndepărtat și depozitat la -80 ° C pentru analize viitoare. Am colectat o probă de 1 g de inghinal adipos din fiecare grup și am supus proba la degradarea enzimatică. Toate animalele au fost cântărite săptămânal până la sfârșitul experimentelor.
2.3. Izolarea fracțiunii vasculare stromale (Sfv) și citometria de flux
După sacrificarea șoarecelui, țesutul adipos inghinal (IAT) a fost extras, cântărit și supus degradării enzimatice așa cum s-a descris anterior [10]. După izolarea celulelor IAT SFV, s-au adăugat 200 pl de tampon de spălare FCS (1x PBS, 2% SFC) și soluția a fost centrifugată timp de 5 minute. După ce supernatantul a fost aruncat, peleta a fost resuspendată în FCS și centrifugată timp de 5 minute la 600 g. Celulele au fost colorate cu anti-CD8 (Caltag-FITC-Medsystems, Buckingham, Marea Britanie), anti-CD4 (albastru-Pacific-BioLegend), anti-F4/80 (PerCP-Bioscience) și anti-NK.1 -Bioscience ) anticorpi. Celulele stromale au fost achiziționate prin FACS într-un citometru cu flux Canto II (BD, Becton Dickinson, NJ, SUA). Analizele datelor au fost finalizate utilizând programul FlowJo 8.7.4. (Tree Star Inc., Ashland, OR, SUA).
2.4. Analiza citokinelor în ser
Probele de ser au fost depozitate la -80 ° C. Panoul utilizat pentru imunoanaliza citokinei/chemokinelor Milliplex Mouse a inclus următoarele citokine: MCP-1, RANTES, TNF-alfa (factor de necroză tumorală), IL-6 și IL1-. Testarea a fost efectuată în conformitate cu procedurile descrise anterior de producător (panoul de citokine/chemokine Milliplex Mouse).
2.5. Test de toleranță la glucoză
Testul de toleranță la glucoză (GTT) a fost efectuat la animale postite timp de 12 ore. Pentru a evita stresul, a existat un interval de 7 zile între teste. Glicemia a fost măsurată folosind un glucometru (Accu-Check Advantage) care măsoară picăturile de sânge obținute din vena cozii. Pentru GTT s-a injectat intraperitoneal 1 g glucoză pe kg de greutate corporală (BW). Nivelurile de glucoză au fost determinate la momentul inițial, 0, 15, 30, 60 și 120 de minute după injectarea glucozei.
2.6. Analize statistice
Datele au fost prezentate ca medie
eroare standard în textul descriptiv și în grafică. Toate experimentele au fost comparate folosind ANOVA One Way urmat de testul Tukey post-hoc. Diferențe semnificative au fost determinate atunci când
valoarea a fost mai mică de 0,05 (
). Grafica a fost dezvoltată în Prism 5.0.
3. Rezultate
Animalele supuse dietei HF au consumat mai multe calorii în comparație cu șoarecii din grupul de dietă LF (Figura 1 (a)). Consumul caloric mai mare a fost însoțit de o creștere a masei corporale totale a șoarecilor (Figura 1 (b)). Înotul combinat cu dieta HF a reușit să reducă greutatea corporală a șoarecilor similară cu cea observată la animalele cărora li s-a administrat restricție calorică (Figura 1 (b)). Nu a existat nicio diferență în țesutul adipos inghinal (IAT) și țesutul adipos maro (BAT) între animalele antrenate și cele supuse restricției calorice (Figurile 1 (c) și 1 (d)); cu toate acestea, animalele antrenate au prezentat mai multe BAT decât animalele din grupul LF (Figura 1 (d)).
Se știe că obezitatea este asociată cu inflamații sistemice, de grad scăzut. Prin urmare, am investigat efectele unei diete HF, exerciții fizice și restricții dietetice în grupurile noastre de studiu prin evaluarea nivelurilor serice ale mai multor citokine proinflamatorii. Am observat niveluri crescute de IL-1 în grupul de dietă HF și o reducere a acestei citokine în ambele grupuri de intervenție (exerciții fizice și restricție calorică) (Figura 2 (a)). TNF-
nivelurile serice nu au fost afectate de modificările dietei și exercițiilor fizice investigate în acest studiu (Figura 2 (b)).
), dieta bogata in grasimi (HF,
), dieta bogata in grasimi cu exercitiu 60 ′ (HFEX 60 ′,
) și dietă bogată în grăsimi cu restricție alimentară de 30% (HFREST,
, (c) IL-6, (d) RANTES și (e) MCP-1. Rău
Pe lângă exercitarea funcțiilor pro și antiinflamatorii, IL-6 joacă, de asemenea, roluri importante atât în obezitate, cât și în exercițiul fizic. În timp ce dieta HF nu a modificat nivelul IL-6, antrenamentul la exerciții fizice și-a crescut nivelul (Figura 2 (c)). Reducerea greutății corporale nu a putut induce modificări ale nivelurilor IL-6, deoarece nu s-au observat diferențe la animale din grupul de restricție calorică (Figura 2 (c)).
Animalele supuse la înot au crescut semnificativ nivelurile serice RANTES (reglate la activare, celule T normale exprimate și secretate). Creșterile masei corporale și IAT observate la animalele supuse dietei HF nu au condus la modificări ale nivelurilor RANTES, deși este de așteptat infiltrarea cu limfocite AT în timpul obezității. Cu toate acestea, exercițiul fizic a crescut nivelurile serice RANTES, în timp ce restricția calorică nu i-a modificat nivelul (Figura 2 (d)). Mai mult, MCP-1 (proteina chimiotratantă monocitară-1) a fost redusă prin efort și nu a fost afectată de restricția calorică (Figura 2 (e)).
Deoarece celulele imune care locuiesc în AT obeze secretă activ citokine și chemokine proinflamatorii, am evaluat efectul dietei IC și ambele intervenții asupra populațiilor de leucocite AT. Am observat o reducere a limfocitelor T CD4 + și CD8 + la AT la animalele supuse ambelor intervenții în comparație cu animalele care consumă dieta HF (Figurile 3 (a) și 3 (b)). Deoarece celulele CD8 + au fost mai reduse decât celulele CD4 +, s-a observat un raport crescut CD4 +/CD8 + (Figura 3 (e)). Markerul natural al celulelor ucigașe (NK1.1) a fost afectat doar de restricția calorică (Figura 3 (c)). De asemenea, am observat că atât exercițiul fizic, cât și restricția calorică au fost capabili să inverseze infiltrația crescută de macrofage observată în grupul de dietă HF (Figura 3 (d)).
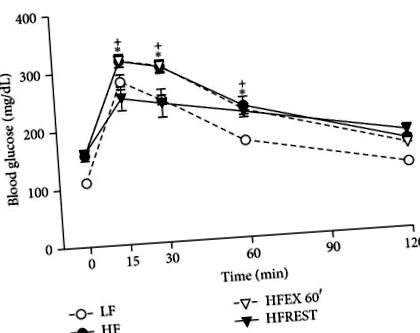
În ceea ce privește testul de toleranță la glucoză, sa observat că numai restricția calorică a reușit să îmbunătățească acest parametru în comparație cu grupul HF (Figura 4).
, HFEX 60 ′ versus HFREST;
4. Discutie
Celulele imune se află în țesutul adipos slab și obez, dar prezintă caracteristici diferite în fiecare afecțiune. Pe măsură ce adipocitele cresc în dimensiune, aceste celule imune se modifică în ceea ce privește numărul și funcționalitatea. Mai mult, astfel de modificări ale celulelor imune contribuie activ la stabilirea inflamației locale și sistemice de grad scăzut [11]. Exercițiul regulat este o strategie importantă nonfarmacologică pentru tratarea obezității, deoarece protejează împotriva creșterii masei corporale și contrabalansează mai multe consecințe dăunătoare datorate efectelor sale antiinflamatorii [12]. În mod normal, intervenția exercițiilor fizice cu modificări dietetice este sugerată pentru combaterea obezității; combinația ambelor intervenții funcționează mai bine decât exercițiul individual [13-15]. Cu toate acestea, se știe puțin despre beneficiile exercițiilor fizice atunci când modificările dietetice nu sunt prescrise.
Deoarece rezultatele noastre au demonstrat că exercițiile cronice sunt capabile să contrabalanseze mai multe modificări imune induse de IC (sau promovează modificări diferite), se pare că această intervenție este benefică chiar și atunci când se menține o dietă bogată în grăsimi. S-a demonstrat anterior că expansiunea AT reduce numărul de celule NK rezidente. Celulele NK produc cantități semnificative de interferon gamma (IFN-
), promovând o stare inflamatorie în AT. Studiile au arătat, de asemenea, că reducerea prezenței celulelor inflamatorii în AT îmbunătățește toleranța la glucoză la șoarecii cu deficit de IFN [16]. IFN- este, de asemenea, capabil să inhibe calea de semnalizare Hedgehog implicată în diferențierea adipocitelor [17]. Capacitatea exercițiului de a promova o creștere a numărului de celule NK în AT poate reflecta, de asemenea, un alt tip de infiltrare celulară, cum ar fi NKT, care pare să aibă un rol protector. Absența modificărilor numărului de celule NK se confirmă cu două studii anterioare care au raportat că pierderea celulelor NK are un efect redus sau deloc asupra parametrilor metabolici după o dietă de 45% HF timp de 26 săptămâni sau 60% din aceeași dietă timp de 12 săptămâni [18, 19].
În concordanță cu rezultatele anterioare [20, 21], am observat o frecvență crescută a macrofagelor la AT obeză. Macrofagele răspund la stimulii TLR producând cantități marcate de citokine proinflamatorii (de exemplu, IL-12, TNF, IL-1 și IL-6) crescând răspunsul inflamator AT [22]. În plus, acești mediatori imuni sunt implicați în rezistența la insulină și diabetul de tip 2 la organismele obeze [23]. Astfel, datele noastre referitoare la macrofage și țesut adipos de la animalele din dieta HF au fost în conformitate cu studiile anterioare care au arătat că s-a observat o infiltrare crescută a macrofagelor în AT. Deși nu am evaluat profilul macrofagelor (de exemplu, M1 și M2) în AT, am verificat că creșterea numărului de macrofage și a MCP-1, o moleculă importantă în recrutarea acestor celule [24], promovată de HF, a fost inversată prin exercițiu.
În acest studiu, infiltrarea crescută a macrofagelor datorată IC a fost urmată de un număr crescut de celule T CD8 + în AT. În schimb, reducerea macrofagelor promovată de efort și restricție calorică a fost urmată de un număr scăzut de celule T CD8 +. Celulele T adaptive sunt, de asemenea, legate de infiltrarea macrofagelor în AT [25]. Celulele T CD8 + cresc de 3 până la 4 ori în AT la oameni și animale supuse unor diete bogate în grăsimi și produc cantități mari de citokine și chemokine. Nishimura și colab. [25] a raportat că neutralizarea celulelor T CD8 + a redus infiltrarea macrofagelor și rezistența la insulină la șoarecii hrăniți cu o dietă bogată în grăsimi. Transferul adoptiv al celulelor T CD8 + la șoareci deficienți în această populație de celule agravează inflamația în AT. Împreună, aceste date sugerează că celulele T CD8 + sunt activate în AT de șoareci obezi și că aceste limfocite induc activarea macrofagelor și migrarea către AT.
Celulele T CD4 + joacă, de asemenea, un rol esențial în progresia obezității și sunt asociate cu inflamația prin secreția de citokine. La șoarecii Rag-1 KO, reconstituirea celulelor T CD4 + a redus creșterea greutății corporale, a dimensiunii adipocitelor, a toleranței la glucoză și a semnalizării insulinei [26, 27]. În acest sens, este tentant să speculăm că creșterea celulelor T CD4 + datorită unei diete HF ar putea compensa creșterea inflamației în AT. Reducerea acestor celule indusă de efort și restricție calorică sugerează că îmbunătățirea inflamației în AT induce o reducere a celulelor T CD4 +.
În sânge, precum și în majoritatea țesuturilor, raportul celulelor T CD4 +/CD8 + este în general mai mare de 2 până la 1. Consumul de HF a indus o reducere a acestui raport în AT. Este important de reținut că numai restricția calorică a reușit să restabilească numerele CD4 + și CD8 + la nivelurile observate în grupul LF și acest lucru ar putea fi legat de diferitele răspunsuri observate în testul de toleranță la glucoză.
Deoarece celulele imune care locuiesc în țesutul adipos reprezintă o sursă importantă de citokine și chemokine proinflamatorii în obezitate, am decis să investigăm dacă o dietă HF și intervențiile au afectat citokinele. Dieta HF a redus MCP-1 și a crescut RANTES în ser comparativ cu martorul. RANTES este un chimioactiv puternic pentru mai multe tipuri de celule [28], inclusiv celule NK [29]; creșterea sa în serul animalelor de control s-ar putea datora numărului mai mare de celule NK la aceste animale.
În plus, efectele restricției alimentare asupra nivelurilor MCP-1, RANTES și IL-6 au fost diferite în comparație cu cele observate în grupul instruit. Aceste observații sugerează că exercițiul și restricția calorică, considerate a fi capabile să atingă același scop, procedează prin mecanisme diferite [30]. Un alt exemplu al acestei afirmații este reducerea aportului de alimente promovat de exerciții fizice. În conformitate cu studiile anterioare [31, 32], un astfel de efect ar putea fi legat de efectul exercițiului asupra sensibilității la leptină asupra sistemului nervos central. Animalele antrenate au prezentat, de asemenea, o îmbunătățire a BAT în comparație cu grupul LF și este tentant să speculăm că o modificare a termogenezei ar putea influența reducerea greutății corporale la animalele antrenate. Prin urmare, rezultatele noastre sugerează că efectul exercițiilor cronice nu a fost limitat la practicile exercițiilor fizice datorate cheltuielilor calorice.
Câteva limitări trebuie, de asemenea, discutate. Deoarece modificările pe care le-am observat la nivelurile de citokine circulante nu au fost strict legate de numărul local de celule imune rezidente, este important de reținut că absența experimentelor de detectare a citokinelor țesutului adipos constituie o limitare a studiului nostru. De asemenea, rețineți că intensitatea exercițiului este un factor important pentru adaptări. Astfel, alte intensități diferite de cele pe care le-am evaluat ar putea induce modificări imune diferite de cele observate aici și acest lucru trebuie considerat ca o limitare a proiectării noastre.
5. Concluzii
Datele noastre demonstrează că atât exercițiul fizic, cât și restricția calorică au reușit să contrabalanseze efectele dăunătoare induse de o dietă IC. Intervențiile au indus o reducere a masei corporale și a grăsimii corporale. Cu toate acestea, aceste reduceri nu au putut explica toate rezultatele, deoarece efectele restricției alimentare și ale exercițiilor fizice nu au fost aceleași. Exercițiul pare să afecteze imunitatea înnăscută (adică NK1.1), în timp ce restricția dietetică a influențat imunitatea adaptativă (adică raportul CD4 +/CD8 +). Ambele intervenții au afectat nivelurile de citokine și chemokine în moduri diferite.
Conflict de interese
Autorii declară că nu au interese concurente.
Confirmare
Acest studiu a fost susținut de subvenții de la FAPESP (2011/03528-0).
Referințe
- Hrană pentru gândire Sfaturi de dietă de top pentru un sistem imunitar puternic
- Frontiere Exerciții ușoare de salvare Steroidogeneză și spermatogeneză la șobolani supuși alimentelor
- Efectul unei diete mediteraneene cu conținut ridicat de grăsimi asupra greutății corporale și circumferința taliei a fost pre-specificată
- Efectul nanofibrei de celuloză și a exercițiilor fizice asupra obezității și a microbiotei intestinale la șoarecii hrăniți
- Micobiota și microbiota tractului digestiv și efectele asupra sistemului imunitar - ScienceDirect