David Licha
1 Laboratoare de cercetare bioanalitică, Departamentul Biosciences and Cancer Cluster Salzburg, Universitatea din Salzburg, Hellbrunnerstraße 34, 5020 Salzburg, Austria
Silvia Vidali
2 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Departamentul de Pediatrie, Universitatea Paracelsus Medical, 5020 Salzburg, Austria
Sepideh Aminzadeh-Gohari
2 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Departamentul de Pediatrie, Universitatea Paracelsus Medical, 5020 Salzburg, Austria
Oliver Alka
3 Bioinformatică aplicată, Departamentul de Informatică, Universitatea din Tübingen, 72076 Tübingen, Germania
Leander Breitkreuz
1 Laboratoare de cercetare bioanalitică, Departamentul Biosciences and Cancer Cluster Salzburg, Universitatea din Salzburg, Hellbrunnerstraße 34, 5020 Salzburg, Austria
Oliver Kohlbacher
3 Bioinformatică aplicată, Departamentul de Informatică, Universitatea din Tübingen, 72076 Tübingen, Germania
4 Institutul de Bioinformatică și Informatică Medicală, Universitatea din Tübingen, Sand 14, 72076 Tübingen, Germania
5 Institutul de Bioinformatică Translațională, Spitalul Universitar din Tubinga, 72076 Tubinga, Germania
6 Interacțiuni biomoleculare, Institutul Max Planck pentru Biologie al Dezvoltării, Max-Planck-Ring 5, 72076 Tübingen, Germania
Roland J. Reischl
1 Laboratoare de cercetare bioanalitică, Departamentul Biosciences și Cancer Cluster Salzburg, Universitatea din Salzburg, Hellbrunnerstraße 34, 5020 Salzburg, Austria
René G. Feichtinger
2 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Departamentul de Pediatrie, Universitatea Paracelsus Medical, 5020 Salzburg, Austria
Barbara Kofler
2 Program de cercetare pentru biochimia receptorilor și metabolizarea tumorilor, Departamentul de Pediatrie, Universitatea Paracelsus Medical, 5020 Salzburg, Austria
Christian G. Huber
1 Laboratoare de cercetare bioanalitică, Departamentul Biosciences and Cancer Cluster Salzburg, Universitatea din Salzburg, Hellbrunnerstraße 34, 5020 Salzburg, Austria
Date asociate
Abstract
1. Introducere
Celulele canceroase care prezintă binecunoscutul „efect Warburg” sunt extrem de dependente de glucoză ca sursă de energie și prezintă frecvent fosforilare oxidativă scăzută, dar funcțională (OXPHOS). Chiar și în prezența oxigenului, aceștia își gestionează alimentarea cu energie în principal prin glicoliză aerobă, în care piruvatul este oxidat în lactat în loc să fie alimentat în ciclul acidului citric [15]. Studiile metabolomice vizate au arătat deja că KD duce la niveluri ridicate de corpuri cetonice în plasmă, derivate din β-oxidarea acizilor grași [16]. În timpul postului sau sub KD, acetoacetatul și β-hidroxibutiratul, produsele predominante ale cetogenezei, ar trebui să înlocuiască glucoza ca sursă primară de energie. După conversia la acetil-CoA, acestea sunt introduse în ciclul acidului citric, unde NADH este generat pentru a conduce producția de ATP prin fosforilare oxidativă, care are loc în membrana mitocondrială internă. În ceea ce privește cancerul, celulele tumorale ar trebui să fie puternic restrânse în producția de energie printr-o combinație de carbohidrați minima și absorbția extinsă a grăsimilor, în timp ce alimentarea cu energie a celulelor normale este asigurată prin corpuri cetonice [10,17].
Pe lângă inducerea formării corpului cetonice [10] și modificări ale metabolismului aminoacizilor [16], efectele globale ale KD asupra metabolomului sunt larg necunoscute, în special în ceea ce privește creșterea tumorii. Prin urmare, aici implementăm xenogrefele tumorilor umane ca modele de cancer pentru a studia efectul KD în combinație cu chimioterapia clasică. Pentru a acoperi cea mai largă gamă posibilă de caracteristici metabolice, am examinat efectele biologice ale terapiei prin analize metabolomice bazate pe HPLC-MS, care nu au ținte, folosind patru combinații diferite și ortogonale de selectivitate cromatografică și ionizare spectrometrică de masă. Folosind evaluarea datelor statistice pentru detectarea metaboliților reglementați semnificativ, ne-am propus să descoperim rețelele biologice și căile implicate în adaptarea la KD în combinație cu chimioterapia. În acest curs, ar putea fi dezvăluiți alți factori induși de KD care duc la afectarea proliferării tumorale, în afară de inducerea propusă a scăderii nivelului de glucoză din sânge.
2. Rezultate și discuții
2.1. Design de studiu
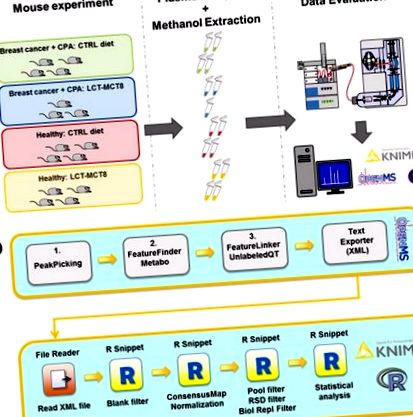
Pentru a investiga efectele KD asupra creșterii tumorale în combinație cu terapia citostatică, au fost analizați metabolomii plasmatici ai unui model de cancer de sân cu xenogrefă umană la șoareci. Deși ar fi interesant să se investigheze metaboliții la nivel local în țesutul tumoral, acesta are limitările sale, deoarece țesutul tumoral este adesea eterogen, iar microenviromentul constând din macrofage asociate tumorii (TAM), fibroblaste asociate tumorii (TAF) și sistemul vascular ar fi contribuie, de asemenea, la date. Astfel, astfel de date s-ar putea să nu reflecte doar modificările celulelor tumorale în sine. Pe de altă parte, utilitatea metabolomicii plasmatice/serice pentru descoperirea biomarkerilor în cercetarea cancerului a fost dovedită numeros [32]. Având în vedere metodologia stabilită în prezent, credem că analiza efectuată a probelor de plasmă reprezintă cea mai bună alegere pentru demonstrarea alterărilor sistemice cauzate de KD adjuvant și poate fi privită astfel ca o dovadă de principiu.
Probele MTX au fost extrase din plasma șoarecilor anesteziați. Toate xenogrefele tumorale purtătoare de animale au primit chimioterapie cu ciclofosfamidă (CPA). Plasma sănătății vs. au fost analizate probe de șoareci purtători de tumori, care au primit fie diete ketogene, fie diete normale. După cum un studiu anterior a arătat că o combinație de trigliceride cu lanț lung (LCT) și trigliceride cu lanț mediu (MCT8) a exercitat cel mai puternic efect asupra inhibării creșterii tumorale [19], am decis să folosim o dietă LCT-MCT8 în experimentele de tratament . Șoarecii sănătoși, care nu au primit nici chimioterapie și nici KD, au servit drept martori negativi (Figura 1 a).
General (A) și fluxul de lucru computațional (b) aplicat pentru studii de metabolomică. CPA - ciclofosfamidă; LCT-MCT8 - dietă trigliceridă cu lanț lung/triglicerid cu lanț mediu. Pentru detalii despre fluxul de lucru de calcul, consultați secțiunea Materiale și metodă.
2.2. Efectele induse de dieta ketogenică la șoarecii purtători de tumori MDA-MB-468
Dieta LCT-MCT8 (raportul dintre grăsimi: carbohidrați + proteine = 8: 1; LCT îmbogățite cu 25% MCT cu 8% carbon; Tabel suplimentar S2) și ciclofosfamidă (CPA) 30 mg/kg/zi tratamente au redus semnificativ volumul tumorii în MDA- Xenogrefele MB-468 purtând șoareci deja după primele 20 de zile de tratament, comparativ cu șoarecii tratați cu CPA și dieta de control (CTRL) (Figura suplimentară S1a). KD a fost bine tolerat, după o ușoară pierdere în greutate inițială, datorită adaptării la gustul și gustul diferit al noilor diete, greutatea corporală a șoarecilor s-a stabilizat și a rămas destul de constantă pe tot parcursul experimentului (Figura suplimentară S1b).
Dieta LCT-MCT8 a crescut semnificativ concentrația corpurilor cetonice din sânge la șoareci deja după cinci zile de tratament (pentru șoareci purtători de cancer de sân a se vedea figura suplimentară S1c; pentru șoareci sănătoși a se vedea figura suplimentară S1d din [42]). În schimb, nivelurile medii de glucoză din sânge nu au prezentat nicio modificare specifică dietei și au rămas în mare parte neschimbate până la terminarea experimentului după 80 de zile (Figura suplimentară S1d).
2.3. Rezultatele analizei metabolizate nedestinate
un cancer de sân; b ciclofosfamidă; c trigliceride cu lanț lung/dietă cu trigliceride cu lanț mediu; d controlul dietei.
2.4. Metaboliți reglați la tratamentul KD
Diagrame circulare (A,b) și parcelele corespunzătoare ale vulcanilor (c,d) care prezintă caracteristici reglementate semnificativ induse de cancerul de sân sub chimioterapie la șoarecii care primesc o dietă de control (A,c) și o dietă ketogenică (KD)b,d), respectiv. Graficele vulcanului arată valoarea log p negativă (modele liniare pentru date microarray (LIMMA) urmate de corecția Benjamini-Hochberg) împotriva raporturilor log2 ale reglementărilor induse de cancerul de sân sub chimioterapie. Punctele albastre reprezintă puncte reglate în jos, punctele roșii reglate în sus și punctele gri caracteristici nereglate cu un prag de semnificație de 0,05 (linia verde). Liniile negre verticale indică raporturi log2 de -0,25 și 0,25. Cercurile verzi indică metaboliții identificați.
- Efectele psihologice ale postului pe termen scurt la femeile sănătoase
- Fapte nutriționale ale lui Wendy's Opțiuni sănătoase ale meniului pentru fiecare dietă
- Factorii de top care contribuie la o recidivă în alimentația sănătoasă a dietei SF Gate
- Cel mai bun plan de dietă sănătoasă pentru pierderea în greutate; 1500 de calorii pe zi
- Profiluri metabolomice plasmatice nedestinate asociate cu dieta generală la femeile din cohortă