Martha Lappas
1 Universitatea din Melbourne, Departamentul de Obstetrică și Ginecologie, Melbourne, Australia
2 Mercy Hospital for Women, Melbourne, Australia
Rattan Lim
1 Universitatea din Melbourne, Departamentul de Obstetrică și Ginecologie, Melbourne, Australia
2 Mercy Hospital for Women, Melbourne, Australia
Sarah Price
3 Universitatea din Melbourne, Departamentul de Medicină (Austin), Melbourne, Australia
4 Departamentul de endocrinologie, Austin Health, Melbourne, Australia
Luke A Prendergast
5 Universitatea La Trobe, Departamentul de Matematică și Statistică, Bundoora, Australia
Joseph Proietto
3 Universitatea din Melbourne, Departamentul de Medicină (Austin), Melbourne, Australia
4 Departamentul de endocrinologie, Austin Health, Melbourne, Australia
Elif I Ekinci
3 Universitatea din Melbourne, Departamentul de Medicină (Austin), Melbourne, Australia
4 Departamentul de endocrinologie, Austin Health, Melbourne, Australia
Priya Sumithran
3 Universitatea din Melbourne, Departamentul de Medicină (Austin), Melbourne, Australia
4 Departamentul de endocrinologie, Austin Health, Melbourne, Australia
Abstract
fundal
Reglarea homeostatică centrală a depozitelor de grăsime este atenuată în timpul sarcinii, pentru a permite depunerea adecvată de grăsime pentru a sprijini dezvoltarea fetală și alăptarea. Ce factori specifici sarcinii facilitează acumularea de grăsime și de ce creșterea în greutate gestațională (GWG) este atât de variabilă, nu sunt clari. Scopul acestui studiu transversal a fost de a examina asocierile dintre GWG și hormoni circulanți cu efecte cunoscute asupra apetitului și creșterii.
Metode
Femeile fără obezitate (indicele de masă corporală, IMC 2), cu o sarcină sănătoasă singleton, au fost recrutate la momentul nașterii prin operație cezariană electivă la un spital obstetric terțiar. Femeile cu prematuri (16 kg; n = 35) în timpul sarcinii. Analiza covarianței a fost efectuată folosind regresia liniară multiplă pentru a testa efectul grupului GWG asupra parametrilor biochimici, luând în considerare IMC înainte de sarcină.
Rezultate
Cei 69 de participanți au avut o vârstă medie de 34,6 ± 4,3 ani și un IMC pre-sarcină de (23,3 ± 1,8 kg/m2), fără diferențe semnificative între grupuri în greutatea pre-sarcină, IMC, vârstă, greutate la naștere sau paritate. GWG mediu a fost de 14,0 ± 1,3 kg în grupul „recomandat” și de 19,6 ± 3,2 kg în grupul „excesiv”. Leptina a fost semnificativ mai mare (43,4 ± 21,6 vs 33,4 ± 15,0 ng/ml, p = 0,03) și prolactina a avut tendința de a fi mai mică (159,5 ± 66,1 față de 194,0 ± 85,6 ng/ml, p = 0,07) la naștere la femeile cu exces recomandat) GWG. Nu s-a constatat că alți factori circulanți diferă între grupuri. Diferența dintre grupuri în leptină a rămas după ajustarea pentru IMC înainte de sarcină în analize de regresie liniară multiplă și regresie cuantilă.
Concluzie
La femeile fără obezitate, leptina rămâne un marker al adipozității în timpul sarcinii. GWG nu a fost asociat cu alți hormoni circulanți cu efecte asupra apetitului și creșterii.
Introducere
În ciuda variațiilor zilnice ale consumului de alimente și ale activității fizice, majoritatea adulților dețin o greutate corporală destul de constantă în timp, deoarece un sistem de feedback între creier și organele periferice (inclusiv țesutul adipos, tractul gastro-intestinal și pancreasul) modulează apetitul și consumul de energie în ordine pentru a menține un nivel stabil de depozite de grăsime.1,2
Creșterea substanțială în greutate și depunerea de grăsime sunt necesare în timpul sarcinii pentru a susține dezvoltarea fetală și pentru a se pregăti pentru cerințele metabolice ale alăptării. Institutul de Medicină (IOM) al Academiei Naționale de Științe din SUA recomandă femeilor cu greutate normală (indicele de masă corporală [IMC] 18,5-24,9 kg/m 2) să câștige între 11,5 și 16 kg în timpul sarcinii. a fătului, a placentei, a lichidului amniotic și a expansiunilor fiziologice în volumul de sânge, apă extravasculară, țesut uterin și mamar4, aceasta permite depunerea a aproximativ 2,5 până la 7 kg de masă grasă.
Apetitul și consumul de alimente tind să crească în al doilea și al treilea trimestru de sarcină5, în ciuda creșterii grăsimii corporale și a leptinei circulante materne (un hormon cheie în homeostazia energetică) 6, sugerând că reglarea obișnuită a depozitelor de grăsime trebuie atenuată sau suspendată. Acest concept este susținut de demonstrarea rezistenței centrale la efectele de reducere a poftei de mâncare ale leptinei, colecistokininei și hormonului de stimulare a α-melanocitului (α-MSH) în timpul sarcinii. în rândul femeilor cu greutate normală anterior (IMC 18,5-24,9 kg/m 2) - creștere cu 40% peste recomandarea OIM de 16 kg în timpul gestației, în principal datorită depunerii crescute de grăsime.3
Ce factori specifici sarcinii facilitează acumularea de grăsime și de ce creșterea în greutate este atât de variabilă, chiar și pentru femeile fără o predispoziție aparentă până la obezitate, nu sunt clare. Este plauzibil ca schimbările profunde care apar în timpul sarcinii în nivelurile circulante ale hormonilor care stimulează apetitul și creșterea somatică să joace un rol. De exemplu, există creșteri marcate ale nivelurilor circulante materne de progesteron și prolactină, ambele demonstrând că stimulează consumul de alimente la șobolani, 9,10 și factorul de creștere asemănător insulinei, hormonul anabolic 1 (IGF-1), care este condus de producția placentară a hormonului de creștere.11 Scopul acestui studiu a fost de a examina asocierile dintre GWG și hormoni circulanți cu efecte cunoscute asupra apetitului și creșterii. Am emis ipoteza că unul sau mai mulți dintre acești hormoni ar diferi între femeile care au crescut 11,5-16 kg față de mai mult de 16 kg (în cadrul recomandărilor OIM sau mai mari pentru GWG la femeile cu greutate normală).
Subiecte, materiale și metode
Participanți și setare
Colectare de probe și teste
Sângele matern a fost colectat după un post de 10-12 ore, cu aproximativ 30 de minute înainte de livrarea prin cezariană programată, într-un tub EDTA sub vid, centrifugat la 1000 g timp de 5 minute, plasma alicotată în tuburi de microfugă de 1 ml și depozitată la -80 ° C până la analiză. Estradiolul și progesteronul au fost măsurate prin imunotest (analizor Roche Cobas e602). Insulina a fost măsurată folosind un kit de la ALPCO (Salem, NH, SUA). Măsurătorile de leptină au fost efectuate folosind kituri Quantikine ELISA (R&D Systems, Minneapolis, SUA). Nivelurile de prolactină, factor de creștere asemănător insulinei 1 (IGF-1) și nivelurile totale de proteină de legare a factorului de creștere asemănător insulinei 3 (IGFBP-3) au fost analizate utilizând teste de margele magnetice cu un singur plex (Millipore, Billerica, MA, SUA). Toate testele au fost efectuate conform instrucțiunilor producătorilor și coeficienții de variație calculați între test și intra-test au fost mai mici de 10%. Raportul molar IGF-1 la IGFBP-3 a fost calculat ca indicator al biodisponibilității IGF-1, utilizând formula: (IGF - 1 (ng/mL) * 0,13/IGFBP-3 (ng/mL) * 0,036) .12
Analize statistice
tabelul 1
Caracteristicile de bază ale participanților
| GWG | 14,0 ± 1,3 | 19,6 ± 3,2 | 2) | 23,2 ± 1,8 | 23,4 ± 1,8 | 0,79 |
| Greutate înainte de sarcină (kg) | 62,1 ± 5,7 | 64,2 ± 6,0 | 0,15 | |||
| Vârsta (ani) | 34,3 ± 4,1 | 34,9 ± 4,6 | 0,54 | |||
| Etnie | 0,38 | |||||
| caucazian | 24 (71%) | 30 (86%) | ||||
| Asia de Sud | 4 (12%) | 3 (9%) | ||||
| Asia de Est/Sud-Est | 5 (15%) | 2 (6%) | ||||
| Necunoscut | 1 (3%) | 0 | ||||
| Paritate | 0,38 | |||||
| 1 | 4 (12%) | 6 (17%) | ||||
| 2 | 24 (71%) | 18 (51%) | ||||
| 3 | 5 (15%) | 10 (29%) | ||||
| 4 | 1 (3%) | 1 (3%) | ||||
| Lungimea gestației (d) | 272 ± 3 | 273 ± 5 | 0,22 | |||
| Greutatea la naștere (g) | 3471 ± 363 | 3565 ± 394 | 0,31 | |||
| Lungime fetală (cm) | 50,7 ± 2,0 | 51,5 ± 2,0 | 0,10 | |||
| Greutatea placentară (g) | 687 ± 128 | 672 ± 116 | 0,64 |
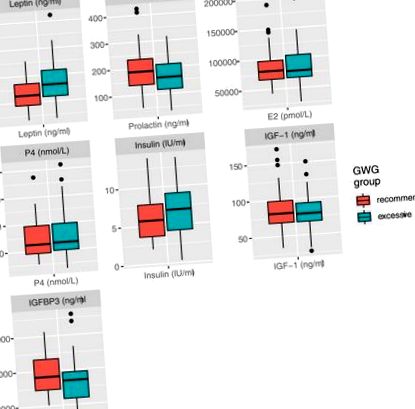
Diferențele în factorii circulanți între grupuri sunt prezentate în (Figura 1). În comparație cu femeile care s-au îngrășat în intervalul recomandat, leptina a fost semnificativ mai mare (43,4 ± 21,6 față de 33,4 ± 15,0 ng/ml, p = 0,03) și prolactina a avut tendința de a fi mai mică (159,5 ± 66,1 față de 194,0 ± 85,6 ng/ml, p = 0,07) la naștere la femeile cu GWG excesiv. Nu s-au detectat diferențe semnificative între grupuri în estradiolul circulant, progesteron, insulină, IGF-1 sau IGFBP-3 (Figura 1).
Diferența factorilor circulanți între femeile cu creștere în greutate gestațională recomandată (n = 34) vs excesivă (n = 35).
Diferența de leptină între grupuri a rămas semnificativă statistic după ajustarea pentru IMC înainte de sarcină în analize de regresie liniară multiplă și regresie cuantilă (Tabelul 2). Analizele care consideră GWG ca o variabilă continuă au găsit, de asemenea, o relație puternică între leptină și GWG (+1,88 ng/ml la 1 kg creștere în GWG, p = 0,001) și nu există relații semnificative între GWG și ceilalți factori circulanți măsurați (Tabelul 3).
masa 2
Diferențe medii și medii estimate în factorii circulanți între femeile cu creștere recomandată (n = 34) V excesivă (n = 35), creștere în greutate gestațională în analize de regresie liniare (medii) și cuantile (mediane), ajustarea pentru IMC înainte de sarcină
| Leptină (ng/ml) | 9.45 | 1,31, 17,58 | 5.59 | 0,68, 10,94 |
| Prolactină (ng/ml) | −34,3 | −71,3, 2,7 | −31.2 | −57,3, 15,4 |
| Estradiol (pmol/L) | −658,7 | −16.349,3, 15,031,9 | −3210.9 | −11.451,9, 11.642,8 |
| Progesteron (nmol/L) | 42.4 | −57,2, 141,9 | 24.8 | −37,9, 123,8 |
| Insulină (UI/ml) | 3,43 | −4,04, 10,89 | 8.43 | 0,02, 17,79 |
| IGF-1 (ng/mL) | −4,43 | −17,17, 8,31 | −4,27 | −14,65, 4,15 |
| IGFBP-3 (ng/mL) | −655,2 | −1586,2, 275,9 | −430,6 | −1530,0, 564,7 |
Tabelul 3
Analize de regresie pentru relația dintre factorii circulanți și GWG ca variabilă continuă, ajustând pentru IMC înainte de sarcină.
| Leptină (ng/ml) | 1,88 | 0,81, 2,95 |
| Prolactină (ng/ml) | −3.11 | −8,28, 2,07 |
| Estradiol (pmol/L) | −983,6 | −3134,3, 1167,0 |
| Progesteron (nmol/L) | −0,48 | −14,29, 13,32 |
| Insulină (UI/ml) | 0,40 | −0,63, 1,44 |
| IGF-1 (ng/mL) | 0,02 | -1,75, 1,78 |
| IGFBP-3 (ng/mL) | −61,1 | −190,6, 68,3 |
Notă: Valorile sunt exprimate ca schimbare a factorului de circulație pentru creșterea cu 1 kg a GWG.
Nu s-au detectat diferențe semnificative în raportul molar dintre IGF-1 și IGFBP-3 între femeile cu GWG excesiv vs recomandat (0,07 ± 0,03 vs 0,06 ± 0,02; p = 0,13). Analizele efectuate după reclasificarea a 12 femei cu IMC 25,1-26,9 kg/m 2 conform recomandărilor OIM pentru GWG la femeile supraponderale (excesiv definit ca> 11,4 kg) nu au modificat semnificativ rezultatele (recomandat n = 28 vs excesiv n = 41, leptină 31,9 ± 14,1 vs 43,0 ± 21,0, p = 0,018, prolactină 204,8 ± 87,1 vs 157,2 ± 64,8, p = 0,012, restul factorilor circulanți nu diferă semnificativ între grupuri).
Discuţie
Deși apetitul și cheltuielile de energie sunt ajustate pentru a menține stabilitatea relativă a greutății în timpul vârstei adulte, controlul homeostaziei greutății corporale pare să fie modificat în timpul sarcinii pentru a se potrivi depunerii de grăsime necesare pentru a sprijini dezvoltarea fetală și lactația. Chiar și în rândul femeilor fără o predispoziție aparentă la obezitate, creșterea excesivă în greutate în timpul sarcinii este frecventă, afectând 40% din femeile cu greutate normală.3 Am emis ipoteza că variabilitatea creșterii în greutate gestațională la femeile fără obezitate ar fi asociată cu hormoni circulanți despre care se știe că afectează apetitul și creșterea, care sunt modificate în timpul sarcinii. Rezultatele noastre nu au susținut acest lucru, arătând doar o relație puternică între GWG și leptina circulantă la naștere. S-a indicat o relație inversă între GWG și prolactină care nu a atins semnificația statistică și nu s-a găsit nicio relație între GWG și progesteron, estradiol, insulină, IGF-1 sau IGFBP-3.
În afara sarcinii, leptina este produsă în principal în țesutul adipos alb proporțional cu masa de grăsime și este transportată peste bariera hematoencefalică, unde inhibă neuronii peptidici orexigenici (AgRP) și neuronii neuropeptidici Y (NPY) și activează pro- neuronii opiomelanocortinei (POMC) din hipotalamus.13 În ciuda creșterii leptinei circulante observată în timpul sarcinii, apetitul matern și consumul de alimente cresc în general, indicând rezistență la efectele sale asupra apetitului. Studiile efectuate la șobolani au demonstrat mai multe mecanisme prin care rezistența la leptină centrală se dezvoltă la jumătatea sarcinii, inclusiv transportul redus prin bariera hematoencefalică14 și afectarea semnalizării hipotalamice. lichid cefalorahidian (LCR) și un raport mai mic de LCR la leptina plasmatică la femeile însărcinate, comparativ cu femeile care nu sunt gravide.16 Un studiu longitudinal recent a raportat o creștere a raportului LCR: leptină periferică după naștere și a indicat faptul că nivelurile periferice de AgRP la sfârșitul sarcinii ar putea prezice modificări de greutate pe termen lung (5 ani)
Limitările majore ale acestui studiu sunt natura sa observațională și transversală. Aceasta înseamnă că nu poate oferi informații despre relațiile dintre GWG și factorii de interes circulanți mai devreme în cursul sarcinii, care ar putea să nu mai fie detectabili în momentul nașterii. Cu toate acestea, studiile longitudinale nu au raportat asocieri consistente între markerii circulanți mai devreme în timpul sarcinii cu GWG ulterior. Într-un raport de 270 de femei caucaziene cu greutate normală, s-a constatat că GWG nu are legătură cu prolactina în săptămânile 16 și 27 de gestație și invers în legătură cu progesteronul în săptămâna 16, dar nu și în săptămâna 27,43, în timp ce un alt studiu realizat pe 226 de femei a găsit o mică asociere între creșteri în greutate și niveluri de progesteron între săptămânile gestaționale 12 și 33,44. Mai mult, acest tip de studiu poate descrie asocierile dintre obiectivele biochimice și GWG, dar nu oferă niciun indiciu de cauzalitate. Analizele noastre au ajustat efectul potențial confuz asupra GWG al IMC înainte de sarcină și au exclus femeile cu naștere prematură (Sumithran P, Prendergast LA, Delbridge E și colab. Persistența pe termen lung a adaptărilor hormonale la pierderea în greutate. N Engl J Med 2011; 365 (17): 1597-1604 doi: 10.1056/NEJMoa1105816 [PubMed] [CrossRef] [Google Scholar]
- Hormonii feminini ar putea stimula creșterea în greutate la bărbații Doctor la ficat
- Top de reducere Câte calorii ar trebui să mănânc pentru a mă îngrăși Magazin - Videografie cu cronometru
- Hormonii te împiedică să piardă în greutate după ce ai avut un copil Salut maternitate
- Întreruperea ciclurilor circadiene legate de creșterea în greutate - Cunoașterea neuronilor
- Pacienții se îngrașă după tiroidectomie pentru cancerul tiroidian tiroidian