Abstract
fundal
Se crede că diabetul accelerează bolile cardiovasculare în funcție de tipul dietei. Acest studiu la subiecți diabetici a fost efectuat pentru a investiga efectele metabolice, inflamatorii și cardiovasculare ale componentelor nutriționale prezente în mod obișnuit într-o dietă occidentală, mediteraneană sau glicemică ridicată.
Metode
45 kg) au fost hrăniți timp de 10 săptămâni suplimentar (40% din energia alimentară) grăsimi saturate/colesterol (SFC), grăsimi nesaturate (UF) sau amidon (S) într-un studiu de intervenție dietetică eucalorică.
Rezultate
Concentrațiile totale de plasmă în jeun, LDL și HDL au fost de 3-5 ori mai mari (p 2 = 0,95). Greutatea depoperitoneală a depozitului de grăsime (g) a fost intermediară în SFC (260 ± 72), cea mai mică în S (135 ± 51) și cea mai mare (p
fundal
Impactul unui exces de grăsimi și carbohidrați dietetici asupra controlului metabolic, inflamației și bolilor cardiovasculare a fost studiat și discutat la subiecți normali și (pre) diabetici, atât la studii umane [1-4], cât și la animale [5-7]. În general, grăsimile saturate dietetice excesive și colesterolul cresc riscul apariției obezității, diabetului și bolilor cardiovasculare [6, 8-10], în timp ce grăsimile nesaturate din dietă sunt considerate mai puțin dăunătoare și nu impun un risc crescut pentru dezvoltarea diabetului și boli cardiovasculare [1, 2, 6]. Carbohidrații dietetici, sub formă de amidon, au o încărcătură glicemică ridicată și astfel agravează glucoza postprandială, stimulează secreția de insulină și lipogeneza de novo [11-14].
Majoritatea studiilor privind efectele pe termen lung (luni) ale componentelor dietetice au fost efectuate la indivizi normali sau cu intoleranță la glucoză, dar sunt disponibile informații limitate în diabetic subiecți cu control metabolic, inflamație, anomalii cardiovasculare și compoziția corpului [2, 12, 13, 15].
Studiile pe termen mai lung la oameni diabetici sunt dificil de realizat, deoarece respectarea dietelor prescrise s-a dovedit a fi extrem de dificilă [16] și deoarece efectele dietetice asupra fiziopatologiei diabetului sunt de obicei mici în ceea ce privește controlul metabolic, sensibilitatea la insulină, inflamația și sistemul cardiovascular. boli [17, 18]. În plus, sunt de obicei necesare studii pe termen lung pentru a dezvălui orice efecte dietetice asupra fiziopatologiei diabetului, deoarece o parte din efectele dietetice sunt cauzate de modificări ale compoziției corpului. Acest lucru poate fi parțial depășit prin studierea modelelor animale care sunt reprezentative pentru situația umană, sunt foarte omogene și sunt păstrate în condiții experimentale strict standardizate.
Am dezvoltat un model de porc pentru diabetul zaharat de tip 2 la om, care se caracterizează prin rezistență la insulină, hiperglicemie, precum și concentrații crescute de trigliceride plasmatice și NEFA. Porcii diabetici sunt necetotici, anabolici și nu necesită terapie cu insulină [19]. Porcii sunt ca omnivorii umani și, ca atare, funcționalitatea tractului gastro-intestinal este comparabilă între porci și om și, prin urmare, porcul este un model animal util pentru studiul componentelor dietetice [20, 21]. Acest lucru face ca porcul să fie deosebit de util atunci când efectul dietelor este studiat asupra dislipidemiei accelerate de diabet și aterosclerozei [22-24]. Mai mult, arterele coronare ale porcilor diabetici s-au dovedit a exprima inflamație de grad scăzut [25], o afecțiune descrisă și la oamenii cu diabet zaharat de tip 2 [13, 26, 27].
Scopul acestui studiu de intervenție dietetică a fost de a caracteriza și compara efectele patogene pe termen mediu/lung (10 săptămâni) ale dietelor eucalorice 1) ambele bogate în grăsimi suplimentare, dar diferind în ceea ce privește compoziția grăsimilor, reflectate în principal de grăsimi saturate și colesterol (SFC ) comparativ cu grăsimile nesaturate (UF) și 2) care diferă în ceea ce privește grăsimile suplimentare (SFC sau UF) față de carbohidrații suplimentari (amidon, S), în ceea ce privește hiperglicemia pre- și postprandială, lipidemia și insulinaemia, sensibilitatea la insulină, tensiunea arterială, markeri inflamatori, greutatea retroperitoneală a grăsimii și depozitele lipidice musculare, hepatice și aortice la porcii diabetici.
Metode
Cercetarea efectuată este în conformitate cu orientările ARRIVE privind cercetarea pe animale [28]. Protocoalele experimentale care descriu managementul, procedurile chirurgicale și îngrijirea animalelor au fost revizuite și aprobate de Comitetul de îngrijire și utilizare a animalelor ASG-Lelystad (Lelystad, Olanda).
Animale, adăpostire, diete și intervenții chirurgicale
Porci domestici (Landrace × Yorkshire, D-line) (vagoane cu o vârstă inițială și o greutate corporală de
30 kg, respectiv) au fost obținute (Bastiaanse, Espel, Olanda) și păstrate în pixuri metabolice special concepute (1,15 × 1,35 m) și adaptate la ciclul lumină/întuneric (luminile aprinse la ora 05:00 și stinsul la ora 19:00 h) și un program de hrănire. Porcii au fost cântăriți săptămânal și mărimea mesei a fost ajustată la greutatea porcului individual. Porcii au fost hrăniți cu cerințe de întreținere de 2,5 ori pentru energia brută (GE), așa cum au fost stabiliți la un porc normal. Acest lucru a corespuns cu un nivel de hrănire de 1045 kJ GE kg -1 BW 0,75 (greutatea metabolică a porcilor) pe zi și este suficient pentru a asigura o creștere moderată la porcii normali [29].
Porcii au fost hrăniți cu o dietă comercială de porci (5% grăsimi brute, 16% proteine brute, 41% amidon și zaharuri, 20% polizaharide fără amidon, 6% cenușă și 12% apă; Startbrok; Agrifirm, Meppel, Olanda) de două ori zilnic (la 06:00 și 16:00). Apa era întotdeauna disponibilă ad libitum. După o săptămână, porcilor li s-a furnizat un cateter permanent de vase de sânge în vena jugulară, așa cum am descris anterior [29, 30]. La o săptămână după operație, 21 de porci au fost tratați cu streptozotocină (140 mg/kg) așa cum s-a descris anterior [19]. La două săptămâni după aceea, 3 porci au prezentat concentrații de glucoză plasmatică la jeun -1 BW 0,75 pe zi) pe o durată de 10 săptămâni. În termeni practici, acest lucru înseamnă că porcii din dieta îmbogățită cu amidon au fost hrăniți de 1,31 ori mai mult decât cantitatea (în funcție de greutate, dar egală în conținut caloric) comparativ cu porcii din dietele îmbogățite în grăsimi, pentru a se potrivi cu aportul de energie al porci printre diete.
Conținutul suplimentar de grăsimi saturate plus colesterol (SFC), grăsimi nesaturate (UF) sau amidon (S) a fost de 40% din energia dietetică totală. SFC a fost derivat din seu de carne de vită (adică.
35% mono-nesaturat și
10% acizi grași poli-nesaturați) plus 1% colesterol, UF a fost derivat din ulei de floarea-soarelui și de rapiță (adică.
25% acizi grași mono-nesaturați și 10% acizi grași saturați) și S a fost derivat din amidon de mazăre, reprezentând componente ale unei diete occidentale, mediteraneene sau, respectiv, glicemice bogate.
Cronologie
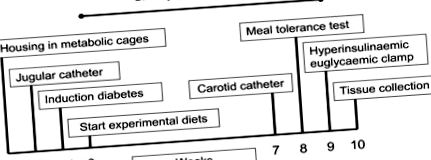
Cronologia studiului este reprezentată schematic în Figura 1. Pe scurt, cele 3 diete au fost hrănite la porci (n = 6 pe grup de dietă) timp de 10 săptămâni cuprinzând următoarele tehnici și măsurători: 1) aport zilnic de alimente, 2) săptămânal greutatea corporală, 3) colectarea cantitativă de urină (pentru determinarea excreției urinare de glucoză 24 de ore) în zilele de luni, miercuri și vineri în timpul tratamentului dietetic, 4) în săptămâna 7, porcilor li s-au furnizat catetere permanente în vena jugulară și carotidă arterială, 5) în săptămâna 8, s-a efectuat un test de toleranță la masă și s-a înregistrat tensiunea arterială intra-arterială, 6) în săptămâna 9, s-a efectuat un studiu hiperinsulinaemic cu clemă euglicemică folosind perfuzie de 6,6-2 H2-glucoză și 7) la săptămâna 10, porcii au fost uciși prin injecție intravenoasă de barbituric (administrat prin cateterul jugular) pentru colectarea țesuturilor.
Cronologia studiului.
Test de toleranță la masă și tensiune arterială
În perioada de recuperare de o săptămână după operație, porcii au fost obișnuiți cu prelevarea de sânge și proceduri experimentale. Cateterul arterei carotide a fost utilizat pentru prelevarea de sânge și înregistrarea tensiunii arteriale. În timpul procedurii de prelevare a sângelui, cateterele au fost spălate cu ser fiziologic și sigilate cu ser fiziologic conținând 5 UI de heparină per ml. Din experiență știm că această procedură de eșantionare nu afectează concentrațiile plasmatice de NEFA.
Sângele a fost prelevat în mod repetat înainte, în timpul și după masa de dimineață (-15, 0, 30, 60, 120, 240, 360 și 480 de minute de la începutul hrănirii). Per punct de timp de prelevare, s-au prelevat aproximativ 5 ml de sânge. Au fost evaluate răspunsurile insulinei, glucozei și trigliceridelor. În plus, nivelurile pre-și post-prandiale de proteină C-reactivă (CRP), haptoglobină, IL-6 și TNF-α au fost determinate pe probe prelevate cu 15 minute înainte și 180 de minute după începerea hrănirii. Ulterior testului de toleranță la masă, tensiunea arterială și ritmul cardiac au fost determinate la cinci ore postprandial pe un electromanometru digital de tip 330 (Hugo Sachs Elektronik KG, March-Hugstetten, Germania).
Clemă euglicemică hiperinsulinemică și perfuzie de 6,6-2 H2-glucoză
Cateterul de venă jugulară a fost utilizat pentru perfuzia de lichide, iar cateterul de artă carotidă a fost utilizat pentru prelevarea de probe de sânge în timpul studiului cu clamp hiperinsulinaemic. Precedând clema de insulină, s-au recoltat probe de sânge în repaus peste noapte pentru a determina concentrațiile de fructozamină, glucagon, cortizol, NEFA, colesterol total, colesterol LDL și HDL și îmbogățirea glucozei de fond.
După eșantioanele inițiale, s-a administrat o perfuzie primară (4,8 mg/kg) continuă (0,08 mg.kg -1 .min -1) de 6,6-2 H2-glucoză timp de 150 min. După un timp de echilibrare, s-au prelevat probe de sânge la 110, 120, 130, 140 și 150 min pentru determinarea glucozei, a îmbogățirii cu 6,6-2 H2-glucoză (pentru a estima producția de glucoză hepatică în repaus alimentar) și a insulinei. Ulterior, insulina a fost perfuzată (primă (34 mU/kg) -continuă (2 mU.kg -1 .min -1)) timp de 6 ore. O perfuzie variabilă a unei soluții de 33% D-glucoză a început să mențină glucoza plasmatică la euglicemie (
5 mmol/L). Calculele la starea de echilibru au fost efectuate în ultimele 40 de minute ale clemei (t = 320, 330, 340, 350 și 360 min) și s-au determinat coeficienții de variație pentru concentrațiile de insulină și glucoză și pentru viteza de perfuzie a glucozei. În ultimele 3 ore ale clemei de insulină, o perfuzie primară (4,8 mg/kg) continuă (0,08 mg.kg -1 .min -1) de 6,6-2 H2-glucoză a fost suprapusă pentru a estima 1) insulină stimulată absorbția de glucoză a întregului corp (rata de dispariție = Rd) și 2) producția de glucoză hepatică inhibată de insulină, așa cum s-a descris mai înainte [19]. În acest scop, au fost prelevate probe de sânge la t 320, 330, 340, 350 și 360 min de clemă.
Infuzate: insulina (Actrapid MC, porcină monocomponentă, Novo, Copenhaga, Danemarca), 6,6-2 H2-glucoză (Cambridge Isotope Laboratories, Inc, MA, SUA) și D-glucoză (Merck, Darmstadt, Germania) au fost preparate ca soluții sterile și trecute printr-un filtru Millipore de 0,22 μm în recipiente sterile înainte de utilizare. Insulina a fost diluată într-o soluție salină conținând plasmă de porc (concentrația plasmatică finală a fost de 3%) pentru a evita lipirea insulinei de recipientele și tuburile de plastic. 6,6-2 H2-glucoză a fost dizolvată într-o soluție salină și D-glucoză a fost dizolvată în apă dest.
Colectare și analize de plasmă, urină și țesuturi
Probele de sânge recoltate în tuburi heparinate (150 USP. U. Lithium Heparin, 10 ml Venoject, Terumo, Leuven, Belgia) sau EDTA (acid etilendiaminetetraacetic, (0,47 mol/L EDTA, 10 ml Venoject, Terumo, Leuven, Belgia) au fost imediat răcite la 0 ° C pe apă cu gheață și centrifugate la 4 ° C timp de 10 minute la 3000 rpm Alicote de plasmă au fost depozitate la -80 ° C pentru analize ulterioare Urina a fost colectată cantitativ la 24 de ore în găleți conținând 0,5 grame d (sodiu- p-toluenesulfonchloramide, Akzo Nobel Chemicals, Amersfoort, Olanda) pentru a preveni descompunerea microbiană a glucozei Probele de urină au fost depozitate la -20 ° C pentru analize ulterioare ale glucozei Mușchiul (m. iliopsoazie) și ficatul au fost înghețate rapid în azot lichid și depozitate la -80 ° C. Aorta abdominală a fost fixată într-o soluție de 4% paraformaldehidă.
Probele de plasmă pentru determinarea îmbogățirii cu 6,6-2 H2-glucoză au fost analizate așa cum s-a descris anterior [19]. Pe scurt, glucoza a fost extrasă din plasmă, derivatizată și injectată într-un sistem de cromatograf de gaze/spectrometru de masă (sistemul GC seria HP 6890 și Detectorul selectiv de masă 5973, Palo Alto, CA, SUA). Separarea a fost realizată pe o coloană capilară DB 17 științifică J&W (30 m × 0,25 mm × 0,25 μm; Agilent Technologies Nederland BV, Amstelveen, Olanda). Îmbogățirea izotopică a fost calculată ca un raport de urmărire-urmărire după scăderea îmbogățirii izotopice a unei probe de plasmă de fond. O alicotă a perfuzatului de 6,6-2 H2-glucoză a fost analizată pentru concentrația izotopului pentru a calcula rata efectivă de perfuzie pentru fiecare experiment de perfuzie.
Glucoza plasmatică a fost analizată cu kitul Glucoza liquiUV mono (Human, Wiesbaden, Germania), acizii grași neesterificați din plasmă au fost analizați cu kitul WAKO (Neuss, Germania) și trigliceridele plasmatice cu un kit de la Human (Wiesbaden, Germania). Concentrațiile totale de colesterol LDL și HDL în plasmă au fost determinate cu seturi de lichid (Human, Wiesbaden, Germania), iar colesterolul VLDL a fost calculat ca colesterol total minus colesterolul LDL și HDL. Concentrația de insulină plasmatică a fost măsurată utilizând un test Delfia (trusa de testare a Perkin Elmer Life Sciences Trust de Wallac Oy, Turku, Finlanda). Această analiză specifică a insulinei porcine a fost validată utilizând standarde de insulină porcină, după cum s-a indicat anterior [30]. Glucagonul plasmatic a fost măsurat cu un kit de la Euro-Diagnostica (Arnhem, Olanda), cortizolul plasmatic cu kitul Count-A-Count Cortisol (DPC, Los Angeles, SUA) și fructozamină printr-un kit de la Spinreact (Sant Esteve De Bas, Spania). Proteina C reactivă plasmatică (CRP), interleukina-6 (IL-6) și factorul de necroză tumorală alfa (TNF-α) au fost analizate cu kituri (CRP-hs, Human, Wiesbaden, Germania; Haptoglobin, Instruchemie, Delfzijl, Olanda; SW Interleukin 6, IBL, Hamburg, Germania și SW TNF-alpha Elisa Kit, Biosource Int, Camarillo, SUA), respectiv.
Cetonele (acid acetoacetic) au fost determinate în urină proaspătă printr-un test de bandă reactivă (Ketostix, Bayer Diagnostics, Mijdrecht, Olanda).
Concentrațiile de trigliceride în probele de mușchi și ficat au fost determinate cu același kit ca cel utilizat pentru probele de plasmă, după saponificare cu o soluție de alcool alcalin așa cum s-a descris anterior [31].
Dungile grase aortice, ca marker al aterosclerozei timpurii [22, 24], (leziunea AHA clasa 2 [32]), au fost cuantificate cu utilizarea petei de grăsime Sudan IV în secțiuni ale aortei abdominale, de la bifurcația arterelor renale la bifurcația arterelor iliace. Aortele colorate au fost apoi fotografiate și analizate cu un sistem de analiză a imaginii la microscopie (Clemex technologies Inc., Quebec, Canada) ca raport dintre suprafața colorată și suprafața totală.
Analize statistice
Rezultatele sunt exprimate ca medii ± SEM și criteriul semnificației statistice a fost stabilit la p
Rezultate
Compozitia corpului
Greutățile corporale finale au fost comparabile în rândul porcilor SFC, UF și S, indicând faptul că aportul mediu de alimente și excreția urinară de glucoză au fost în echilibru în cursul studiului pe grup de dietă (Tabelul 2). Cu toate acestea, greutățile hepatice și concentrațiile de trigliceride au fost mai mari (p Tabelul 2 Aportul alimentar, excreția urinară de glucoză, greutățile corporale finale și datele țesuturilor la porcii diabetici hrăniți cu grăsimi saturate/colesterol sau grăsimi nesaturate sau diete îmbogățite cu amidon
Controlul metabolismului
La sfârșitul intervenției dietetice, concentrațiile plasmatice de insulină, glucagon, glucoză, fructozamină și trigliceride în jeun au fost similare la toți porcii diabetici (tabelele 3 și 4). Concentrațiile plasmatice de colesterol total la jeun, HDL, LDL și VLDL au fost mai mari (p Tabelul 3 Producția de glucoză hepatică la jeun, absorbția de glucoză a întregului organism stimulată de insulină, producția de glucoză hepatică inhibată de insulină și concentrațiile plasmatice de metaboliți și insulină la porcii diabetici hrăniți cu grăsimi saturate diete bogate în colesterol sau grăsimi nesaturate sau amidon
Curbele postprandiale (0-8 ore) ale glucozei plasmatice (A), trigliceridelor (B) și insulinei (C) sunt prezentate la porcii diabetici care au fost hrăniți cu diete suplimentate cu amidon (cercuri deschise), grăsimi nesaturate (pătrate negre) sau grăsimi saturate cu colesterol (cercuri negre).
Inflamaţie
Concentrațiile plasmatice de cortizol, haptoglobină, IL-6 și TNF-α în jeun nu au fost statistic diferite între grupurile de dietă (Tabelul 4). În schimb, atât concentrațiile plasmatice de proteine C reactive (CRP), cât și cele postprandiale, precum și răspunsurile CRP induse de masă (() au fost mai mari (p Figura 4
Ateroscleroza și tensiunea arterială
Suprafața dungi grase aortice a fost mai mare (p 2 = 0,95, p Figura 5
Imagini cu exemple tipice de aortă abdominală Sudan IV colorarea grăsimii la porcii diabetici, care au fost hrăniți cu diete suplimentate cu amidon (imaginea de sus), grăsimi nesaturate (mijloc) sau grăsimi saturate cu colesterol (jos). Colorarea intra-luminală roșie indică prezența dungi grase. Inserarea în imaginea de jos prezintă detalii histologice (colorare hematoxilină-eozină) a dungii grase (mărire 4 ×). Zona intimă a acestei părți a peretelui vasului constă din mai multe straturi celulare cu spații mici goale în care s-a depus grăsime.
Discuţie
Principalele descoperiri
În ceea ce privește compoziția corpului, porcii SFC au prezentat depozite crescute de grăsime musculară, hepatică și aortă și o cantitate redusă de grăsime retroperitoneală. Ultimul depozit non-ectopic de țesut adipos a fost cel mai mare la porcii UF, indicând faptul că compoziția corpului este cel mai favorabil afectată de dieta UF comparativ cu dieta SFC în acest model de porc diabetic non-obez. Dieta UF este stocată în principal în țesutul adipos și într-o măsură mai mică în organe și sistemul vascular. În schimb, porcii S au prezentat cele mai mici depozite de grăsime musculară și hepatică și o cantitate scăzută de grăsime retroperitoneală. Acest lucru indică faptul că stocarea energiei sub formă de grăsime este scăzută din S din dietă, atât în țesutul adipos, cât și în cel non-adipos. Markerii inițiali ai inflamației sistemice au avut tendința de a fi mai mari la porcii SFC, dar numai concentrațiile inițiale și postprandiale de CRP au atins niveluri de semnificație statistică. S-a observat o corelație puternică între PCR plasmatică postprandială și zona striului de grăsime aortică (R 2 = 0,95, p
Concluzie
Atunci când se compară SFC dietetic, UF și S, SFC dietetic induce ateroscleroza precoce asociată cu CRP și depunerea de grăsimi ectopice în timp ce UF izoenergetic prezintă efecte benefice asupra glicemiei postprandiale, a inflamației și a compoziției corpului la porcii diabetici.
- Deficitul de proteine dietetice influențează leucemia limfocitară granulară mare la șobolanii F344 -
- Fructoza alimentară induce endotoxemie și leziuni hepatice la primatele controlate caloric - PubMed
- Efecte diferite ale lipsei de proteine dietetice asupra producției de celule care formează rozetă în
- Recomandările actuale ale proteinelor dietetice trebuie actualizate, spun specialiștii
- Efectele modelelor de dezvoltare pe termen lung ale adipozității asupra nivelurilor de proteine C-reactive și