S. V. Hartimath
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
R. Boominathan
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
V. Soh
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
P. Cheng
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
X. Deng
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
Y. C. Chong
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
F. F. Yong
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
P. W. Tan
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
W. Han
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
E. G. Robins
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
2 Centrul de cercetare a imagisticii clinice (A ∗ STAR - NUS), Școala de Medicină Yong Loo Lin, Universitatea Națională din Singapore, Singapore 117599, Singapore
J. L. Goggi
1 Singapore Bioimaging Consortium, Agenția pentru Tehnologie și Cercetare Științifică (A ∗ STAR), 11 Biopolis Way, # 01-02 Helios, Singapore 138667, Singapore
Date asociate
Seturile de date utilizate și/sau analizate în timpul studiului actual sunt disponibile de la autorul corespunzător, la o cerere rezonabilă.
Abstract
Scop
Fibroza hepatică este semnul distinctiv al steatohepatitei cronice nealcoolice (NASH) și se caracterizează prin depunerea excesivă a proteinelor matricei extracelulare. Detectarea precoce și stadializarea precisă a fibrozei hepatice este extrem de importantă pentru gestionarea pacientului. Unul dintre primii markeri patologici din NASH este activarea celulelor stelate hepatice (HSC) care pot fi exploatate ca marker al fibrogenezei. Factorii care secretă HSC activați, cum ar fi integrina αvβ3, propagă fibroza. Scopul studiului actual a fost de a evalua utilitatea agentului de integrare a imaginii αvβ3 [18 F] FtRGD pentru detectarea precoce a fibrozei într-un model de NASH indus de dietă folosind longitudinal imagistica PET.
Proceduri
Șoarecii au fost hrăniți fie cu dieta standard chow (SD), cu o dietă bogată în grăsimi (HFD), fie cu o dietă fibrogenică bogată în grăsimi (CDAHFD) cu deficiență de colină, pentru a imita patologia clinică a bolilor hepatice și au urmat longitudinal timp de 10 săptămâni pentru a evalua dezvoltarea fibrozei hepatice utilizând imagistica [18 F] FtRGD cu tomografie cu emisie de pozitroni (PET). Biochimia standard a sângelui, măsurile histologice și qPCR au fost utilizate pentru cuantificarea integrinei αvβ3, a actinei musculare netede și a colagenului tipurile 1 și 6 pentru a evalua gradul de patologie NASH și pentru a stabili cu precizie fibroza hepatică.
Rezultate
Dieta fibrogenică CDAHFD a dezvoltat în mod previzibil inflamație hepatică și steatoză în decurs de 10 săptămâni studiate cu o patologie mică a NASH detectată la animalele tratate cu dietă bogată în grăsimi. Fibroza de stadiul 1 a fost detectată devreme de histologie în ziua 21 și a progresat în stadiul 2 până în ziua 35 și stadiul 3 până în ziua 56 la șoarecii hrăniți numai cu dietă CDAHFD. Imagistica neinvazivă cu [18 F] FtRGD s-a corelat bine cu integrina αvβ3 și a reușit să distingă fibroza timpurie ușoară a stadiului 2 la animalele CDAHFD comparativ cu animalele standard hrănite cu dietă chow în ziua 35. Comparativ cu animalele hrănite cu diete bogate în grăsimi, [18 F] FtRGD a reușit să distingă fibroza moderată ulterioară în stadiul 2 la animalele CDAHFD în ziua 49.
Concluzii
Progresia indusă de dietă a fibrozei hepatice a fost confirmată utilizând histologie și corelată bine cu ARNm de integrină αvβ3 și expresia proteinei matricei extracelulare. [18 F] FtRGD a arătat o corelație foarte bună între absorbția ficatului și expresia integrinei αvβ3 și o sensibilitate de detecție similară cu modalitățile actuale standard de aur clinice pentru stadializarea fibrozei hepatice.
1. Introducere
Lianții integrin αvβ3 (125R și 99m Tc-marcat cRGD) au fost utilizați anterior pentru a detecta fibroza hepatică la modelele animale induse chimic [5-11]. Cu toate acestea, modelele de NASH induse chimic dezvoltă fibroza foarte rapid și nu recapitulează progresia clinică a bolii. În plus, aceste modele afectează grav hepatocitele, parenchimul hepatic și celulele Kupffer în câteva zile. În patologia NASH, inflamația apare mult mai încet și HSC-urile sunt activate într-un stadiu foarte timpuriu al fibrozei. În studiul de față, am investigat relația dintre absorbția hepatică a [18 F] FtRGD, o sondă selectivă integrină αvβ3 și dezvoltarea fibrozei utilizând imagistica PET într-un model NASH indus de dietă, metionina scăzută, cu deficit de colină dietă bogată în grăsimi (CDAHFD). Dieta CDAHFD reproduce mai fidel patologia clinică de la parenchimul rănit la steatoză și NASH, unde stresul hepatic cauzat de fluxul de acizi grași din țesutul adipos în ficat, precum și stocarea crescută a trigliceridelor duce la fibroză și disfuncție hepatică [12-14].
2. Materiale și metode
2.1. Intervenția animalelor și a dietei
Șoarecii masculi C57/BL6 au fost cumpărați de la InVivos (Singapore). Șoarecii C57/BL6 au fost aleși ca tulpină de rozătoare, deoarece s-a demonstrat că dezvoltă patologie hepatică cu dieta aleasă. Șoarecii au fost hrăniți fie cu dieta standard chow (n = 5), cu o dietă bogată în grăsimi (HFD), cu o dietă purificată de rozătoare cu 60% energie din grăsimi (HFD: 58Y1, n = 5), fie cu o dietă fibrogenică bogată în grăsimi (definită AA dietă bogată în grăsimi fără colină și 0,1% metionină; CDAHFD cu 60% energie din grăsimi; 9 GKW au fost cumpărate de la Test Diet, Richmond Indiana, SUA, (n = 5) timp de zece săptămâni.
2.2. Analize biochimice și evaluare histopatologică
Toate animalele au fost monitorizate și greutatea corporală a fost măsurată de două ori pe săptămână. Sângele a fost colectat din plexul orbital și plasma a fost separată (200 μL) pentru analiza trigliceridelor (TG) (ab65336, Abcam). Animalele au fost sacrificate, iar ficatul a fost colectat la 21, 28, 42, 56 și 70 de zile de tratament cu CDAHFD și HFD. Ficatul a fost cântărit și o porțiune a fost înghețată rapid pentru analiza hidroxiprolinei (ab222941, Abcam) sau cuantificarea ARNm. Restul țesuturilor hepatice au fost fixate în formalină tamponată neutră 10% pentru examenul histologic.
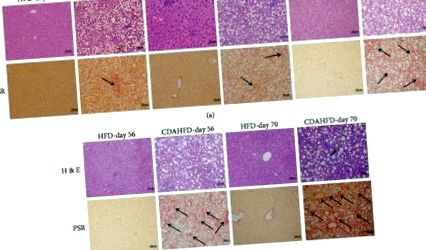
Țesuturile fixate pe formalină au fost secționate (4 μm) și colorate cu Picro Sirius Red (PSR) sau hematoxilin-eozină (H&E). Probele de ficat au fost evaluate microscopic pentru prezența celulelor inflamatorii, balonare hepatocelulară, modificări ale grăsimii (steatoză), fibroză și alte leziuni conform practicii de clasificare descrise anterior [12]. Clasificarea patologică pentru diferitele etape ale fibrozei se bazează pe severitate și se clasifică după cum urmează: pentru infiltrarea celulelor inflamatorii, gradul 0: niciuna; gradul 1: 1-2 focare; gradul 2: 3-4 sigilii; și gradul 3: mai mult de 4 focare observate la 200x. Pentru balonare hepatocelulară și degenerare, gradul 0: niciunul; gradul 1: câteva celule cu balon; și gradul 2: celule/balonare proeminentă. Pentru modificări grase (steatoză), gradul 0, absența steatozei; gradul 1, 70% din hepatocite afectate. Pentru fibroza hepatică (pe baza colorării PSR), etapa 0: niciuna; stadiul 1: ușor, perisinusoidal sau periportal; stadiul 2: moderat, perisinusoidal și periportal; etapa 3: fibroza de punte; iar stadiul 4: ciroza.
2.3. Prepararea [18 F] FtRGD
Toate substanțele chimice și solvenții obținuți comercial au fost de calitate analitică și s-au utilizat direct fără purificare ulterioară. [18 F] FtRGD a fost preparat ca o reacție cu două poturi așa cum s-a descris anterior [15] pe baza unei metode modificate de Bejot și colab. [16]. Pe scurt, fluorura azeotropică uscată [18 F] a reacționat cu 2-azidoetil-4-toluenesulfonat (2 μL) în acetonitril uscat (0,5 mL) pentru a da 2- [18 F] fluoretil azidă ([18 F] FEA) [17] ]. Conjugarea 2- [18 F] fluoroetil azidei cu peptida c (RGDyK) funcționalizată cu alchină prin cicloadițiile dipolare Huisgen 1, -3 catalizate cu Cu (I). După reacție, [18 F] FtRGD a fost purificat utilizând HPLC semipreparativă urmat de extracție cu cartuș ușor C18 în fază solidă și reformulat în soluție salină tamponată cu fosfat (pH = 7,4). Trasorul a fost sterilizat prin trecerea printr-un filtru Millex GV de 0,22 μm înainte de utilizare la animale. Puritatea radiochimică a fost> 98%.
2.4. Imagistica PET
Toate animalele (n = 5 per grup) au fost realizate cu imagini longitudinale de la 3 la 10 săptămâni după inițierea regimului alimentar. Animalele au fost injectate cu o soluție de [18 F] FtRGD (~ 10 MBq în 0,2 ml) prin vena laterală a cozii. După 60 de minute după injectare, animalele au fost realizate cu ajutorul unui Siemens Inveon PET-CT (Siemens, Germania) cu o statică de 10 minute urmată de un protocol standard de scanare CT așa cum s-a descris anterior [16]. Datele PET au fost achiziționate în modul listă, iar imaginile au fost generate din datele sinogramei, urmate de reconstrucție și corecție de atenuare a maximizării așteptării subsetului (OSEM-3D) tridimensional ordonat folosind CT. Imaginile PET și CT au fost înregistrate pentru a confirma locația anatomică și absorbția radiofarmaceutică a fost determinată prin trasarea unei regiuni de interes (ROI) peste ficatul delimitat folosind imaginile CT. Concentrațiile țesuturilor au fost măsurate utilizând analiza ROI în software-ul Amide (Sourceforge 10.3, http://amide.sourceforge.net), iar absorbția trasorului este prezentată ca o modificare procentuală a absorbției ficatului.
2.5. Analiza imunohistochimică
Probele de ficat au fost congelate rapid în azot lichid și secționate folosind un criotom (felii de 5 μm) pentru examinări imunohistochimice. Secțiunile au fost înmuiate în metanol conținând 0,3% H2O2 timp de 30 de minute la temperatura camerei pentru a fixa și a bloca activitatea endogenă a peroxidazei și apoi s-au spălat cu PBS. După blocarea cu ser de capră/H2O2, țesuturile au fost incubate cu anticorp primar la temperatura camerei timp de 30 de minute (antialfa policlonală de iepure SMA Abcam, ab15734; la diluarea 1: 200). Secțiunile au fost apoi procesate pentru anticorp secundar conjugat cu HRP conform protocolului producătorului polimer (30 mL) Antirabbit Poly-HRP-IgG (75%).
2.6. Analiza expresiei genelor prin qPCR
Țesutul hepatic a fost înghețat și prelucrat pentru extracția ARN-ului hepatic și analiza ulterioară a qPCR așa cum s-a descris anterior [18]. TRIzol (Thermo Fisher Scientific) a extras ARN total și ADNc a fost amplificat folosind primerii indicați prin 40 de cicluri de PCR. Nivelul de expresie a ARNm al integrinei αVβ3, colagen de tip 1 și 6 alfa 1 a fost cuantificat prin qPCR. Metoda 2 −ΔΔCT a fost utilizată pentru a estima expresia relativă a ARNm și s-a normalizat la 18S mARN (ca genă de menaj). Secvențele primerilor folosiți pentru qPCR sunt după cum urmează: Col1a1: 5'-GCTCCTCTTAGGGGCCACT-3 'și 5'-CCACGTCTCACCATTGGGG-3'. Col6a1: 5′-CTGCTGCTACAAGCCTGCT-3 ′ și 5′-CCCCATAAGGTTTCAGCCTCA-3 ′. Integrină αVβ3: 5'-CCGTGGACTTCTTCGAGCC-3 'și 5'-CTGTTGAATCAAACTCAATGGGC-3'. 18S: 5′-CGTGATTAGCGATGATGAACCAGG-3 ′ și 5′-CATCTCGAGCAA-GTCTTTCAGTCC-3 ′.
2.7. Analize statistice
Ficatele CDAHFD sau HFD au fost evaluate microscopic pentru prezența histologică a inflamației hepatocelulare, modificări ale grăsimii (steatoză), balonare și fibroză. Șoarecii hrăniți cu CDAHFD au arătat o progresie clară a NASH din ziua 21 cu modificări de grăsime micro și macrovesiculare observate din ziua 21 care au progresat constant până în ziua 70. Balonarea hepatică de gradul 1 a fost observată din ziua 21 până la 56 și balonul de gradul 2 din ziua 56 până sfârșitul studiului. Aceste modificări au fost însoțite de focare inflamatorii de gradul 1 din ziua 21 și gradul 2 din ziua 35 încoace. Fibroza a fost detectată devreme la animalele CDAHFD cu stadiul 1 în ziua 21 progresând în stadiul 2 până în ziua 35 și gradul 3 din ziua 56 în continuare. În schimb, șoarecii hrăniți cu HFD au dezvoltat unele steatoze și focare inflamatorii în momentele ulterioare, dar nu au dezvoltat fibroză pe parcursul studiului (Figura 1).
Histopatologia hepatică a șoarecilor hrăniți cu CDAHFD sau HFD din ziua 21 până în ziua 70: (a) colorare H&E și (b) colorare Picro Sirius Red (PSR). Toate imaginile reprezentate la 200x.
- Comparație cap la cap a azotatului anorganic și a metforminei într-un model de șoarece de cardiometabolism
- Pierderea de ACE2 exagerează rezistența la insulină indusă de dietă bogată în calorii prin reducerea GLUT4 la șoareci
- Efect independent al capacității aerobe ridicate de a proteja împotriva rezistenței la insulină indusă de dietă în
- Beneficiile pentru sănătate ale uleiului de semințe de bujor din arborele dietetic într-un hamster funcțional cu dietă bogată în grăsimi
- Influencer acuzat de fatfobie pentru că a chemat un model; dezgustător; Insider