Peter Fickert
De la Departamentele de Medicină * și Patologie, † Universitatea Karl-Franzens, Graz, Austria
Michael Trauner
De la Departamentele de Medicină * și Patologie, † Universitatea Karl-Franzens, Graz, Austria
Andrea Fuchsbichler
De la Departamentele de Medicină * și Patologie, † Universitatea Karl-Franzens, Graz, Austria
Conny Stumptner
De la Departamentele de Medicină * și Patologie, † Universitatea Karl-Franzens, Graz, Austria
Kurt Zatloukal
De la Departamentele de Medicină * și Patologie, † Universitatea Karl-Franzens, Graz, Austria
Helmut Denk
De la Departamentele de Medicină * și Patologie, † Universitatea Karl-Franzens, Graz, Austria
Abstract
Recent am demonstrat că hrănirea obstructivă a colestazei sau acidului colic (CA) duce la supraexprimarea CK însoțită de fosforilare anormală în ficatul șoarecelui; Cu toate acestea, relația de cauzalitate dintre colestază cu reținerea acizilor biliari potențial toxici și formarea MB a rămas neclară. Acest studiu a fost conceput pentru a clarifica dacă colestaza și acizii biliari reprezintă singuri factori cauzali în formarea MB. Prin urmare, am evaluat influența colestazei obstructive prin ligarea comună a căilor biliare (CBDL) și hrănirea CA (pentru a imita retenția unui acid principal biliar primar) asupra formării citoscheletului IF și MB într-un model de șoarece experimental bine definit (adică, medicamentul -ficat de șoarece amorsat). 2,4,18-21 Se raportează dovezi că colestaza și acizii biliari joacă un rol central în formarea MB.
Materiale și metode
Animale
Șoarecii masculi albini elvețieni (tulpina Him OF1 SPF) au fost obținuți de la Institutul de Cercetare Animală de Laborator, Facultatea de Medicină a Universității din Viena, Himberg, Austria, găzduită cu un ciclu lumină-întuneric de 12:12 ore și a permis consumul ad libitum de apă și o dietă standard pentru șoareci (Marek, Viena, Austria). Experimentele au fost efectuate cu șoareci de 2 luni cu greutatea de 25 până la 30 g. Experimentele au fost aprobate de comitetul local de etică și au urmat criteriile prezentate în Ghidul pentru îngrijirea și utilizarea animalelor de laborator pregătit de Academia Națională de Științe a Statelor Unite, publicat de Institutul Național de Sănătate (publicația NIH 86-23, revizuit 1985). CA și DDC au fost obținute de la Aldrich (Steinheim, Germania).
Intoxicarea DDC
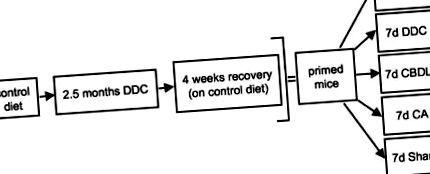
Șoarecii au fost hrăniți cu o dietă care conțin 0,1% DDC timp de 2,5 luni pentru a induce MB. 2,4 După această perioadă de timp, un grup de animale a fost sacrificat pentru a evalua modificările cito-scheletice induse de DDC, inclusiv formarea MB, în timp ce un alt grup a fost sacrificat la 4 săptămâni după întreruperea alimentării cu DDC pentru a studia reversibilitatea acestor modificări, așa cum a fost descris anterior. 4 În plus, șoarecii amorsați recuperați au primit o dietă conținând 0,1% DDC timp de 7 zile sau supuși hranei cu CBDL sau CA (a se vedea Figura 1 ▶ pentru proiectarea experimentală).
Proiectare experimentală pentru a studia rolul colestazei și al acizilor biliari în formarea MB la șoarecii pregătiți de medicamente. Șoarecii au fost hrăniți cu o dietă de control sau cu 0,1% dietă suplimentată cu DDC timp de 2,5 luni pentru a induce MB. Un grup de animale a fost sacrificat pentru a studia modificările cito-scheletice induse de DDC (inclusiv formarea MB), în timp ce un alt grup a fost sacrificat la 4 săptămâni după întreruperea alimentării cu DDC (recuperare) pentru a evalua reversibilitatea acestor modificări. În plus, șoarecii recuperați (amorsați) au primit dietă de control (Co) sau au fost supuși alimentării cu DDC (DDC), hrănirii cu CBDL, CA și, respectiv, operației simulate timp de 7 zile, respectiv. Cinci animale au fost studiate în fiecare grup.
Toate procedurile chirurgicale au fost efectuate în condiții sterile. Pentru a studia efectele colestazei obstructive asupra expresiei CK și a formării MB la șoareci pregătiți de medicament, conducta biliară comună a fost ligată aproape de hilul hepatic imediat sub bifurcație și disecată între ligaturi așa cum s-a descris anterior. 23 În plus, colecistectomia a fost efectuată după ligarea canalului chistic. Controalele au suferit o operație falsă cu expunere, dar fără ligarea căii biliare comune și îndepărtarea vezicii biliare. Ficatele au fost excizate sub anestezie generală (10 mg Avertin i.p.) la 7 zile după operație. Probele de țesut hepatic au fost înghețate în azot lichid pentru analize moleculare și microscopie de imunofluorescență sau fixate în soluție de formaldehidă tamponată neutră 4% pentru microscopie ușoară și imunohistochimie. Probele de ser de la fiecare șoarece au fost depozitate la -70 ° C pentru analiza aspartatului aminotransferazei/alaninei aminotransferazei, a fosfatazei alcaline și a nivelurilor totale de acid biliar.
Hrănirea cu acid biliar
Pentru a studia efectele acizilor biliari asupra expresiei CK și formării MB, șoarecii pregătiți de medicamente au fost hrăniți cu o dietă suplimentată cu CA (1%) timp de 7 zile. 22.24 Ficatele și serurile au fost prelucrate așa cum s-a descris mai sus.
Determinarea numerelor de copiere a ARNm
Numerele de copii ale ARNm pentru CK 8, CK 18 și gliceraldehidă-3-fosfat dehidrogenază au fost determinate prin reacție în lanț competitivă cu transcriptază inversă-polimerază. 10
Western Bloting pentru CK 8 și CK 18
Nivelurile de proteine CK 8 și CK 18 au fost determinate prin analiza Western blot. 4.22
Microscopie de imunofluorescență
Microscopia de imunofluorescență a fost efectuată pe secțiuni hepatice înghețate (3-μm grosime, fixate în acetonă la -20 ° C timp de 10 minute) folosind anticorpul monoclonal MM120-1 recunoscând în mod specific MBs și anticorpul policlonal CK 50K160 de iepure împotriva CK 8 și CK 18 ca descris anterior. 4,22,25 În plus, fosforilarea CK 8 a fost evaluată cu anticorpul 5B3 împotriva unui epitop hiperfosforilat al CK 8. 4,26 Imunomarcare dublă a fost efectuată combinând anticorpii monoclonali MM120-1 sau 5B3 cu anticorpul policlonal 50K160. Ca anticorpi secundari, s-au folosit IgG capră anti-șoarece conjugată cu Cy2 (Amsersham, Buckinghamshire, Marea Britanie) și Ig anti-iepure porcine conjugate cu tetrametilrhodamină isotiocianat (DAKO, Glostrup, Danemarca). Pentru control, anticorpii primari au fost permiși sau înlocuiți cu imunoglobuline potrivite cu izotip (DAKO). Probele imunofluorescente au fost analizate cu un dispozitiv confocal de scanare laser MRC 600 (Bio-Rad, Richmond, CA) atașat la un microscop Zeiss Axiophot. Imaginile fluorescente au fost colectate folosind tubul fotomultiplicator confocal la cadru complet 768 × 512 pixeli).
Histologie
Ficatele șoarecilor au fost fixate în soluție de formaldehidă tamponată neutră 4% și încorporate în parafină. Secțiunile de 4 μm grosime au fost colorate cu hematoxilină și eozină.
Imunohistochimie
Imunohistochimia a fost efectuată folosind un anticorp împotriva ubiquitinei (diluare 1: 200; DAKO). Secțiuni de parafină (4 μm grosime) de țesut fixat pe formaldehidă au fost deparafinizate, rehidratate și digerate cu 0,1% protează (tip XXIV; Sigma, St. Louis, MO). Legarea anticorpului ubiquitin a fost detectată utilizând sistemul ABC (DAKO) așa cum s-a descris anterior. 8
Biochimie serică de rutină și măsurători ale acidului biliar
Nivelurile serice de alanină aminotransferază, aspartat aminotransferază și fosfatază alcalină au fost determinate prin teste de rutină pe un analizor Hitachi 717 (Boehringer Mannheim, Mannheim, Germania) ca măsuri ale toxicității hepatice a diferitelor regimuri de tratament și gradul de colestază. Nivelurile totale de acid biliar seric au fost determinate printr-o analiză 3α-hidroxisteroid dehidrogenază disponibilă comercial (Merck, Darmstadt, Germania). Testele au fost efectuate în duplicat.
Analize statistice
Valorile sunt medii ± SEM. AST, aspartat aminotransferază (U/L); ALT, alanin aminotransferază (U/L); AP, fosfatază alcalină (U/L); BA, acizi biliari (μmol/L).
* P ▶ ▶ ▶. Interesant este faptul că extinderea infarctelor biliare a fost mult mai puțin pronunțată la șoarecii CBDL pregătiți de medicamente decât la șoarecii naivi CBDL (localizați predominant în zonele acinare 1 și 2; neprezentat). 22.27 CBDL a avut ca rezultat o creștere semnificativă a nivelurilor de ARNm CK 8 și CK 18 în comparație cu șoarecii recuperați pregătiți de medicamente și șoarecii naivi cu control naiv (Figura 2A) ▶ însoțită de o creștere a expresiei proteinei CK (Figura 2B) ▶. Similar cu realimentarea DDC, creșterea relativă a CK 8 a depășit-o pe cea a CK 18 la șoarecii preparați de droguri CBDL (Figura 2B) (. Operația Sham nu a avut nicio influență asupra expresiei ARNm și proteinei CK 8 și CK 18, precum și asupra formării MB (nu este prezentată).
Hrănirea cu CA induce supraexpresia CK și formarea MB în ficatul șoarecelui preparat cu medicamente
Pentru a discrimina în continuare între efectele mecanice (de exemplu, creșterea presiunii canaliculare) și toxice (de exemplu, toxicitatea indusă de acidul biliar din cauza concentrațiilor crescute de acid biliar) ale colestazei în ceea ce privește formarea MB, șoarecii pregătiți de medicamente au fost hrăniți cu o dietă suplimentată cu potențial toxic CA, care reprezintă un acid biliar major în boala hepatică colestatică umană. 22,24,28,29 În conformitate cu studiile noastre anterioare la șoareci naivi hrăniți cu CA, hrănirea cu 22,24 CA a crescut semnificativ nivelurile de transaminaze serice, fosfatază alcalină și acizi biliari serici la șoareci pregătiți pentru medicamente (Tabelul 1) ▶ . Hrănirea CA a șoarecilor pregătiți de medicament a fost asociată cu mărirea hepatocitelor, necroze hepatocelulare diseminate, mitoze, dilatarea căilor biliare interlobulare și edem periductal (nu este prezentat) Mai mult decât atât, acest tratament a crescut semnificativ nivelurile de ARNm și proteine CK 8 și CK 18 în comparație cu șoarecii recuperați preparați cu medicamente și șoarecii hrăniți cu dietă naivi (Figura 2, A și B) (. Creșterea nivelurilor de proteine CK 8 a depășit-o pe cea a CK 18; cu toate acestea, diferența a fost mai puțin pronunțată decât la șoarecii refugiați cu DDC și șoarecii preparați cu CBDL (Figura 2B) (. Hrănirea cu CA a indus formarea MB într-o măsură similară cu cea observată la șoarecii CBDL pregătiți de medicamente (Figurile 2F, 3D și 4D) .
Hrănirea cu CBDL și CA induce fosforilarea anormală și ubiquitinarea CK-urilor în ficatul șoarecelui cu medicament
Discuţie
MB sunt incluziuni citoplasmatice hepatocelulare caracteristice și caracteristici morfologice ale unei varietăți de boli hepatice cronice, inclusiv steatohepatita alcoolică și nealcoolică, precum și colestaza cronică. 2,3 Ele pot servi, de asemenea, ca obiecte de studiu pentru a obține informații despre principiile generale ale leziunii celulare asociate cu corpurile de incluziune (de exemplu, diverse boli de agregare a proteinelor). 2,3,30,34,35 Scopul acestui studiu a fost de a determina modul în care colestaza și acizii biliari potențial toxici declanșează formarea MB în ficatul de șoarece cu tratament medicamentos. S-a demonstrat că atât colestaza obstructivă, cât și hrănirea cu CA duc în câteva zile la supraexprimare, fosforilare anormală și ubiquitinarea CK și, în cele din urmă, la formarea MB în ficatul de șoarece primat de medicamente. Aceste descoperiri oferă dovezi pentru un rol cheie al acizilor biliari potențial toxici pentru formarea MB în tulburările hepatice colestatice.
CK-IF-urile au fost considerate mult timp structuri destul de statice responsabile în primul rând de stabilitatea mecanică a celulelor. 1 Totuși, devine din ce în ce mai clar că proteinele CK-IF sunt angajate în funcții celulare suplimentare (de exemplu, apărarea împotriva stresului toxic și modularea căilor apoptotice). 10,26,36-40 Importanța CK-urilor pentru menținerea integrității funcționale a hepatocitelor a fost demonstrată în mai multe modele de șoareci knockout genetici. 2,10,40 Mai mult, mutațiile CK, precum și modificările posttranslaționale ale CK pot juca, de asemenea, un rol în patogeneza bolilor hepatice umane, deoarece mutațiile genei CK 8 la pacienții cu ciroză criptogenă și fosforilarea CK anormală pronunțată observată în steatohepatita alcoolică umană au fost demonstrate recent. 8,41,42 Pe baza acestor constatări, se poate specula că creșterea expresiei hepatice a CK cu fosforilare anormală, omniprezentare și formarea MB rezultată reprezintă un răspuns de apărare necunoscut până acum al celulei hepatice la leziuni toxice (de exemplu, oxidant toxic indus de acidul biliar stres).
Rezultatele studiului actual sugerează că acizii biliari potențial toxici duc la formarea MB prin inducerea supraexprimării dezechilibrate, fosforilării anormale și poliubiquitinării și degradării scăzute a CK-urilor în ficatul de șoarece cu tratament medicamentos. Va fi interesant să vedem dacă aceste descoperiri obținute în modele animale sunt relevante și pentru bolile hepatice colestatice umane. Stresul oxidativ poate fi ultimul principiu comun în diferite tipuri de tulburări de agregare a proteinelor, inclusiv boli hepatice colestatice. 49-51
Mulțumiri
Mulțumim Dr. Bishr M. Omary (Departamentul de Medicină, Centrul Medical Palo Alto VA și Universitatea Stanford, Stanford, CA) pentru furnizarea de anticorpi împotriva epitopilor CK hiperfosforilați, Dr. W. Erwa (Graz) și colegii pentru efectuarea testelor funcției hepatice, și Dr. R. Aigner (Graz) și colegii săi pentru măsurarea nivelurilor serice de acid biliar.
Note de subsol
Adresa solicitări de reimprimare către Helmut Denk, MD, FRCPath, Departamentul de Patologie, Universitatea Karl-Franzens, Auenbruggerplatz 25, A-8036 Graz, Austria. E-mail: .ta.ca.zarginufk @ kned.tumleh
Sprijinit de Fundația științifică austriacă (acordă S 7401-MOB către KZ și P-15502 către MT), Fondul jubiliar al Băncii Naționale austriece (acordă 7171 și 8522 către MT) și de Premiul Joseph Skoda de la Societatea austriacă din Medicină internă (la MT).
- 10 alimente care îți detoxifiază corpul și îți curăță ficatul
- Anne Hathaway; Dieta aproape-vegană a făcut ca corpul ei de pisică să fie posibil
- Grăsimea din burtă promovează diabetul sub comanda ficatului
- 5 obiceiuri sănătoase care îți epuizează corpul de minerale
- Cele mai bune 10 alimente uscate pentru câini pentru boli hepatice din 2020