Conținutul care urmează este substanța prelegerii de chimie generală 21. În această prelegere acoperim definițiile energiei și procesul de calorimetrie.
Energie
Din păcate, pentru a avea o discuție despre subiectele care urmează, există o mulțime de definiții care trebuie discutate mai întâi, așa că aveți grijă de mine.
În primul rând, trebuie să definim această secțiune de studiu în chimie. Termodinamica sau mai specific Termochimie este studiul absorbției sau eliberării căldurii care însoțește reacțiile chimice.
Energia este definită ca fiind capacitatea de a lucra și, în chimie, o definim Energie ca suma atât a muncii (w) efectuate, cât și a căldurii (q) generate sau pierdute.
E = w + q
Energia se încadrează și în două tipuri generale:
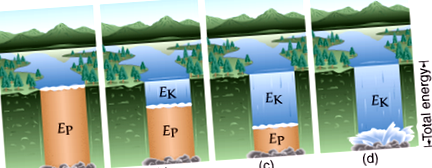
(1) Energia cinetică (EK) sau energia mișcării: 1/2 mv 2 unde m este masă și v este viteză
(2) Energie potențială (EP): energia stocată în legături chimice care este eliberată atunci când o legătură este ruptă sau formată.
În imaginea de mai jos, pe măsură ce apa începe să curgă, energia se schimbă de la potențial la cinetic:
În orice caz, energia măsurată este exprimată în general în una din cele două unități: Calorii (cal) sau Jouli (J) Un Joule este definit ca 1 kg. m 2/s 2. O calorie este cantitatea de căldură necesară pentru a crește 1 mol de apă cu 1 grad Celsius și un 4,184 J = 1 cal.
Legea conservării energiei
La fel cum Legea conservării masei a stabilit scena pentru calculele stoichiometrice, Legea conservării energiei stabilește scena pentru calculele termodinamice.
Legea prevede că Energia nu poate fi nici creată, nici distrusă și, prin urmare, este cunoscută sub numele de Prima Lege a Termodinamicilor. Aceasta înseamnă că Energia totală a universului este constantă și pot fi măsurate doar modificările tipului de energie.
În chimie, acest lucru înseamnă adesea că energia potențială găsită în legăturile chimice este convertită în energie termică, care la rândul său este apoi transformată în energie cinetică pe măsură ce molecula răspunde la creșterea temperaturii etc. Sau așa cum se arată mai jos, formarea unei legături transformă energia chimică în energie termică și lumină. Caracteristica importantă a procesului este că cantitatea de energie rămâne constantă.
Iată câteva definiții pentru dvs.:
1) Temperatura - în termodinamică aceasta este definită ca o măsură a energiei cinetice derivată din mișcarea moleculară. Un fel de definiție care a apărut pentru prima dată, de pui sau ou, deoarece la temperaturi mai ridicate moleculele au o energie cinetică mai mare, dar acolo o ai.
2) Energia termică sau căldura (q) - este determinată ca energia cinetică transferată de la un obiect la altul ca urmare a unei diferențe de temperatură între ele. Deci, trebuie să măsurăm diferența de temperatură dintre două obiecte/substanțe pentru a determina căldura.
3) Energia chimică - așa cum se arată mai sus, aceasta este energia potențială găsită în legăturile chimice.
Calculele energiei
În acest moment există doar câteva tipuri de calcule ale energiei pe care le putem face din energie din muncă și căldură.
Care este energia unui sistem care face 100 J de lucru și absoarbe 250 J de căldură?
Pentru a calcula acest lucru, trebuie să cunoașteți convențiile semnelor:
În termodinamică (la fel ca în viață) munca are un semn negativ și lucrul la sistem este pozitiv. În același mod, pierderea căldurii primește un semn negativ, iar absorbția căldurii este pozitivă. Deci, pentru problema de mai sus, este într-adevăr doar un proces de interpretare a lecturii, deoarece matematica implicată este doar adunarea sau scăderea:
Sistemul funcționează, astfel încât 100 J ar trebui să fie negativ și să absoarbă căldura, astfel încât 250J să fie pozitiv:
E = -100J + 250J = 150 J
iar celălalt tip de calcul este pentru energia cinetică:
EC = 1/2 mv 2
Iată un exemplu simplu:
Dacă un backbacker poate alerga 40 de metri în 4,15 secunde și cântărește 195 lbs câtă energie cinetică are?
Mai întâi amintiți-vă unitățile unui Joule: 1 kg. m 2/s 2
Trebuie să convertim lbs în kg: 195 lbs x 1 kg/2,2 lb = 88,6 kg
Atunci este doar plug and chug:
EK = BЅ (88,6 kg) (40m/4,15s) 2 = B 4,12 kJ
Și acum înapoi la definiții.
Sistem și împrejurimi
După cum am învățat mai devreme, energia pierdută și câștigată trebuie să fie echivalentă cu orice proces, dar nu am definit unde vom pierde sau vom câștiga această energie, așa că vom face asta acum.
Sistemul - este definit ca procesul, reacția sau obiectul studiat.
Împrejurimiles - este orice altceva.
De exemplu, într-o reacție a unui acid și a unei baze apoase, sistemul ar fi reacția în sine între moleculele de acid și bază și împrejurimile ar fi apa și recipientul în care se află.
Oficial există trei tipuri de sisteme:
Deschis - Poate face schimb de căldură și materie cu împrejurimile
Închis - Poate schimba căldura, dar nu contează cu împrejurimile
Izolat - Nu se poate schimba căldura sau materia cu împrejurimile
În acest moment vreau să vă reamintesc din nou prima lege a termodinamicii: energia nu este nici creată, nici distrusă. Un alt mod de a afirma acest lucru este că schimbarea netă a energiei dintre un sistem și împrejurimile sale trebuie să fie zero. ΔE = ESystem + ESÎnconjurător = 0. Pentru ca acest lucru să fie adevărat, atunci Energia sistemului trebuie să fie echivalentă cu energia din împrejurimi, dar opusă în semn.
ESystem = -ESurroundings sau -ESystem = ESurroundings
Și la fel ca înainte, atunci când sistemul pierde energie, îi dăm un semn negativ și când câștigă energie este un punct pozitiv.
Când apare o reacție chimică într-un recipient deschis, cea mai mare parte a energiei câștigate sau pierdute este sub formă de căldură. Aproape nu se lucrează (adică nu se mișcă nimic). Căldura (q) este definită ca un transfer de energie între un sistem și împrejurimile sale. Căldura curge între sistem și împrejurimile sale până când cele două sunt la aceeași temperatură. Când apare o reacție chimică în care sistemul absoarbe căldura, se spune că este procesul endotermic (se simte frig). Când apare o reacție chimică în care sistemul produce căldură, este exoterm (se simte cald).
Determinarea căldurii - calorimetrie
Calorimetria este un proces prin care se măsoară schimbarea de temperatură a unui sistem.
Există două tipuri de bază de calorimetrie - presiunea constantă și volumul constant.
Un calorimetru de presiune constantă este adesea numit calorimetru de ceașcă de cafea, deoarece seamănă și este adesea construit dintr-o ceașcă de cafea în experimentele de laborator.
QSys-ul prezentat aici este căldura totală pentru întregul calorimetru care conține apa și calorimetrul din împrejurimi așa cum l-am definit anterior și qRxn l-am definit ca sistemul anterior. La fel ca mai sus, unde am afirmat că energia totală trebuia să fie egală cu zero, la fel face și qSys-ul prezentat aici. Aceasta înseamnă că rearanjarea ecuației de mai sus setează q-ul din împrejurimi egal în mărime, dar opus în semn la fel ca înainte.
Calculul q depinde nu numai de modificarea temperaturii, ci și de capacitatea și cantitatea sa de căldură specifice.
Capacitate specifică de căldură (c)
Căldura specifică (c) a unei substanțe este cantitatea de căldură (q) necesară pentru a crește temperatura unui gram din substanță cu un grad Celsius.
Această ecuație pentru căldură înseamnă doar că, cu cât aveți mai multă substanță, cu atât mai multă căldură o poate absorbi sau elibera, astfel că căldura este considerată o proprietate extinsă. Și ia în considerare, de asemenea, că diferite tipuri de materiale absorb/eliberează căldura în mod diferit. Oricine a gătit vreodată cu folie de aluminiu sau o tigaie din fontă înțelege această diferență. Folia pe care o puteți atinge cu un pericol minim, deoarece este rece aproape imediat după scoaterea de pe căldură, dar o tavă de fier va rămâne periculoasă la atingere pentru o lungă perioadă de timp. Acest lucru se datorează capacităților lor de căldură diferite (a se vedea tabelul de mai sus).
Revenind la calorimetrie, celălalt tip de calorimetru este un volum constant sau calorimetru „bombă”. Partea „bombă” provine din faptul că, din moment ce volumul este constant, presiunea din interiorul calorimetrului poate fi destul de mare. Dacă nu este urmărit cu atenție, acest lucru poate duce la rezultate dezastruoase.
Ecuațiile pentru calcularea căldurii sunt practic identice cu cele ale calorimetrului cu presiune constantă. Marea diferență dintre cele două este că, în timp ce în calorimetrul cu ceașcă de cafea reacția are loc în apă ca parte a soluției apoase, reacția într-un calorimetru bombă se află într-un compartiment separat.
- Caracterizarea moleculară și clinică a infecției cu Giardia duodenalis la copiii preșcolari din
- Hidrogen molecular pentru înfrumusețarea pielii MISTER Susan Smith Jones, dr
- Formulele de control al greutății Royal Canin sunt în
- Noua tehnică dezvoltată pentru a separa amestecurile moleculare complexe
- Şofran; Kebaburi de iepure de curcuma