Abstract
Glucozinolații sunt un grup de glicozide care conțin sulf care se găsesc în multe specii de plante, inclusiv legume crucifere, cum ar fi broccoli, varză, varză de Bruxelles și conopidă. Acumularea de dovezi susține din ce în ce mai mult efectele benefice ale glucozinolaților dietetici asupra sănătății generale, inclusiv ca potențiali agenți anticanceroși, datorită rolului lor în prevenirea inițierii carcinogenezei prin inducerea enzimelor detoxifiante/antioxidante de apărare celulară și a mecanismelor lor epigenetice, inclusiv modificarea metilarea CpG a genelor legate de cancer, reglarea modificării histonei și modificări în expresia microARN-urilor (miARN-uri). În acest context, mecanismul de apărare mediat de stresul anti-oxidant Nrf2 și căile de semnalizare antiinflamatoare poate contribui la protecția celulară împotriva stresului oxidativ și a metaboliților reactivi ai agenților cancerigeni. În această revizuire, rezumăm rolul chimiopreventiv al cancerului derivaților glucozinolatici naturali ca inhibitori ai carcinogenezei, cu accent deosebit pe ținte moleculare specifice și modificări epigenetice in vitro și in vivo pe modele animale de cancer uman.
Introducere
Chimioprevenția cancerului este o strategie majoră de prevenire a cancerului care utilizează fitochimicale dietetice naturale sau medicamente terapeutice cu toxicitate relativ scăzută pentru a inhiba transformarea malignă a celulelor inițiate în etapele de promovare sau progresie [1, 2]. Astfel, chimioprevenția poate implica prevenirea cancerigenilor de a ajunge la siturile țintă, de a fi supuși activării metabolice sau de a interacționa ulterior cu macromoleculele celulare cruciale (de exemplu, ADN, ARN și proteine) în stadiul de inițiere [3, 4]. Interesant este faptul că prevenirea și/sau protecția împotriva agenților cancerigeni chimici prin fitochimicale prezente în legumele crucifere care conțin glucozinolat este de mare interes deoarece acestea pot oferi o strategie sigură și rentabilă pentru combaterea cancerului [5, 6 ••]. În acest context, numeroase studii epidemiologice și farmacologice au arătat că consumul de legume crucifere are un potențial substanțial pentru chimioprevenția cancerului uman [7].
Biosinteza și metabolizarea glucozinolaților
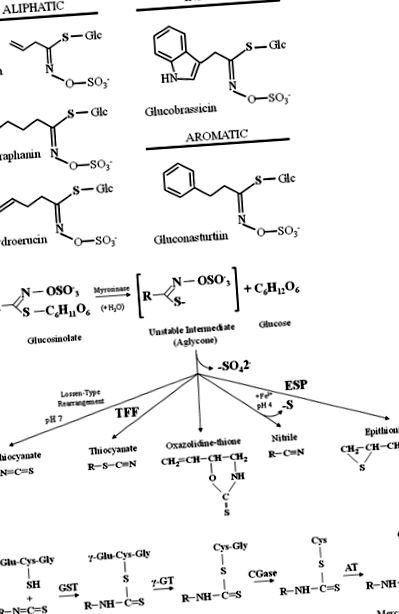
A Exemple de glucozinolați alifatici, indolici și aromatici găsiți în legumele Brassicaceae. b Modelul general de hidroliză a glucozinolatului prin mirozinază și proteinele specificatoare indicate ca TFP (tiocianat-formând proteine) și ESP (proteina epitiospecificatoare). c Metabolizarea izotiocianaților prin calea acidului mercapturic. Izotiocianații sunt conjugați cu glutation de glutation S-transferuri (GST-uri) și scindate succesiv de γ-glutamiltranspeptidaza (γ-GT), cisteinilglicinaza (CGase), și N-acetiltransferaza (LA) a crea N-conjugate de acetilcisteină (acizi mercapturici)
Mai multe studii epidemiologice și farmacologice au demonstrat că glucozinolații dietetici și produsele lor de descompunere, izotiocianații, pot reduce riscul de carcinogeneză și anumite boli umane [14]. Izotiocianații din legumele dietetice cercetate în prezent pentru utilizare ca agenți chimiopreventivi includ SFN din broccoli, conopidă și varză, PEITC din năsturel, ridiche și nap, izotiocianat de alil (AITC) din varză, muștar și hrean, izotiocianat de benzii (BITC) din lepidiu, 3-metilsulfinilpropil (iberină) din broccoli, varză de Bruxelles și varză, 4-metiltiobutil din rucola și 3-metiltiopropil din varză [13]. În mod similar, indolul I3C, care la expunerea la acidul gastric suferă autocondensare pentru a forma DIM, este prezent și în legumele crucifere, inclusiv broccoli, varză, conopidă, varză de Bruxelles, verzi și varză și este utilizat ca agent chemopreventiv [23 ].
După ingestie, izotiocianații sunt absorbiți din tractul gastrointestinal prin difuzie pasivă în rețeaua de sânge capilară, legându-se reversibil de tiolii proteinelor plasmatice libere (tiocarbamoilarea proteinelor) și traversând membrana plasmatică în celulele țesuturilor [20]. Astfel, izotiocianații sunt metabolizați de calea acidului mercapturic și inițial conjugați cu glutation cu glutation. S-transferazele (GST) și scindate succesiv de γ-glutamiltranspeptidaza (γ-GT), cisteinilglicinaza (CGaza) și N-acetiltransferază (AT), creând N-conjugați de acetilcisteină (acizi mercapturici), care sunt transportați în rinichi și secretați activ în urină pentru eliminarea din corp [14] (Fig. 1c).
Derivați ai glucozinolatului dietetic și modularea enzimelor de biotransformare de faza I și faza II
Efecte chimiopreventive ale derivaților naturali ai glucozinolatului dietetic în cancerele induse de stresul antioxidant mediat de Nrf2 și căile de semnalizare antiinflamatoare
Derivați ai glucozinolatului dietetic și modularea inflamației
Factorul nuclear-kappa-B (NF-κB) este un factor de transcripție și o legătură moleculară cheie între inflamație și cancer care reglează mai multe gene ale căror produse inhibă apoptoza și sporesc progresia ciclului celular, angiogeneza și metastaza [52, 59]. În plus, un număr considerabil de gene țintă NF-κB codifică mediatori ai răspunsului imun înnăscut și al inflamației, care includ citokine, chemokine, proteaze, NOS2 și COX2 [52, 60]. În acest context, s-a arătat că derivații glucozinolatici din dietă inhibă procesele mediate de NF-κB in vitro și in vivo, jucând un rol important deoarece NF-κB este implicat în exprimarea a peste 500 de gene implicate în bolile umane, inclusiv cancerul [15]., 61]. Astfel, derivații de glucozinolat sunt capabili să inhibe căile reglementate de NF-κB declanșate de acești activatori prin blocarea semnalelor pro-inflamatorii la diferite niveluri; cu toate acestea, mecanismele moleculare prin care se exercită aceste interacțiuni sunt complexe și slab înțelese [15, 61].
Au fost cercetate mai multe ținte celulare ale derivaților glucozinolat pentru modularea căii de semnalizare NF-κB. De exemplu, SFN este capabil să suprime cascada de semnalizare TLR4 prin afectarea efectorilor din aval MyD88, p38 proteină kinază activată cu mitogen (MAPK) și JNK prin interacțiunea cu glutationul sau alți regulatori redox, cum ar fi tioredoxina sau Ref-1, care sunt indirect capabil să afecteze capacitatea de legare a ADN-ului NF-κB și legarea directă a grupurilor esențiale de tiol de p50, afectând legarea ADN-ului NF-κB cu implicarea potențială a reglării Akt [15, 62, 63]. În plus, DIM, PEITC și SFN au fost descrise pentru a reprima fosforilarea IKK/IkB și translocația nucleară p65 NF-κB, inhibând activitatea transcripțională a NF-κB și afectând mediatori importanți, precum IL-6, iNOS, TNF-α și COX-2 [15, 64, 65]. În mod similar, PEITC este, de asemenea, capabil să scadă nivelurile de expresie a proteinelor iNOS și COX-2, ducând la exprimarea redusă a ambilor mediatori proinflamatori și, de asemenea, a fost raportat că suprimă fosforilarea factorului de reglare a interferonului 3 (IRF3) indusă de stimularea receptorul de tip Toll care scade activarea interferonilor de tip I (IFN) și a genelor inductibile de IFN [13, 66].
Derivați ai glucozinolatului dietetic și mecanisme epigenetice care modifică speciile de cancerigenă, inflamație și oxigen reactiv
Reglarea epigenetică cuprinde modificări ale ADN-ului fără modificări ale secvenței care duc la modificări ale expresiei genice sau ale fenotipului [31]. Recent, o cantitate mare de dovezi a demonstrat că modificările epigenetice, cum ar fi metilarea ADN-ului, modificările histonelor și miARN-urile necodificate, contribuie în mod constant la carcinogeneză, iar constituenții din dietă, inclusiv derivații glucozinolatici ai dietei, au potențialul de a modifica un număr dintre aceste evenimente epigenetice [15, 18, 26]. Deși majoritatea cercetărilor privind efectele celulare ale derivaților glucozinolatului din dietă s-au concentrat în primul rând pe efectele enzimei detoxifiante, dovezile în creștere au demonstrat efectele chemopreventive ale derivaților glucozinolatului dietetici asupra reglării genelor tăcute în cancer.
Interesant este că Wong și colab. a descris efectele genomului SFN și DIM asupra metilării promotorului în celulele epiteliale normale de prostată și celulele canceroase de prostată [11 ••]. În consecință, atât SFN cât și tratamentul DIM au scăzut expresia DNMT-urilor în celulele epiteliale normale de prostată (PrEC) și celulele cancerului de prostată dependente de androgen (LnCAP) și androgen-independent (PC3). Mai exact, SFN și DIM au modificat metilarea promotorului în diferite seturi de gene din celulele epiteliale normale de prostată și celulele cancerului de prostată; cu toate acestea, au împărtășit ținte genetice similare într-o singură linie celulară, inversând multe dintre modificările metilării asociate cancerului, inclusiv genele metilate aberant care sunt neregulate în timpul progresiei cancerului (de exemplu, migrarea celulelor, adeziunea celulară, semnalizarea celulelor celulare și reglarea transcripțională ).
Modificările histonice au fost recunoscute pe scară largă ca factori declanșatori importanți ai silențierii genelor prin modificări post-translaționale ale histonelor la cozile amino-terminale [26]. De exemplu, starea deschisă a cromatinei și activarea genei sunt mediate de histone acetiltransferazele (HAT), care transferă grupări acetil în grupa ε-amino a reziduurilor de lizină din cozile histonice, în timp ce starea de cromatină condensată și silențierea genei respective sunt de regulă reglementate de Enzime HDAC, care îndepărtează grupările histonacetil prin catalizarea transferului acestora în coenzima A (CoA) [26, 103]. În mod similar, metilarea histonică a reziduurilor de lizină și arginină mediată de histona metiltransferaze (HMT) și demetilaze (HDM) a fost, de asemenea, descrisă ca un mecanism care activează sau reprimă expresia genelor în diferite forme de cancer [15, 104]. De exemplu, metilarea H3K4, H3K36 și H3K79 a fost asociată cu cromatina activă transcripțională, în timp ce metilarea H3K9, H3K27 și H4K20 a fost asociată cu cromatina reprimată transcripțional, constituind două dintre mecanismele importante de reducere a zgomotului în celulele mamiferelor [26, 105 ].
Aceste rezultate au fost observate și în alte celule imortalizate derivate din piele și în liniile celulare transformate. În schimb, s-a raportat că DIM scade semnificativ expresia proteinei HDAC2, dar nu și expresia proteinei HDAC1, HDAC3, HDAC4, HDAC6 sau HDAC8 în liniile celulare de cancer de prostată PC-3 insensibile la androgen și LNCaP sensibile la androgeni [106]. Interesant, același studiu a observat că tratamentul I3C inhibă ușor activitatea HDAC în celulele LNCaP fără inhibare HDAC în celulele PC-3. În mod similar, s-a demonstrat că DIM suprimă expresia proteinelor HDAC2 și HDAC3 în celulele TRAMP-C1, cu o creștere concomitentă a apoptozei, scăderea proliferării celulare și îmbunătățirea exprimării genei Nrf2 și Nrf2 NQO1 în țesuturile prostatei [83]. DIM poate induce selectiv degradarea mediată de proteazom a histonei deacetilaze de clasa I (HDAC1, HDAC2, HDAC3 și HDAC8) fără a afecta proteinele HDAC de clasa II din celulele cancerului de colon uman in vitro și in vivo în xenogrefele tumorale [94]. Astfel, epuizarea HDAC a fost asociată cu inducerea deteriorării ADN-ului, care a declanșat apoptoza.
Derivați de glucozinolat dietetic: studii in vivo
Glucosinolații naturali și produsele lor de descompunere au fost utilizate pe scară largă ca agenți chimiopreventivi în studii in vivo, incluzând modele de cancer la rozătoare induse chimic și dezvoltarea cancerului determinată de oncogene la șoareci transgenici [110]. Studiile cheie care documentează chimioprevenția cancerului de către glucozinolați în modelele de șoarece transgenic și cancer de rozătoare induse chimic sunt rezumate în Tabelul 2. De exemplu, am arătat că aplicarea topică a SFN reduce incidența tumorilor cutanate induse de DMBA/TPA în Nrf2 (+/+ ) șoareci de tip sălbatic (Nrf2 WT), dar nu la șoareci Nrf2 KO tratați cu sulforaphane, demonstrând că efectele chemopreventive ale SFN în tumorile cutanate induse de DMBA/TPA sunt mediate de Nrf2 [44]. În mod similar, inhibiția tumorigenezei pielii a fost observată, de asemenea, utilizând SFN în cancerul de piele indus chimic la șoarecii CD-1 în timpul etapei de promovare [111]. În contrast, am raportat, de asemenea, că tratamentele SFN la șoarecii ApcMin/+ conduc la reglarea diferitelor seturi de gene implicate în apoptoză, creșterea/menținerea celulelor și inflamația în polipii intestinului subțire, după cum s-a evidențiat prin analiza profilului de expresie genică utilizând microarrays Affymetrix [112] ].
Deși au existat cercetări ample privind fitochimicalele dietetice care contribuie la înțelegerea generală a derivaților glucozinolatici în ceea ce privește funcțiile lor chimice și biologice și efectele benefice asupra sănătății umane, studiile clinice ale participanților umani asupra efectelor biologice ale glucosinolatului din dietă lipsesc și se limitează la determinarea efectele legumelor crucifere crude sau ale extractelor acestora sub unii parametri biologici [110, 124]. De exemplu, au fost descrise efectele inhibitoare ale creșterului asupra metabolismului oxidativ al 4- (metilnitrosamino) -1- (3-piridil) -1-butanonei în celulele sanguine periferice ale participanților [125]. În mod similar, un studiu randomizat și controlat cu placebo utilizând o băutură infuzată cu varză de broccoli a prezentat o asociere inversă între excreția de ditiocarbamați și aductul urinar aflatoxin-ADN [126]. În mod similar, consumul de germeni de broccoli a scăzut activitatea histonei deacetilază în celulele mononucleare din sângele periferic la subiecții umani [88].
Până în prezent, 31 de studii clinice au fost înregistrate folosind SFN (www.clinicaltrials.gov; accesat la 22 octombrie 2014). Dintre aceste studii, zece au fost finalizate și au raportat date de la pacienții tratați cu cancer de prostată și sân, boli cardiovasculare, boli imune și autism. În mod similar, PEITC, care a avut mai puține studii înregistrate, cuprinde unul dintre cele patru studii finalizate pentru prevenirea cancerului pulmonar la persoanele care fumează. Patru studii de șapte înregistrate pentru 3IC tratamente au fost finalizate pentru pacienții cu cancer de prostată și de sân și un studiu specific privind prevenirea cancerului la participanții sănătoși. În cele din urmă, au fost finalizate patru studii de zece înregistrate pentru DIM la pacienții tratați cu cancer de prostată și de col uterin, precum și studii specifice de prevenire a cancerului la participanți sănătoși. În rezumat, aceste descoperiri sugerează că derivații glucozinolatici din dietă ar putea fi folosiți pe scară largă în alte studii prospective epidemiologice și chemopreventive.
Concluzii și perspective de viitor
- Acidificarea alimentară îmbunătățește digestibilitatea fosforului, dar scade expresia H K-ATPazei în
- Caracteristici și intervenții privind aderarea la dietă - ScienceDirect
- Ajustări dietetice și terapie nutrițională în timpul tratamentului pentru disfagia orală-faringiană
- Arginina dietetică stimulează imunitatea umorală și mediată celular la puii vaccinați și
- Aportul de antioxidanți dietetici în vârsta școlară și dezvoltarea funcției pulmonare până la adolescență în Europa