Abstract
fundal
Rezistența la leptină este considerată un factor primar de risc pentru obezitate. S-a emis ipoteza că proteinele din cerealele din dietă ar putea provoca rezistența la leptină prin împiedicarea legării leptinei de receptorul său. Proteina din grâu dietetică nedegradată a fost găsită în serul uman la un nivel mediu de 41 ng/ml. Aici, raportăm concluziile noastre de la testarea dacă glutenul digerat enzimatic din grâu împiedică legarea leptinei de receptorul leptinei in vitro.
Glutenul din grâu a fost digerat cu pepsină și tripsină în condiții fiziologice. Activitatea de pepsină și tripsină a fost îndepărtată din digestia de gluten cu un filtru de rotire de 10 kDa sau prin tratament termic la 100 ° C timp de 30 de minute. Legarea la receptorul de leptină al leptinei amestecat cu digestia glutenului la o serie de concentrații a fost măsurată folosind tehnologia de rezonanță a plasmonului de suprafață.
Rezultate
Legarea digestiei glutenului la receptorul leptinei nu a fost detectată. Digestia de gluten filtrată prin rotire a inhibat legarea leptinei de receptorul de leptină, cu o inhibare de 50% la o concentrație de digestie a glutenului de
10 ng/ml. Digestia cu gluten tratată termic nu a inhibat legarea leptinei.
Concluzii
Glutenul de grâu digerat inhibă legarea leptinei de receptorul leptinei, cu inhibare la jumătate maximă la 10 ng/ml. Inhibarea este semnificativă la concentrații relevante din punct de vedere clinic și, prin urmare, ar putea servi ca o cale nouă de investigare pentru a înțelege baza moleculară a rezistenței la leptină, a obezității și a tulburărilor asociate.
fundal
Leptina este o polipeptidă de 16 kDa secretată de țesutul adipos alb în circulație, după cum a fost revizuită recent de Zhou și colab. [1]. Nivelurile de leptină în circulație sunt proporționale cu masa de grăsime corporală și fluctuează în conformitate cu modificările stărilor nutriționale. Concentrația de leptină servește ca un semnal cheie de adipozitate pentru creier, unde leptina se leagă și activează receptorul de leptină. Leptina este importantă în reglarea sațietății, a greutății și a homeostaziei energetice. Majoritatea pacienților obezi au niveluri ridicate de leptină circulantă, indicând o stare dobândită de rezistență la leptină, definită de capacitatea redusă a leptinei de a suprima pofta de mâncare și creșterea în greutate [2]. Rezistența la leptină este considerată un factor de risc primar pentru patogeneza supraponderalității și a obezității [2], care la rândul său este strâns asociată cu diferite tulburări metabolice, inclusiv dislipidemie, boli cardiovasculare, accident vascular cerebral, rezistență la insulină și diabet de tip 2. Au fost propuse mai multe mecanisme pentru a explica rezistența la leptină, inclusiv transportul afectat al leptinei, semnalizarea leptinei și circuitele neuronale orientate către leptină [2].
În acest studiu, am testat ultima propoziție a ipotezei de mai sus, care este că proteinele din cereale din boabe inhibă legarea leptinei. Proteinele din cereale din cereale s-au raportat deja că se leagă de un receptor de către Lammers și colab., care au descoperit că peptidele din cereale derivate din digestia enzimatică a gliadinei de grâu cu enzimele intestinale pepsină și tripsină în condiții fiziologice se leagă de receptorul de chemokină CXCR3 exprimat în epitelii și laminee proprii intestinale de șoarece și uman, ducând la eliberarea zonulinelor și la permeabilitatea intestinală crescută [11 ]. Kamikubo și colab. a raportat că aglutinina germenilor de grâu se leagă de receptorul leptinei in vitro și inhibă legarea leptinei de receptorul leptinei [12]. Aglutinina din germeni de grâu se găsește în făina de grâu comun, dar nu și în sângele uman [13]. Am ales să examinăm proteinele din cereale din grâu, care este principala sursă de proteine vegetale din alimentele umane. Principala componentă proteică a grâului este glutenul, care este masa coezivă și elastică care rămâne după ce amidonul a fost îndepărtat din făina de cereale prin clătire cu apă. Mai precis, glutenul din grâu este un compozit din mai multe tipuri de proteine, cum ar fi gliadinele (greutatea moleculară
30 kDa) și glutenine (greutate moleculară
30-90 kDa). Aportul de gluten a crescut foarte mult în ultimele sute de ani și s-a accelerat în ultimele decenii [14,15]. Această creștere se datorează în mare parte creșterii soiurilor de cereale bogate în gluten și, mai recent, prin utilizarea glutenului suplimentar la coacere și procesarea alimentelor pentru a face aluatul mai ușor de lucrat și pentru a face pâinea mai pufoasă [15]. Soares și colab. a constatat că o dietă fără gluten reduce leptina, adipozitatea, inflamația și rezistența la insulină la șoareci, în ciuda unui aport energetic similar [16]. Chirdo și colab. a raportat prezența gliadinei de grâu nedegradate în serul uman (la un nivel mediu de 41 ng/ml) [17], așa cum a fost raportat anterior și pentru alte proteine dietetice de către Husby și colab. [18.19].
Aici, am folosit tehnologia de rezonanță plasmonică de suprafață (SPR) pentru a monitoriza interacțiunea dintre leptină și receptorul de leptină și inhibarea acesteia de gluten digerat enzimatic din grâu.
Metode
Digestia glutenului
Pentru a imita condițiile fiziologice din intestinul uman, glutenul din grâu a fost digerat conform protocolului De Ritis și colab. [20] cu ușoare modificări. 100 g de gluten din grâu (Sigma-Aldrich: G5004) au fost digerate în 1 L de HCI 0,2 N (pH 1,8) conținând 2 g de pepsină (Sigma-Aldrich: P6887) la 37 ° C timp de 2 ore. PH-ul a fost verificat periodic și ajustat la 1,8 cu HC1 sau NaOH, după cum este necesar. PH-ul a fost apoi ajustat la 8,0 cu NaOH 2 N. Glutenul digerat cu pepsină a fost digerat în continuare prin adăugarea a 2 g de tripsină (Sigma-Aldrich: T4799). Glutenul rezultat digerat cu pepsină și tripsină a fost agitat energic la 37 ° C timp de 4 ore. PH-ul a fost verificat periodic și ajustat la pH 8,0 cu HC1 sau NaOH, după caz.
Îndepărtarea pepsinei și a tripsinei
Pepsină (greutate moleculară
40 kDa) și tripsină (greutate moleculară
25 kDa) au fost îndepărtate din digestia de gluten fie prin filtrare prin rotire printr-un filtru de 10 kDa, fie prin tratament termic la 100 ° C timp de 30 min urmat de centrifugare la 13000 g timp de 10 min. Concentrația de digestie a glutenului după filtrare sau centrifugare a fost determinată din absorbanță la 280 nm, presupunând o absorbanță de 1 la 1 mg/ml. Pentru a verifica dacă a rămas vreo activitate de pepsină sau tripsină, 1,8 μg/mL de leptină (leptină umană recombinată, sisteme de cercetare și dezvoltare) a fost incubată în digestie cu gluten (numai filtrare prin rotire sau filtrare prin rotire și tratare termică) timp de 1 oră sau 24 ore ° C Probele au fost rezolvate prin SDS PAGE (Invitrogen) și au fost șterse folosind iBlot® Gel Transfer Stacks, PVDF, mini kit (Invitrogen) conform instrucțiunilor producătorului. După spălare, petele au fost incubate cu anticorp conjugat cu anti-leptină HRP (HyTest Ltd, nr. Cat. 2LE1C) la 4 ° C peste noapte. Anticorpul a fost utilizat la o diluție de 1: 1000 în raport cu concentrația stoc în produs (HyTest Ltd, nr. Cat. 2LE1C). Benzile imunoreactive au fost detectate folosind reactivi ECL (GE Healthcare Life Sciences).
Studii SPR
Datele fazei de disociere au fost adaptate folosind o singură descompunere exponențială:
Valoarea obținută pentru k off a fost apoi utilizată în timpul adaptării datelor fazei de asociere pentru a obține o estimare a k on cu următoarea ecuație:
Datele de inhibare au fost analizate prin găsirea valorii platoului la sfârșitul fiecărei injecții de leptină singură sau leptină plus gluten.
Rezultate
Îndepărtarea pepsinei și a tripsinei
Western blot a arătat benzile de leptină rămase pentru toate digestile de gluten după atât 1, cât și 24 de ore. Acest lucru arată că filtrarea prin rotire și tratamentul termic au eliminat toate activitățile de protează din digestia glutenului, deoarece altfel leptina ar fi fost degradată.
Studii SPR
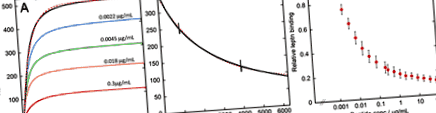
Analiza SPR a legării leptinei la receptorul de leptină și inhibarea acesteia de către digestia glutenului. A) Exemple de sensorgrame înregistrate în timpul injecției cu 30 nM de leptină singură (neagră) sau în prezența 0,0022 (albastru), 0,0045 (verde), 0,018 (portocaliu) sau 0,3 (roșu) μg/ml gluten digerat pe un senzor Chip cu imobilizat receptorul leptinei-himera Fc. Linia punctată roz se potrivește cu linia neagră folosind ecuația 2 (vezi Metode). B) Exemplu de sensorgramă înregistrată în timpul fluxului tampon după injectarea completă de 30 nM leptină (neagră). Linia punctată roz se potrivește cu datele folosind ecuația 1 (vezi Metode). Cele două linii verticale apar în timpul disocierii prelungite când mașina comută între cele două pompe ale sale. C) Grafic de intensitate relativă la platoul final de legare a leptinei în timpul injectării de 30 nM leptină versus concentrația de digestie a glutenului. Barele de eroare reprezintă abaterea standard a trei măsurători.
Discuţie
Descoperiri cheie
Glutenul de grâu digerat inhibă legarea leptinei de receptorul leptinei.
Posibile mecanisme
Nu a fost detectată nicio legare a digestiei glutenului la receptorul de leptină. Acest lucru poate indica faptul că glutenul digerat a fost prea mic pentru a fi detectat atunci când este legat de receptorul leptinei sau că glutenul digerat este legat în schimb de leptină. Indiferent, digestia glutenului poate inhiba legarea leptinei direct prin obstrucționarea locului de legare pe leptină sau receptorul de leptină sau indirect, provocând o schimbare conformațională a leptinei sau a receptorului de leptină care le afectează capacitatea de a se lega reciproc.
Comparație cu rezultatele altor studii
Lammers și colab. a arătat că digestia glutenului a determinat deplasarea dependentă de concentrație a ligandului receptorului CXCR3, cu 50% deplasarea ligandului cu o concentrație de digestie a glutenului de 1 mg/ml [11]. Concentrația mult mai mică de digestie a glutenului de 10 ng/ml necesară în studiul nostru pentru inhibarea pe jumătate maximă a legării leptinei s-ar putea datora diferențelor de sensibilitate în modelul de legare respectiv al studiilor. S-ar putea datora, de asemenea, diferențelor de concentrație și/sau activitate între substanțele inhibitoare din respectivele digestii de gluten.
Limitările prezentului studiu
Aceasta este o in vitro trebuie efectuate studii și mai multe cercetări pentru a clarifica posibila relevanță clinică a observațiilor noastre. De asemenea, studiul a examinat efectele glutenului din grâu, lăsând astfel alte proteine din grâu și toate celelalte proteine din cereale pentru studii viitoare. Mai mult, activitatea de protează a fost îndepărtată din digestia de gluten prin filtrare prin rotire printr-un filtru de 10 kDa. Acest lucru va elimina substanțele active mai mari din digestia de gluten. Astfel de substanțe pot fi examinate în studii viitoare.
Cercetări și implicații clinice
Concentrațiile la care glutenul de grâu digerat a inhibat leptina în studiul nostru sunt în același interval cu concentrațiile raportate anterior pentru gliadină și alte proteine dietetice din serul uman [17-19], făcând astfel proteinele din cereale din cereale relevante clinic ca posibilă cauză a leptinei. rezistență și obezitate. Descoperirile noastre justifică cercetări suplimentare, nu numai cu privire la efectele proteinelor din grâu și alte boabe de cereale asupra semnalizării leptinei, ci și asupra efectelor altor proteine dietetice asupra altor receptori, structuri și funcții din organism.
Pentru a evalua implicațiile clinice ale rezultatelor studiului, ar trebui să luăm în considerare concluziile anterioare privind relația dintre leptina serică și masa de grăsime corporală la om, care sa dovedit a fi o corelație liniară sau pătratică puternică (R = 0,86, P 2 și o
21 kg/m 2. O îmbunătățire corespunzătoare a IMC ar reduce probabil și tulburările metabolice asociate obezității, cum ar fi dislipidemia, bolile cardiovasculare, accidentul vascular cerebral, rezistența la insulină și diabetul de tip 2 în populație.
Concluzii
Glutenul de grâu digerat inhibă legarea leptinei de receptorul leptinei, cu inhibare la jumătate maximă la 10 ng/ml. Inhibarea este semnificativă la concentrații relevante din punct de vedere clinic și, prin urmare, ar putea servi ca o nouă cale de investigare pentru a înțelege baza moleculară a rezistenței la leptină, a obezității și a tulburărilor asociate.
Referințe
Zhou Y, Rui L. Semnalizarea Leptinei și rezistența la leptină. Front Med. 2013; 7 (2): 207-22.
Pan H, Guo J, Su Z. Progrese în înțelegerea interrelațiilor dintre rezistența la leptină și obezitate. Fiziol Comportament. 2014; 130: 157-69.
Jonsson T, Olsson S, Ahren B, Bog-Hansen TC, Dole A, Lindeberg S. Dieta agrară și boli de bogăție - Lectinele dietetice noi evolutive cauzează rezistență la leptină? Tulburare endocră BMC. 2005; 5 (1): 10.
Segurel L, Austerlitz F, Toupance B, Gautier M, Kelley JL, Pasquet P și colab. Selecția pozitivă a variantelor de protecție pentru diabetul de tip 2 începând cu neoliticul: un studiu de caz în Asia Centrală. Eur J Hum Genet. 2013; 21 (10): 1146-51.
Vasselli JR, Scarpace PJ, Harris RB, Banks WA. Componente dietetice în dezvoltarea rezistenței la leptină. Adv Nutr. 2013; 4 (2): 164-75.
Dall M, Calloe K, Haupt-Jorgensen M, Larsen J, Schmitt N, Josefsen K, și colab. Fragmentele de gliadină și o peptidă specifică de gliadină 33-mer închid canalele KATP și induc secreția de insulină în celulele INS-1E și insulele de șobolani din Langerhans. Plus unu. 2013; 8 (6): e66474.
Lam NT, Cheung AT, Riedel MJ, Light PE, Cheeseman CI, Kieffer TJ. Leptina reduce transportul glucozei și nivelurile ATP celulare în celulele beta INS-1. J Mol Endocrinol. 2004; 32 (2): 415-24.
El-Shebini SM, Ghattas LA, Mohamed HI, Moaty MI, Tapozada ST, Hanna LM. Concentrațiile circulante de hormon leptinic, receptorul de leptină solubil și indicele de leptină liber la femeile egiptene obeze înainte și după terapia cu dietă. J Med Sci. 2009; 9 (5): 219-26.
Ryberg M, Sandberg S, Mellberg C, Stegle O, Lindahl B, Larsson C și colab. O dietă de tip paleolitic provoacă efecte puternice specifice țesutului asupra depunerii de grăsimi ectopice la femeile obeze aflate în postmenopauză. J Intern Med. 2013; 274 (1): 67-76.
Jonsson T, Granfeldt Y, Erlanson-Albertsson C, Ahren B, Lindeberg S. O dietă paleolitică este mai sățioasă pe calorie decât o dietă asemănătoare mediteraneene la persoanele cu boli cardiace ischemice. Nutr Metab (Londra). 2010; 7: 85.
Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K și colab. Gliadinul induce o creștere a permeabilității intestinale și a eliberării zonulinelor prin legarea la receptorul de chemokine CXCR3. Gastroenterologie. 2008; 135 (1): 194–204 e3.
Kamikubo Y, Dellas C, Loskutoff DJ, Quigley JP, Ruggeri ZM. Contribuția glicanilor N-legați de receptorul leptinei la legarea leptinei. Biochem J. 2008; 410 (3): 595-604.
Kuzma JN. Ingerarea germenilor de grâu la subiecții sănătoși nu ridică în mod acut concentrațiile plasmatice de aglutinină a germenilor de grâu. Colorado State University: Colecții digitale de biblioteci. 2009.
Belderok B. Evoluții în procesele de fabricare a pâinii. Alimente vegetale Hum Nutr. 2000; 55 (1): 1-86.
Ziua L, Augustin MA, Batey IL, Wrigley CW. Utilizările de grâu-gluten și nevoile industriei. Trends Food Sci Technol. 2006; 17 (2): 82-90.
Soares FL, de Oliveira Matoso R, Teixeira LG, Menezes Z, Pereira SS, Alves AC, și colab. Dieta fără gluten reduce adipozitatea, inflamația și rezistența la insulină asociate cu inducerea expresiei PPAR-alfa și PPAR-gamma. J Nutr Biochem. 2013; 24 (6): 1105-11.
Chirdo FG, Rumbo M, Anon MC, Fossati CA. Prezența nivelurilor ridicate de gliadină nedegradată în laptele matern de la mame sănătoase. Scand J Gastroenterol. 1998; 33 (11): 1186-92.
Husby S, Jensenius JC, Svehag SE. Trecerea antigenului dietetic nedegradat în sângele adulților sănătoși. Cuantificarea, estimarea distribuției mărimii și relația absorbției cu nivelurile de anticorpi specifici. Scand J Immunol. 1985; 22 (1): 83-92.
Husby S, Jensenius JC, Svehag SE. Trecerea antigenului dietetic nedegradat în sângele adulților sănătoși. Caracterizarea ulterioară a cineticii absorbției și distribuția mărimii antigenului. Scand J Immunol. 1986; 24 (4): 447–55.
De Ritis G, Occorsio P, Auricchio S, Gramenzi F, Morisi G, Silano V. Toxicitatea proteinelor din făină de grâu și a peptidelor derivate din proteine pentru dezvoltarea in vitro a intestinului de la fătul de șobolan. Pediatru Res. 1979; 13 (11): 1255–61.
Mistrik P, Moreau F, Allen JM. Analiza BiaCore a interacțiunii receptorului leptină-leptină: dovezi pentru stoichiometrie 1: 1. Biochimie anală. 2004; 327 (2): 271-7.
Maffei M, Halaas J, Ravussin E, Pratley RE, Lee GH, Zhang Y și colab. Nivelurile de leptină la om și la rozătoare: măsurarea leptinei plasmatice și a ARN ob la subiecții obezi și cu greutate redusă. Nat Med. 1995; 1 (11): 1155–61.
Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, și colab. Concentrațiile serice de leptină imunoreactivă la omul cu greutate normală și obez. N Engl J Med. 1996; 334 (5): 292-5.
Caro JF, Kolaczynski JW, Nyce MR, Ohannesian JP, Opentanova I, Goldman WH și colab. Scăderea raportului cefalorahidian-lichid/leptină serică în obezitate: un posibil mecanism de rezistență la leptină. Lancet. 1996; 348 (9021): 159–61.
Mulțumiri
Autorii sunt recunoscători Anna Hedelius pentru asistență tehnică și dr. De Vincenzi și dr. Silano de la Istituto Superiore di Sanità din Roma, Italia, pentru că ne-au trimis cu amabilitate digestia lor de grâu pentru experimentele inițiale. Studiul a fost finanțat de Fundațiile și Dotările Spitalului Universitar Skåne (SUS stiftelser și donații) și Dr. P Håkanssons stiftelse.
Informatia autorului
Afilieri
Centrul de cercetare în domeniul asistenței medicale primare, Universitatea Lund/Regiunea Skåne, Spitalul Universitar Skåne, Malmö, Suedia
Tommy Jönsson, Ashfaque A Memon, Kristina Sundquist și Jan Sundquist
Departamentul de Științe ale Plantelor și Mediului, Universitatea din Copenhaga, DK-1871, Frederiksberg C, Danemarca
Institutul de Științe Biomedice, Facultatea de Sănătate și Științe Medicale, Universitatea din Copenhaga, DK-2200, Copenhaga, Danemarca
Academia Daneză pentru Diabet, Spitalul Universitar Odense, Odense, Danemarca
Departamentul de Biochimie și Biologie Structurală, Universitatea Lund, Lund, Suedia
Mikael Bauer și Sara Linse
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
autorul corespunzator
Informatii suplimentare
Interese concurente
Autorii declară că nu au interese concurente.
Contribuțiile autorilor
TJ a conceput studiul, a participat la proiectarea studiului și a scris articolul. AM, KS, JS, SO, AN, MB și SL au participat la proiectarea și executarea studiului și la redactarea articolului, precum și la revizuirea acestuia pentru un conținut intelectual important. Toți autorii au citit și au aprobat manuscrisul final.
- Dietary Methionine Restriction Plus Temozolomide for Recurrent GBM - View Full Text
- Caracteristicile sindromului Prader-Willi și ale obezității morbide cu debut precoce - Vizualizare text complet
- Text integral Studiu de un an de evaluare a eficacității unei diete restricționate cu iod pentru VMRR
- Efectul Victoza asupra preferințelor și obiceiurilor alimentare la pacienții cu diabet de tip 2 - Vizualizare text complet
- Efectele grăsimilor și carbohidraților la bărbații obezi - Vizualizare text complet