Abstract
1. Introducere
Glucocorticoizii (GC) sunt o clasificare a hormonilor steroizi, produși în mod natural prin activarea axei hipotalamo-hipofizo-suprarenale (HPA), care sunt responsabili pentru medierea sistemului imunitar și a metabolismului energetic. În ultimele șase decenii, GC sintetice au fost stabilite ca o componentă integrantă a terapiei hematologice a cancerului [1] și sunt, de asemenea, utilizate pentru tratamentul unei varietăți de afecțiuni inflamatorii și boli [2,3]. Se estimează că 1,0% –2,5% din populația Statelor Unite cu vârsta ≥20 de ani (
2.513.259 persoane) li se prescriu GC orale [4,5,6,7]. Din păcate, administrarea cronică sau cu doze mari de GC este asociată cu numeroase efecte secundare, cum ar fi pierderea mușchilor scheletici induși de steroizi (miopatie) [8], rezistența la insulină periferică [9], adipozitatea viscerală [10] și dezvoltarea diabetului [11] . GC sunt adesea asociate cu creșterea excesivă în greutate la oameni și animale [12], o caracteristică care poate fi legată, cel puțin parțial, de dorința crescută de alimente „confortabile” cu densitate energetică (de exemplu, conținut ridicat de grăsimi, zaharuri simple) [13.14 ]. O serie de studii recente de rozătoare au început să investească relația dintre alegerile dietetice slabe, cum ar fi o dietă bogată în grăsimi (HFD), în combinație cu administrarea cronică sau cu doze mari de GC. Este posibil ca pacienții care iau GC exogene să fie mai susceptibili la alegeri alimentare slabe, dar efectul creșterii consumului de grăsime în combinație cu GC exogene crescute a fost investigat recent.
Această lucrare va rezuma informațiile disponibile cu privire la implicațiile metabolice asociate cu efectele colective ale creșterilor în GC și un HFD (adică o dietă îmbogățită în mod specific cu grăsimi saturate). Aceste informații sunt extrem de importante și relevante din punct de vedere clinic, deoarece numărul pacienților care iau GC exogene crește și subliniază importanța unei diete cu conținut scăzut de grăsimi atunci când persoanelor li se administrează un tratament GC.
2. Prezentare generală a GC în sănătate și boli
Mai multe boli cardiometabolice (de exemplu, obezitatea centrală, diabetul de tip 2, diabetul de tip 1, sindromul metabolic și pre-diabetul) sunt asociate cu creșteri ale concentrațiilor GC [15]. Creșterea GC, care poate fi rezultatul bolii în sine sau poate conduce la progresia bolii, afectează o serie de elemente metabolice și comportamentale [16]. Interacțiunea glucocorticoidă/receptorul glucocorticoidului (GC/GR) joacă un rol critic în menținerea homeostaziei globale a glucozei, într-un număr de țesuturi, inclusiv creierul și periferia, deoarece menținerea metabolismului sistemic al carbohidraților necesită o reglare complexă între diferite organe periferice, pe lângă sistem nervos. Modificări subtile atât în secreția de cortizol, cât și/sau în reactivarea tisulară specifică a GC mai puțin active (adică, cortizon) la o formă mai activă (de exemplu, cortizon), prin enzima prereceptoră 11β-hidroxisteroid dehidrogenaza 1 (11β-HSD1), posibilă legătură între biologia GC și dezvoltarea rezistenței la insulină [17] și sindromul metabolic/diabetul zaharat de tip 2 (T2DM) [18,19,20].
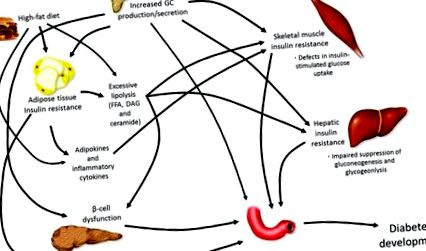
Datorită acțiunilor lor catabolice sistemice, GC cresc producția hepatică de glucoză [21], degradarea proteinelor musculare scheletice [22] și lipoliza [23]. Ca atare, fie supraproducția endogenă (boala Cushing), fie creșterea exogenă a GC prin tratament terapeutic sunt asociate cu tulburări metabolice majore, culminând adesea cu dezvoltarea T2DM, în special într-un cadru de aport caloric crescut (Figura 1).
Fiziopatologia dezvoltării diabetului. Dezvoltarea diabetului manifest are loc printr-o serie de mecanisme, toate care funcționează împreună pentru a afecta creșterea glicemiei, provocând în cele din urmă hiperglicemie. Glucocorticoizi (GC), acizi grași liberi (FFA), diacilglicerol (DAG).
3. Acțiuni metabolice ale GC în interiorul mușchiului scheletic, ficatului și țesutului adipos
3.1. GC cauzează dislipidemie și inhibă proteinele de semnalizare a insulinei în mușchiul scheletic
Rezistența la insulină, care este un răspuns afectat al țesuturilor sensibile la insulină la semnalizarea insulinei, este o trăsătură caracteristică a T2DM și joacă un rol cheie în patogeneza bolii [34,35]. Sensibilitatea sistemică la insulină, în condiții postprandiale, este condusă în mare parte de sensibilitatea la insulină a mușchilor scheletici, deși ficatul joacă și un rol [36]. Hiperinsulinemia, chiar și la niveluri fiziologice, poate stimula de fapt o înrăutățire a sensibilității la insulină în diabet, promovând astfel un ciclu vicios care pune o cerere neîncetată asupra funcției celulelor β pancreatice [36].
3.2. GC cauzează rezistență la insulină hepatică și dislipidemie
Ficatul este un organ major responsabil de reglarea homeostaziei glucozei și lipidelor. În starea de repaus alimentar, producția de glucoză a ficatului prin gluconeogeneză (GNG) și glicogenoliză (GGL) ajută la menținerea euglicemiei. În starea alimentată, absorbția crescută a glucozei în ficat și reducerea producției de glucoză sunt componente esențiale pentru controlul glucozei post-prandial. Odată cu creșterea concentrației de glucoză plasmatică, insulina este responsabilă pentru suprimarea producției endogene de glucoză [57], în timp ce GC și glucagonul măresc debitul hepatic de glucoză, care este răspunsul normal într-o stare de post sau catabolică (de exemplu, exerciții prelungite). În prezența creșterilor GC, producția hepatică de glucoză este crescută direct prin activarea enzimelor responsabile de producerea glucozei (vezi mai jos) și indirect prin promovarea rezistenței crescute la insulină hepatică [58,59].
Rezistența la insulină hepatică indusă de GC are ca rezultat suprimarea afectată a producției hepatice de glucoză de către insulină [60]. În general, GC își exercită acțiunile prin reglarea transcripțională a unui număr de gene implicate în metabolismul hepatic al carbohidraților, inclusiv glucoza-6-fosfataza (G6Paza) și fosfoenolpiruvatul carboxicinaza (PEPCK), enzimele care limitează rata implicate în GNG [61,62] . Ambele enzime conțin un element de răspuns glucocorticoid (GRE) în regiunile lor promotor, ceea ce permite GC-urilor să-și modifice direct expresia genică. Deoarece GC sunt inerent catabolice, ele sunt, de asemenea, capabile să descompună atât proteinele, cât și depozitele de grăsimi, crescând în cele din urmă disponibilitatea substraturilor pentru GNG. Mai mult, similar cu ceea ce se observă în mușchiul scheletic, creșterea indusă de GC în depunerea lipidelor în viscere crește aportul de plasmă NEFA și TG la ficat, ceea ce induce indirect rezistența la insulină hepatică [63]. Această acumulare de lipide în ficat, cunoscută și sub numele de hepatosteatoză, poate duce la boli hepatice grase nealcoolice (NAFLD) [28] și, posibil, la boli hepatice mai severe, cum ar fi steatohepatita nealcoolică, fibroză, ciroză și cancer [64]. ].
3.3. GC cresc proliferarea și lipoliza țesutului adipos
Este clar stabilit că creșterile GC, fie la pacienții cu boală Cushing, fie prin terapia cu corticosteroizi exogeni, provoacă exces de adipozitate [65]. Această constatare este oarecum surprinzătoare, deoarece GC par să exercite acțiuni catabolice în toate celelalte țesuturi active din punct de vedere metabolic (adică, mușchiul scheletic, ficatul și osul) [66]. Cu toate acestea, în interiorul țesutului adipos, GC-urile au un rol contradictoriu în metabolismul lipidic, provocând atât creșterea lipolizei, cât și creșterea adipozității viscerale [23]. În general, GC cresc lipoliza în adipocitele mature prin transcrierea și expresia îmbunătățită a proteinelor lipazei triglicerid lipazei lipidice (ATGL) și lipazei hormon sensibile (HSL) [67,68], în timp ce adipozitatea centrală crescută are loc prin reglarea în sus a proliferării celulelor adipoase în plus față de consum crescut de alimente [69]. Nu este clar dacă GC modifică modificările lipolizei stimulate de catecolamină [23].
Așa cum s-a menționat mai sus, 11β-HSD1, care este exprimat predominant în ficat, creier, mușchi scheletic și țesut adipos, amplifică cantitatea de GC active într-un țesut dat, crescând potențial expunerea la activitatea crescută a GC [70]. Niveluri crescute de 11β-HSD1 au fost observate în depozitele adipoase ale indivizilor obezi [71] și cercetările ulterioare au identificat că atât nivelurile 11β-HSD1 [72], cât și GR [73] sunt mult mai mari în interiorul viscerelor în comparație cu adiposul subcutanat. depozite. Comparativ cu adipocitele subcutanate, adipocitele viscerale par să aibă o afinitate mai mare față de GC [74]. Creșterea expresiei 11β-HSD1 în țesutul adipos într-un model de rozătoare transgenic a dus la creșterea nivelului de GC al țesutului adipos, aport crescut de alimente și o acumulare de adipozitate viscerală, împreună cu alte caracteristici ale sindromului metabolic [75]. Acest lucru sugerează că creșterea specifică țesutului adipos în acțiunea GC, poate prin reglarea în sus a expresiei sau activității 11β-HSD1, stimulează acumularea sporită de grăsime viscerală și deteriorează sensibilitatea la insulină a întregului corp prin acțiuni directe în țesutul adipos.
4. CG și consumul de alimente
Impactul CG pe comportamentul creierului și al hrănirii
Activitatea catabolică a GC determină mobilizarea substraturilor din surse periferice, cum ar fi mușchiul scheletic, ficatul și țesutul adipos. GC sunt, de asemenea, capabile să acționeze asupra creierului prin modularea comportamentului, a răspunsurilor autonome și simpatice, pe lângă creșterea învățării și a memoriei [76]. Consumul de alimente care conțin substanțe bogate în grăsimi și conținut ridicat de zahăr (adesea numite „alimente de confort”) s-a dovedit a fi proporțional cu GC circulante, iar corticosteronul este un hormon cunoscut pentru stimularea stimulărilor sau motivațiilor asociate alimentelor [14,77]. GC stimulează, de asemenea, secreția de insulină și, împreună cu hiperinsulinemia rezultată, această interacțiune a GC cu hiperinsulinemia, modulează alegerea alimentelor pentru a favoriza zaharoza și untura la rozătoare [5,16].
Două studii elegante de rozătoare au examinat efectul stresului metabolic anterior (reținere sau stres rece) asupra preferinței pentru „alimente de confort” și a răspunsului ulterior al axei HPA. Ambele studii au descoperit că alimentele „de confort” au fost preferate chow-urilor standard, iar furnizarea acestor alimente „de confort” a redus gradul răspunsurilor simpatice induse de stres și a scăzut nivelul factorului/hormonului de eliberare a corticotropinei bazale (CRF) din hipotalamus. [78,79]. S-a descoperit că pacienții cu boală Cushing aleg alimente bogate în grăsimi, în comparație cu persoanele cu niveluri normale de GC [80]. Mai mult, creșterile catecolaminelor, care sunt asociate și cu activitatea crescută a axei HPA, s-au dovedit a crește activitățile de hrănire la rozătoare [81]. GC cresc indirect comportamentul de hrănire prin modificarea neuropeptidei Y (NPY) [82], neurotransmițătorul orexigen cheie legat de consumul de alimente și depunerea țesutului adipos [83].
5. Combinarea creșterilor în GC cu hrana bogată în grăsimi
5.1. Dexametazonă sau Corticosteron Tratament exogen și hrănire bogată în grăsimi
Odată cu creșterea numărului de persoane care iau GC sintetice în prezent [84], este important să înțelegem pe deplin asocierea dintre creșterea concentrațiilor de GC și consumul crescut de grăsimi din dietă. Mai precis, tipul de grăsime este extrem de important, deoarece dietele bogate în acizi grași saturați sunt un stimul diabetogen mai puternic decât acizii grași mono și polinesaturați [85]. În mod surprinzător, au fost efectuate cercetări foarte limitate care examinează potențialele acțiuni sinergice ale celor două insulte metabolice. Mai mult, nu sunt cunoscute efectele aportului de proteine de înaltă calitate asupra pierderii musculare induse de GC și a sensibilității la insulină.
Tomografia microcomputată arată că corticosteronul și o dietă bogată în grăsimi au cauzat creșterea grăsimii abdominale. (A) Este prezentată o reprezentare a grăsimii abdominale de la un șobolan reprezentativ din fiecare grup; (B) O radiografie întreagă de șobolan cu ROI (regiunea de interes) utilizată. Dieta standard (SD), dieta bogată în grăsimi (HFD), corticosteron (Cort).
În general, modelele de supraexpunere HFD/GC de mai sus demonstrează o creștere consistentă și rapidă atât a adipozității viscerale, cât și a depunerii de lipide ectopice (ficat, mușchi). Este posibil ca, din moment ce creșterile IMCL sunt cunoscute să apară în decurs de 2-3 zile de la HFD [94], și întrucât atât GC cât și HFD provoacă o acumulare semnificativă de IMCL, s-ar putea propune că rapiditatea disfuncției metabolice, în majoritatea aceste modele de co-tratament, ar putea fi atribuite acumulării inițiale în IMCL. Atunci când este combinat cu activitate crescută de GC specifică țesutului, întrucât conținutul de 11β-HSD1 este crescut în țesutul adipos cu HFD, co-tratamentul poate fi atât creșterea adipozității viscerale, cât și expunerea activă la GC în țesutul adipos, propagând efectele dăunătoare ale creșterii CG. Sunt necesare lucrări suplimentare care examinează mecanismele care contribuie la creșterea efectelor metabolice dăunătoare cauzate de combinația creșterilor în GC, fie exogen, fie endogen, și HFD este necesară.
5.2. Stresul cronic și hrănirea bogată în grăsimi
O altă metodologie utilizată pentru a induce activarea HPA este modelul de stres cronic, cum ar fi stresul de înfrângere socială cronică (CSDS), stresul de reținere sau stresul rece. În general, atunci când această formă de creștere a GC este combinată cu un HFD, rezultatele sunt în mod surprinzător contradictorii cu ceea ce se observă atunci când Dex sau corticosteronul este injectat sau implantat exogen. La șoarecii expuși atât la DIO, cât și la CSDS, stresul cronic a îmbunătățit efectiv adipozitatea crescută, greutatea corporală și intoleranța la glucoză observate după DIO [95]. În mod similar, șobolanii Wistar furnizați cu HFD și imobilizați timp de 1 oră, 5 zile/săptămână timp de 15 săptămâni, au fost protejați de DIO, deoarece acești animale au consumat mai puțin și, în comparație cu șobolanii DIO ne-stresați, au avut toleranțe normale la glucoză [ 96]. Din punct de vedere clinic, acest lucru este foarte relevant și trebuie explorat în continuare deoarece sugerează că persoanele care iau terapie GC exogenă prezintă un risc mult mai mare de complicații metabolice suplimentare dacă consumă o dietă bogată în grăsimi.
6. Rolul exercițiilor fizice în compensarea implicațiilor metabolice ale GC crescute și ale hrănirii cu conținut ridicat de grăsimi
Exercițiul voluntar, în general considerat a fi aerob, este bine cunoscut pentru a îmbunătăți absorbția de glucoză stimulată de insulină a mușchilor scheletici [109] și rezistența la insulină [99], indusă de expunerea la GC, prin atenuarea reducerilor proteinelor specifice de semnalizare a insulinei, inclusiv Akt și IRS -1 activitate și expresie. Exercițiile fizice scad, de asemenea, conținutul de ceramidă, îmbunătățind în același timp sensibilitatea la insulină, posibil prin direcționarea lipidelor în grupul de trigliceride [110, 111, 112]. Cu toate acestea, antrenamentul la mișcare nu este de obicei capabil să îmbunătățească pierderea extremă în greutate observată cu tratamentul cu dexametazonă sau corticosteron [113] sau unele dintre reducerile observate în angiogeneză, în special expresia factorului de creștere endotelial vascular (VEGF) scăzut [100].
Contra-efectele exercițiilor fizice asupra afectărilor metabolice cauzate de creșterea glucocorticoizilor și dieta bogată în grăsimi. Activitatea fizică (rularea benzii de rulare sau rularea voluntară a roților) este capabilă să îmbunătățească unele dintre efectele metabolice cauzate de glucocorticoizii crescuți (GC) și de o dietă bogată în grăsimi (HFD), în special în pancreas, mușchiul scheletic, țesutul adipos și ficatul. Mușchiul scheletic este în prezent cel mai cercetat, iar majoritatea beneficiilor exercițiului fizic se învârt în jurul îmbunătățirilor în semnalizarea insulinei. Creșterile GC combinate cu HFD provoacă efecte metabolice semnificative și este necesară o examinare suplimentară a exercițiilor fizice asupra pancreasului, țesutului adipos și ficatului.
7. Concluzii
Datorită consecințelor lor pleiotrope, GC afectează aproape fiecare țesut din corp, ceea ce le mărește posibilele beneficii terapeutice, dar intensifică și efectele secundare probabile. GC sintetice sunt forma predominantă de tratament pentru numeroase tulburări inflamatorii și imunologice, ceea ce face ca înțelegerea efectului dietei și nutriției asupra acțiunii lor să fie o preocupare clinică majoră. Există relații semnificative între creșteri exogene ale concentrațiilor GC, rezistența la insulină periferică și dezvoltarea diabetului; o asociere care se mărește cu adăugarea unui HFD. Din fericire, exercițiul fizic pare a fi o opțiune terapeutică viabilă pentru a compensa unele dintre efectele secundare metabolice mai severe prin îmbunătățirea toleranței globale la glucoză, semnalizarea insulinei musculare scheletice, secreția de insulină și compoziția corpului. Sunt necesare cercetări suplimentare pentru a înțelege pe deplin consecințele metabolice ale combinării creșterilor GC și a creșterii grăsimilor dietetice, în plus față de efectul exercițiului ca o posibilă măsură.
Mulțumiri
Michael C. Riddell și Emily C. Dunford au fost susținuți de Consiliul de Cercetări în Științe Naturale și Inginerie din Canada. Mulțumim Sofhia V. Ramos pentru finalizarea imaginilor tomografice micro-computerizate.
Contribuțiile autorului
Emily C. Dunford și Michael C. Riddell au conceput și au scris manuscrisul; Ambii autori au citit și au aprobat manuscrisul final.
Conflicte de interes
Autorii nu declară niciun conflict de interese.
- Dieta bogată în grăsimi Hep C la participarea la un proces de fază III cu Sofosbuvir și GS-5816 pentru
- Acesta este creierul tău cu ouăle prăjite Creierul, motivația și consumul unei diete bogate în grăsimi - ScienceDaily
- Inuții sunt adaptați genetic la o dietă bogată în grăsimi, spune studiul - Diet Doctor
- Problemele de dietă Hep C bogate în grăsimi cu studiul Song și colab. Proteina animalelor vs studiul Proteinelor din plante
- Variația implicațiilor senzației orale pentru dietă și sănătate - PubMed