1 Laboratorul de produse naturale pentru sănătate și boli metabolice, Departamentul de farmacologie, Universitatea din Montreal, Station Centre-Ville, P.O. Box 6128, Montreal, QC, Canada
2 Laborator de fitochimie, plante medicinale și etnofarmacologie, Departamentul de biologie, Universitatea din Ottawa, Ottawa, ON, Canada
3 Institutele canadiene de echipă de cercetare în domeniul sănătății în medicamentele antidiabetice aborigene și Centrul de cercetare a diabetului din Montreal, Canada
4 Departamentul de Farmacognozie, Universitatea din Beni Suef, Beni Suef 62511, Egipt
Abstract
1. Introducere
Obezitatea este o tulburare complexă și multifacetică. Având în vedere statura actuală a epidemiei globale și legătura puternică cu bolile care pun viața în pericol, cum ar fi diabetul, bolile cardiovasculare și cancerele, necesitatea de a preveni sau trata obezitatea și complicațiile acesteia a devenit mai urgentă.
Rezistența la insulină precede de obicei dezvoltarea diabetului de tip 2 și este mai frecventă la persoanele obeze. În mușchiul scheletic, insulina promovează absorbția glucozei prin activarea căii fosfatidilinozitol-3 kinazei (PI3-K)/Akt și prin inducerea translocației GLUT4 a transportorului de glucoză din veziculele de stocare intracelulară către membrana plasmatică [1]. O cale alternativă pentru stimularea absorbției glucozei este calea proteinei kinazei activate de AMP (AMPK). AMPK stimulează translocația GLUT4 către membrana plasmatică printr-un mecanism distinct de calea PI3-K stimulată de insulină [2]. Este de remarcat faptul că AMPK reglează în sus expresia GLUT4, posibil prin fosforilarea directă a coactivatorului transcripțional PPARγ coactivator-1α (PGC-1α). Pe de altă parte, activarea AMPK scade acumularea de lipide intramyocite și crește sensibilitatea la insulină a mușchilor prin fosforilare și inhibarea acetil-CoA carboxilazei (ACC) [3, 4].
În ficat, AMPK scade producția hepatică de glucoză, în principal prin inhibarea expresiei genelor gluconeogene precum fosfoenolpiruvatul carboxilază (PEPCK) și glucoză 6-fosfat (G-6-Pase). În plus, activarea AMPK stimulează oxidarea acizilor grași și inhibă expresia genelor care codifică enzimele lipogene (acidul gras sintază și ACC) [5].
SIRT1 este un alt jucător critic în homeostazia energiei mamiferelor. Este o deacetilază dependentă de nicotinamidă adenină dinucleotidă (NAD + -) și un membru al familiei sirtuinei mamifere. SIRT1 controlează o varietate de procese celulare, cum ar fi apoptoza, ciclul celular și metabolismul prin deacetilarea proteinelor țintă, inclusiv p53, NFkB și PGC-1α. Este activat prin restrângerea postului și caloric, precum și de multe molecule mici, cum ar fi fenolii vegetali, quercetina, piceatanolul și resveratrolul. S-a raportat că activarea SIRT1 îmbunătățește homeostazia glucozei, crește sensibilitatea la insulină și îmbunătățește funcția mitocondrială în mușchiul scheletic al modelelor de rozătoare de diabet de tip 2 [6]. În schimb, activarea SIRT1 în ficat mărește genele gluconeogene și reprimă glicoliza, sugerând că SIRT1 induce răspunsuri metabolice specifice organelor. Similar cu mușchiul scheletic, activarea SIRT în ficat promovează oxidarea acizilor grași și previne steatoza hepatică indusă de dietă și rezistența la insulină [7].
În cele din urmă, receptorul activat de proliferatorul peroxizomului-α (PPAR-α) aparține superfamiliei receptorilor nucleari PPAR și este extrem de exprimată în țesuturile cu metabolism activ al grăsimilor, cum ar fi ficatul, inima și mușchiul scheletic. PPAR-α induce expresia genelor care controlează β-oxidarea acizilor grași.
Diabetul de tip 2 a atins proporții fără precedent între populațiile aborigene din întreaga lume. În Canada, ratele au crescut exponențial peste media națională în ultimele decenii și se așteaptă să crească în continuare. De exemplu, prevalența diabetului în rândul națiunilor cree din Eeyou Istchee (CEI) care locuiește în regiunea estică a golfului James din nordul Quebecului s-a triplat la adulții cu vârsta peste 20 de ani în aceeași perioadă de timp [8]. Pentru a aborda această problemă gravă de sănătate cu care se confruntă primele națiuni canadiene, în special CEI, echipa noastră de cercetare și-a propus să identifice tratamente relevante din punct de vedere cultural pentru diabet în farmacopeea lor tradițională.
Lingonberry (COM)V. vitis-idaea) aparține familiei de plante Ericaceae și este strâns legată de afinele cu tufiș (Vaccinium corymbosum L.) și afine (V. macrocarpum L.) [9]. Boabele sunt comestibile și sunt folosite în nordul Europei pentru a face gemuri, sosuri și alte alimente [10]. De asemenea, sunt folosite în mod tradițional ca hrană de către popoarele indigene din Canada, unde sunt consumate crude, înăbușite și servite cu pește sau carne sau amestecate cu ouă de pește fierte, ficat și grăsimi [11, 12]. Criii folosesc fructele de pădure ca medicament popular pentru tratarea urinărilor frecvente și a altor simptome ale diabetului [13, 14].
Într-un studiu anterior, am raportat că extractul etanolic din boabele de V. vitis-idaea a dezvăluit proprietăți interesante de îmbunătățire a absorbției de glucoză în celulele musculare scheletice cultivate C2C12 prin activarea AMPK [15]. În lucrarea de față, am evaluat efectul V. vitis-idaea extract într-un model de șoarece de obezitate indusă de dietă (DIO), care imită îndeaproape sindromul metabolic uman și diabetul de tip 2 timpuriu, legate de stilul de viață nesănătos. Cel mai studiat model experimental al DIO este tulpina de șoarece C57Bl/6J. Această tulpină devine obeză, rezistentă la insulină și hiperglicemiantă atunci când este hrănită cu o dietă bogată în grăsimi [16]. Dincolo de parametrii sistemici ai homeostaziei glucozei și lipidelor, am acordat atenție și componentelor tisulare majore ale căilor insulino-dependente și independente descrise anterior.
2. Materiale și metode
2.1. Materiale vegetale
Boabe de V. vitis-idaea au fost recoltate în regiunea estică a golfului James, QC, Canada, conform procedurilor tradiționale (anotimp, oră a zilei, locație și oferire de cadouri) instruite de bătrâni cri. Au fost păstrate într-un loc uscat și rece până la utilizare. Identitatea botanică a fost confirmată de Dr. Alain Cuerrier (Institutul de Căutare în Biologie Végétale, Université de Montréal) și exemplarele de voucher au fost depuse la Herbariul Grădina Botanică din Montreal (numărul voucherului Whap04-21). Extractul etanolic 80% a fost preparat așa cum s-a descris anterior [17] urmând procedurile standard de operare ale laboratorului profesorului Arnason.
2.2. Animale și În Vivo Protocoale experimentale
Șoareci masculi C57BL/6 de patru săptămâni au fost cumpărați de la Charles River (St-Constant, QC). După aclimatizare, șoarecii au fost împărțiți în mod aleatoriu în cinci grupuri (
fiecare) și a început pe o dietă obișnuită (grup de control CHOW) sau o dietă bogată în grăsimi (35% grăsimi, 20% proteine și 36,5% carbohidrați, Bio-Serv, Frenchtown, NJ, SUA). După 8 săptămâni pe aceste diete, șoarecii hrăniți cu HFD au fost obezi și rezistenți la insulină. Au cântărit în medie 31,78 g ± 2,71, în timp ce omologii lor hrăniți cu CHOW au cântărit
g. În acest moment, un grup de șoareci hrăniți cu HFD a servit drept control DIO (aport continuat de HFD pentru încă 8 săptămâni), în timp ce celelalte trei grupuri de șoareci hrăniți cu HFD au primit V. vitis-idaea extrageți la 3 doze (125, 250 și 500 mg/kg) încorporate în HFD pentru o altă perioadă de 8 săptămâni.
Greutatea corporală, aportul de alimente, aportul de apă și nivelurile de glucoză din sânge au fost măsurate de la animale care nu au fastid de 2 sau 3 ori pe săptămână pe tot parcursul studiului. Sângele din coadă a fost colectat pentru determinarea glucozei folosind un glucometru (Accu-Check Roche, Montreal, QC). La sfârșitul studiului de tratament, animalele au fost sacrificate și diferite țesuturi au fost recoltate, cântărite și prelucrate pentru analiză ulterioară. Toate procedurile și protocoalele experimentale au fost autorizate de Comitetul de etică pentru experimentarea animalelor de la Universitatea din Montreal și au respectat liniile directoare ale Consiliului canadian pentru îngrijirea și protecția animalelor.
2.3. Măsurarea probelor de plasmă
Trigliceridele plasmatice, colesterolul total, LDL, HDL, alanina aminotransferază (ALT), aspartat aminotransferaza (AST), fosfataza alcalină și creatinina au fost evaluate folosind protocoale standard de biochimie clinică la Spitalul de Copii Sainte-Justine (Montreal, Quebec).
Insulina a fost măsurată folosind un kit de radioimunotest (Linco; St-Charles, MO), în timp ce adiponectina și leptina au fost măsurate folosind kituri ELISA (Millipore, St-Charles, MO).
2.4. Evaluarea histologică
Probele de ficat obținute de la fiecare șoarece au fost fixate în soluție de formalină 10%, încorporate în parafină, tăiate în secțiuni, apoi montate pe lamele de sticlă și colorate cu șofran de hematoxilină floxină (HPS). Steatoza hepatică a fost evaluată în funcție de procentul de celule hepatice care au prezentat picături de grăsime macrovesiculare după cum urmează: grad 0, absent, mai puțin de 5% din hepatocite; gradul 1, ușor, 5-33% din hepatocite; gradul 2, moderat, 33-66% din hepatocite; gradul 3, sever,> 66% din hepatocitele afectate [18].
2.5. Determinarea trigliceridelor tisulare (TG)
Țesutul (100 mg) a fost pudrat sub azot lichid și lipidele totale au fost extrase cu 50 de volume de reactiv Folch (2: 1 cloroform-metanol) [19]. Conținutul TG a fost determinat utilizând un kit comercial (Randox Laboratories Ltd., UK).
2.6. Analiza Western Blot
2.7. Analize statistice
Datele au fost analizate de software-ul SigmaStat 3.1 (Jandel Scientific, San Rafael, CA) utilizând analiza unică a varianței (ANOVA). Zonele de sub curbă (ASC) au fost calculate utilizând software-ul PRISM (GraphPad, San Diego, CA, SUA). Datele neparametrice au fost analizate prin testul chi-pătrat. Semnificația statistică a fost stabilită la
. Rezultatele sunt prezentate ca medie ± SEM pentru numărul indicat de determinări sau animale.
3. Rezultate
3.1. V. vitis-idaea Îmbunătățește semnificativ hiperglicemia indusă de HFD la șoarecii DIO
Așa cum era de așteptat, animalele de control DIO au fost obeze, hiperglicemice, hiperinsulinemice și dislipidemice (tabelele 1 și 2). Raportul leptină: adiponectină și steatoza hepatică observate au fost, de asemenea, în concordanță cu stabilirea unei stări rezistente la insulină (tabelele 2 și 3).
). * denotă o diferență semnificativă în comparație cu controlul CHOW și † indică o diferență semnificativă față de grupul de control DIO (
valoarea † indică a
V. vitis-idaea tratamentul nu a avut niciun efect asupra greutății corporale totale sau a greutății retroperitoneale și epididimale (Figura 1 (a) și Tabelul 1). În mod similar, aportul caloric a rămas neschimbat în grupul de control DIO și în grupurile tratate în comparație cu grupul CHOW (datele nu sunt prezentate). cu toate acestea, V. vitis-idaea tratamentul, administrat în ultimele opt săptămâni de protocoale experimentale la doze de 125 și 250 mg/kg, a redus semnificativ zona de sub curbă (ASC) a nivelurilor de glucoză din sânge cu 9 și respectiv 12%, comparativ cu controalele DIO (Figura 1 (b);
). Pe de altă parte V. vitis-idaea la 500 mg/kg a dus la un efect mai slab (reducere cu 7% a glicemiei) care nu a reușit să atingă semnificația statistică. Efectul antihiperglicemic a fost și mai evident la sfârșitul tratamentelor pentru cele trei doze în care s-a înregistrat o scădere semnificativă (28%, 25% și 17% scădere pentru dozele de 125, 250 și 500 mg/kg, respectiv; ).
) evaluat prin testul ANOVA;
Pe de altă parte, insulinemia nu a fost afectată semnificativ de diferitele tratamente. O tendință spre reducere (30%) comparativ cu controalele DIO a fost observată doar la 500 mg/kg V. vitis-idaea-grup tratat (Tabelul 2).
3.2. V. vitis-idaea Tratamentul atenuează steatoza hepatică și hiperlipidemia la șoarecii DIO
Steatoza hepatică a fost evaluată prin scorul histologic al secțiunilor de țesut hepatic, așa cum a fost validat anterior [18]. Așa cum era de așteptat, 82% dintre animalele din grupul de control DIO au prezentat steatoză severă (gradul 3), în timp ce 18% au avut steatoză ușoară până la moderată (gradul 1 sau 2), comparativ cu ficatul sănătos 100% (gradul 0) observat la non-obezi. Congeneri hrăniți cu CHOW. V. vitis-idaea tratamentul a scăzut proporția de animale DIO care prezintă steatoză de gradul 3 la doar 50-66%. Interesant este faptul că animalele cu ficat sănătos (steatoză de gradul 0), care erau inexistente în grupul de control DIO, au fost prezente în proporții cuprinse între 8 și 33% în V. vitis-idaea-animale DIO tratate. Pe de altă parte, 20-32% din V. vitis-idaea grupul a prezentat fie steatoză de gradul 1, fie gradul 2 (Tabelul 3;), confirmând îmbunătățirea generală a acestui parametru. Grupul care a primit doza de 250 mg/kg/zi a arătat cea mai bună reducere a profilului histologic steatotic.
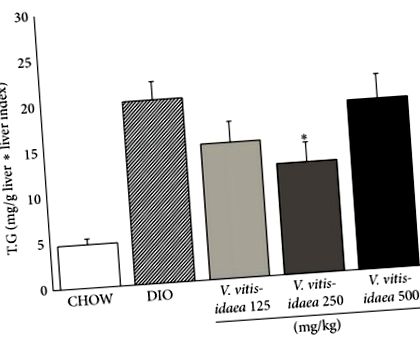
În concordanță cu aceste rezultate, V. vitis-idaea niveluri reduse de trigliceride hepatice. Atât grupurile de 125, cât și cele de 250 mg/kg/zi au demonstrat o reducere semnificativă statistic (39%) (Figura 2;). Mai mult, aceeași doză de 250 mg/kg/zi a reușit să reducă semnificativ colesterolul plasmatic total și LDL plasmatic cu 12% și respectiv 18% (Tabelul 2;).
) a fost determinată folosind un kit comercial. Datele sunt prezentate ca medie ± SEM și reprezentative pentru 12 șoareci per grup experimental. * indică a
valoare). Pe de altă parte, doza mare de extract de plantă a arătat o tendință de scădere a conținutului de p53 acetilat (Lys 379) (Figurile 3 (a) și 3 (c);) și a crescut semnificativ fosforilarea Akt (Serine 473) . (Figurile 3 (a) și 3 (d);). Mai mult, nivelurile de proteine GLUT4 au fost semnificativ crescute de 1,4 până la 2 ori la șoarecii DIO hrăniți cu doza medie și mare de V. vitis-idaea (Figurile 4 (a) și 4 (b);).
valoare ≤ 0,05 diferită semnificativ de grupul CHOW și † indică a
valoare). Acest lucru nu a fost asociat cu o creștere a conținutului hepatic de PPAR-α, un factor de transcripție cheie care controlează oxidarea hepatică a acizilor grași (N.S., Figurile 5 (a) și 5 (d)), nici cu modificări ale p53 acetilat (neilustrat).
- Lingonberry protejează împotriva obezității la șoareci
- HCG Dieta și produse cosmetice și menstruație - Știri despre medicină estetică Știri despre medicină estetică
- Există o relație între hormonul paratiroidian și tulburările legate de obezitate ECE2015 17
- Flămând de gustare Încercați mâncarea pentru bebeluși - The Globe and Mail
- LAY S CLASSIC® Chips de cartofi