Abstract
Cantitatea și calitatea potrivite de aminoacizi (AA) furnizate pacienților cu nutriție parenterală (PN) reduce pierderea de masă musculară, poate păstra sau chiar crește, cu beneficii clinice semnificative. Sunt disponibile mai multe amestecuri industriale PN, astfel încât specialiștii în nutriție să poată alege produsul cel mai apropiat de nevoile pacientului. În cazuri selectate, există posibilitatea personalizării amestecurilor compuse într-o farmacie de spital care să răspundă complet nevoilor nutriționale individuale ale pacienților cu PN. Această revizuire narativă tratează soluțiile AA utilizate în amestecurile PN. De asemenea, sunt raportate fiziologia, metodele de calcul al nevoilor de AA și cerințele de AA și energie sugerate de liniile directoare științifice pentru fiecare tip de pacient.
1. Introducere
În PN, substanțele nutritive sunt administrate intravenos; într-o stare mai fundamentală de bază, printr-o venă periferică sau centrală. Prepararea amestecului de perfuzie utilizează soluții sterile de aminoacizi (AA), glucoză, lipide, apă, electroliți, oligoelemente și vitamine. Amestecurile PN sunt definite ca „standard” dacă sunt preparate industrial cu o compoziție fixă și preambalate (sau cunoscute sub denumirea de „gata de utilizare”) sau „personalizate” dacă sunt compuse într-o farmacie spitalicească pentru nevoile nutriționale specifice ale pacient [13] și pacienți cu insuficiență organică specială (de exemplu, restricție de volum în insuficiența cardiacă, echilibru electrolitic în insuficiență renală cronică); în plus, amestecurile PN personalizate sunt adesea necesare pentru pacienții cu boli critice și/sau grav catabolice, ca și pentru pacienții cu insuficiență intestinală cronică benignă și sugarii născuți prematuri [13]. Această revizuire narativă tratează soluțiile AA utilizate în amestecurile PN. De asemenea, sunt raportate fiziologia, metodele de calcul al nevoilor de AA și cerințele de AA și energie sugerate de ghidurile științifice pentru tipul pacienților.
2. Aminoacizi: fiziologie
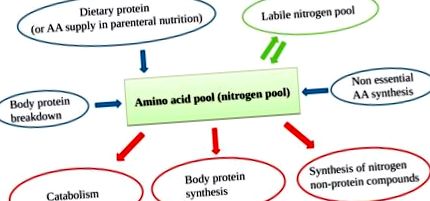
Rezerva de aminoacizi (AA) conține AA care provin din surse dietetice, defalcarea proteinelor, AA neesențiale (NEAA) din sinteza hepatică și rezerva de azot labil. Deoarece corpul nu poate stoca proteine, există o rotație AA continuă, cu o intrare AA constantă care echilibrează ieșirea AA.
Disponibilitatea adecvată a tuturor EAA-urilor (furnizate și din defalcarea proteinelor) îmbunătățește sinteza proteinelor, determinând o stare anabolică [17] (Figura 2).
Reciclare esențială AA (EAA) în cifra de afaceri a proteinelor. Unitățile raportate sunt arbitrare pentru a explica diferențele dintre stările anabolice și catabolice în prezența sau absența furnizării externe de AA.
Este esențial să se ia în considerare faptul că, deși este necesar pentru sinteza proteinelor, NEAA nu pot acționa ca un factor declanșator, diferit de EAA. Din acest motiv, eficacitatea unui anumit aport de azot este legată de EAA, mai degrabă decât de conținutul total de AA [18]. Mai mult, o aprovizionare excesivă cu NEAA (fără o cotă EAA adecvată) ar crește exclusiv catabolismul.
3. Soluții de aminoacizi pentru nutriția parenterală
Atrofia musculară (destul de dificil de inversat) constând în epuizarea musculară a fibrelor striate provoacă slăbiciune, pierderea funcției motorii până la sarcopenie și cașexie [19]. Conservarea masei musculare este unul dintre principalele obiective ale PN; perfuzia intravenoasă de soluții AA păstrează un echilibru pozitiv de azot și promovează sinteza proteinelor musculare. Soluțiile AA standard pentru PN conțin EAA, unele NEAA (pentru a atinge cantitatea necesară de azot) și, ocazional, unele CEAA. În condiții clinice specifice, cum ar fi tulburările AA (de exemplu, erori înnăscute în metabolismul unor AA), pacienții prematuri și bolnavii critici, pot fi necesare soluții AA specializate [20]. În lucrările recente, am arătat că amestecurile PN standard disponibile în comerț, chiar și cu același conținut total de AA, au rapoarte EAA/AA foarte diferite și, în special, un profil EAA puțin probabil (Tabelul 1 și Tabelul 2 și [21]).
tabelul 1
Procentul EAA din totalul AA în mai multe soluții standard de aminoacizi IV disponibile comercial.
| Procentul EAA din totalul AA | 44.4 | 52.4 | 74.9 | 58.4 | 41.2 | 50,8 | 49.3 |
AA: aminoacizi; EAA: aminoacizi esențiali; IV: intravenos.
masa 2
Procentul EAA din totalul AA în mai multe amestecuri parenterale IV complete, all-in-one, care sunt disponibile comercial în Italia.
| Procentul EAA din totalul AA | 51.2 | 43.3 | 48.6 | 45.7 | 51.1 |
AA: aminoacizi; EAA: aminoacizi esențiali; IV: intravenos.
Deși toate amestecurile evaluate la doza obișnuită de 1 g/kg de greutate corporală pe zi îndeplinesc dozele EAA pentru subiecți sănătoși nestresați, sugerate de Organizația Mondială a Sănătății (OMS), Organizația pentru Alimentație și Agricultură a Organizației Națiunilor Unite (FAO) și Universitatea Națiunilor Unite (UNU), în majoritatea cazurilor, conținutul lor de EAA a fost insuficient pentru a garanta o creștere semnificativă a masei musculare la pacienții cu PN; astfel, pentru a obține o doză eficientă de EAA, ar fi necesar să se mărească considerabil doza zilnică de AA totale. În amestecurile AA pentru PN, EAA trebuie să fie de cel puțin 50% din totalul suportului AA și, în special, conținutul de leucină, izoleucină și metionină trebuie să depășească un prag fix pentru a obține un câștig de masă musculară la pacienții cu PN [21] .
Soluția AA ideală capabilă să satisfacă nevoile nutriționale ale tuturor pacienților care necesită PN nu există; într-adevăr, foarte des, trebuie personalizat în funcție de nevoile individuale. Recent, prezența a două NEAA (tirozină și cisteină) în amestecurile de EAA pare a fi crucială [22]. Tirozina este un NEAA numai pentru ficat (și parțial pentru rinichi), în timp ce este un EAA pentru toate celelalte organe/țesuturi lipsite de fenilalanină hidroxilază, enzima care transformă fenilalanina în tirozină. Din acest motiv, adăugarea tirozinei la alte EAA ar îmbunătăți eficacitatea sintezei tirozinei.
Mai multe AA dietetice sunt metabolizate sau transformate în altele în intestin sau ficat la prima trecere. Studiile la animale sugerează că intestinul folosește în principal AA-uri derivate din alimente pentru sinteza proteinelor specifice, în locul celor furnizate de circulația sistemică [23]. De către PN, intestinul este ocolit cu disponibilitatea sistemică redusă a unor AA, rezultând în cele din urmă cererea lor parenterală crescută. Astfel, se pare că fenilalanina și metionina administrate parenteral sunt convertite în tirozină și, respectiv, cisteină, într-o măsură mai mică decât cele ingerate. În special, pacienții cu insuficiență renală și sugarii născuți prematur par să aibă nevoie de amestecuri îmbogățite cu tirozină. Insuficiența renală cronică este asociată cu pierderea activității renale a fenilalaninei hidroxilazei, explicând astfel conversia redusă a fenilalaninei în tirozină [24]. Pentru sugarii născuți prematur, imaturitatea sistemului enzimatic face necesară adăugarea tirozinei în amestecurile pentru PN [25]. Din păcate, tirozina are o solubilitate slabă în apă; în consecință, cantitatea adăugată în amestecurile PN este limitată.
Cisteina adăugată la amestecurile de EAA reduce semnificativ toxicitatea metioninei. Cisteina este sintetizată din metionină cu producerea de homocisteină ca intermediar obligatoriu toxic metabolic. Di Buono și colab. [26] a sugerat că cisteina dietetică poate reduce necesarul exogen de metionină la bărbați. Aceste rezultate susțin existența unui efect de economisire a cisteinei la oameni. Aminoacizii care conțin sulf sunt mai siguri atunci când sunt furnizați cu raporturi stoichiometrice echilibrate de metionină și cisteină. În acest fel, ele speră cererea de folat și reduc la minimum producția de homocisteină derivată de metabolismul metioninei pentru a satisface cerințele de cisteină. Suplimentarea cu cisteină (în doză dublă comparativ cu metionina) în amestecuri de EAA evită supraîncărcarea de homocisteină.
4. Amestec AA specific bolii
În ceea ce privește amestecurile AA specializate, studiul lui Plauth și colab. [27] a sugerat utilizarea soluțiilor AA standard pentru encefalopatiile hepatice de gradul I și II, precum și cele adaptate la ficat de la gradul III la IV. Aceste ultimele amestecuri de AA specializate conțin cantități mari de AA cu lanț ramificat (BCAA) și doze mai mici de AA aromatice (fenilalanină și tirozină), metionină și triptofan. Cu toate acestea, studiile privind eficacitatea BCAA în tratamentul encefalopatiei hepatice au oferit rezultate controversate. În consecință, liniile directoare propuse de Society of Critical Care Medicine (SCCM) și American Society for Parenteral and Enteral Nutrition (ASPEN) [28] au raportat că nu există dovezi care să sugereze că formulările îmbogățite cu BCAA îmbunătățesc rezultatele pacienților comparativ cu întregul standard -proteine la pacienții cu afecțiuni hepatice în stare critică.
Aciditatea intrinsecă a amestecurilor AA este adesea neglijată [38]: acidoză metabolică (pe termen scurt) [39,40] și boala osoasă metabolică (pe termen lung) [41,42] ar putea proveni din administrarea exogenă excesivă și/sau endogenă masivă producerea acizilor nevolatili. Acizii exogeni nevolatili provin din acizi anorganici adăugați la amestecurile PN pentru a susține stabilitatea lor fizico-chimică. Producția de acizi endogeni nevolatili derivă în principal din metabolismul unor AA (cisteină, metionină, lizină, histidină, arginină). Sarcina acidă după administrarea amestecului PN poate fi corectată, adăugând dozele corecte de acizi organici sau sărurile acestora, cum ar fi acetat, gluconat, aspartat sau citrat [38].
5. Cerința de proteine
Corpul uman se poate conforma consumului redus de nutrienți fără consecințe nefaste în anumite limite [48]. După cum sa menționat deja, proteinele din organism suferă o rotație extinsă (defalcarea și sinteza continuă); aminoacizii derivați din descompunerea proteinelor sunt reciclate pentru sinteză nouă sau oxidate sau confiscate inexorabil (Figura 2). În cazul aportului redus de proteine (sau AA), are loc o reutilizare rapidă și mai eficientă a AA endogene cu o rată redusă de oxidare a EAA. După ceva timp, apare o reducere a sintezei și descompunerii proteinelor. Cu aceste mecanisme, organismul se adaptează, până la anumite limite, la un aport redus de AA, prin reducerea pierderilor de azot. După așa-numitele „pierderi obligatorii de azot”, în ciuda continuării unui regim fără proteine, nu este posibil să se limiteze în continuare pierderile de azot [49,50,51,52]. Pierderile obligatorii de azot sunt măsurabile la indivizii care primesc o dietă fără proteine după o scurtă perioadă de adaptare (de obicei 4-5 zile). Aceste pierderi au fost estimate, după cum se arată în Tabelul 3 [53]:
Tabelul 3
Pierderi de azot pe tip de excreție și pe kg de greutate corporală la pacienții adulți sănătoși.
- Nutriție parenterală la domiciliu (HPN) la pacienții cu complicații chirurgicale post-bariatrice -
- Nutriție parenterală hipocalorică la domiciliu și parametri nutriționali la pacienții care au urmat tratament bariatric
- HEAL Reset Nutrition Pre-Holiday - 13 noiembrie 2019! Alimentație sănătoasă Viață activă ™
- Servicii de nutriție și dietă din Maryland
- Cum; s Dieta ta Mâncare antiinflamatorie pentru nutriție optimă Karyn Shanks MD