Fulton T. Crews
1 Bowles Center for Alcohol Studies, School of Medicine, Universitatea din Carolina de Nord, Chapel Hill, Carolina de Nord,
Donita L. Robinson
1 Bowles Center for Alcohol Studies, School of Medicine, Universitatea din Carolina de Nord, Chapel Hill, Carolina de Nord,
L. Judson Chandler
2 Departamentul de Neuroștiințe, Centrul de Cercetare a Alcoolului din Charleston, Charleston, Carolina de Sud,
Cindy L. Ehlers
3 Departamentul de Neuroștiințe, Institutul de Cercetare Scripps, La Jolla, California,
Patrick J. Mulholland
2 Departamentul de Neuroștiințe, Centrul de Cercetare a Alcoolului din Charleston, Charleston, Carolina de Sud,
Subhash C. Pandey
4 Center for Alcohol Research in Epigenetics, Department of Psychiatry, University of Illinois at Chicago and Jesse Brown VA Medical Center, Chicago, Illinois,
Zachary A. Rodd
5 Departamentul de Psihiatrie și Institutul de Cercetări Psihiatrice, Școala de Medicină a Universității Indiana, Indianapolis, Indiana,
Linda P. Spear
6 Centru de cercetare a alcoolului pentru expunerea la dezvoltare, Programul de neuroștiințe comportamentale, Departamentul de Psihologie, Universitatea Binghamton, Binghamton, New York,
H. Scott Swartzwelder
7 Departamentul de Psihiatrie și Științe Comportamentale, Duke University Medical Center, Durham, Carolina de Nord,
Ryan P. Vetreno
1 Bowles Center for Alcohol Studies, School of Medicine, Universitatea din Carolina de Nord, Chapel Hill, Carolina de Nord,
Abstract
AIE persistente - Efecte induse asupra comportamentului
Expunerea la AIE afectează o varietate de măsuri comportamentale, rezumate mai jos și documentate mai detaliat în recenziile recente NADIA (Crews și colab., 2016; Pandey și colab., 2017; Spear, 2015, 2016a, 2016b, 2018; Spear și Swartzwelder, 2014; Varlinskaya și Spear, 2015).
Consumul de alcool
Anxietate
Un alt efect bine documentat al AIE este anxietatea socială sporită la vârsta adultă (Varlinskaya și Spear, 2015), măsurată prin testul de interacțiune socială (File și Seth, 2003). Această constatare este specifică bărbaților (Dannenhoffer și colab., 2018; Varlinskaya și colab., 2014, 2017) și expunerii la EtOH în timpul adolescenței timpurii (P25 până la 45) comparativ cu adolescența târzie (P45 până la 60) (Varlinskaya și colab., 2014). Un comportament sporit de anxietate la vârsta adultă după expunerea la AIE (prin ip, vapori, ig și autoadministrare) a fost, de asemenea, raportat în labirintul crescut plus (Kokare și colab., 2017; Kyzar și colab., 2017; Pandey și colab. ., 2015; Sakharkar și colab., 2016), cutia deschisă - întunecată (Lee și colab., 2017; Pandey și colab., 2015; Sakharkar și colab., 2016; Slawecki și colab., 2004; Vetreno și colab., 2016), testul de îngropare a marmurei (Lee și colab., 2017) și testul în câmp deschis (Coleman și colab., 2014; Vetreno și colab., 2014). Cu toate acestea, aceste descoperiri nu sunt universale, probabil datorate parțial inducerii dezinhibiției, care a fost raportată la animale adulte după vapori și AIE autoadministrată în mai multe studii (Desikan și colab., 2014; Ehlers și colab., 2019, 2013a; Gass și colab., 2014; Gilpin și colab., 2012). În mod specific, este bine cunoscut faptul că expresia comportamentală a anxietății și dezinhibării poate concura în funcție de caracteristicile situației de testare (Ennaceur, 2014). Astfel, dovezile susțin atât anxietatea indusă de AIE, cât și dezinhibarea.
Învățarea și inflexibilitatea comportamentală
„Blocarea” unui fenotip pentru adolescenți
Colectiv, aceste studii comportamentale și cognitive au arătat modificări de lungă durată induse de AIE. O concluzie similară a fost obținută dintr-o revizuire recentă a studiilor efectuate la oameni și la rozătoare, care examinează factorii predispozanți care prezic consumul de alcool la adolescenți și consecințele cognitive, comportamentale și neurobiologice ale expunerii la alcool la adolescenți (Spear, 2018). Datele despre animale, în special, susțin ipoteza că expunerea la alcool asemănătoare cu binge are efecte de lungă durată asupra comportamentului care poate interacționa cu factori care predispun la consumul de adolescenți, dar nu sunt dependenți de aceștia.
Concluzie: expunerea la AIE este suficientă pentru a produce multe caracteristici comportamentale (anxietate, inflexibilitate comportamentală, consum crescut și răspuns modificat la alcool) observate la omul cu tulburare de consum de alcool (AUD). Sunt necesare studii suplimentare pentru a defini în mod clar contribuția abuzului de alcool la adolescenți la AUD.
Modificări persistente în neurobiologia moleculară a adulților după Aie
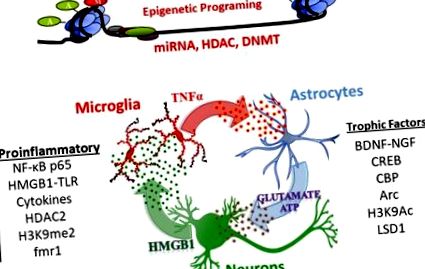
Studiile NADIA au descoperit că AIE modifică persistent reglarea genelor neuroimune, neurotrofice și epigenetice și că acestea sunt mecanisme cheie care stau la baza efectelor AIE asupra fiziologiei și comportamentului adulților (pentru recenzii, vezi Crews și colab., 2017a; Crews și Vetreno, 2016; Crews și colab., 2016; Kyzar și colab., 2016; Pandey și colab., 2017). Aceste mecanisme care implică reglarea epigenetică a expresiei genice și a ARN necodificat, în special microARN, implică semnalizarea între neuroni, astrocite și microglii care schimbă transcrierea, cu creșteri ale transcrierii genelor proinflamatorii și transcrierea redusă a factorilor trofici.
Semnalizare neuroimună
Mecanisme epigenetice
MicroARN (miARN)
MiARN-urile mici sunt eliberate în vezicule și semnalează peste celule, reglând plasticitatea sinaptică (Cohen și colab., 2011). În plus față de implicarea miARN în expresia genelor prin țintirea stabilității ARNm, miARN și alte ARN necodificate participă la semnalizarea neuroimună prin TLR (Coleman și colab., 2017; Crews și colab., 2017b). Studiile efectuate la amigdala la adulți arată că miARN-494 interacționează cu factorii de transcripție CREB și CBP/p300 pentru a regla comportamentele asemănătoare anxietății (Teppen și colab., 2016). Mai mult, un antagomir (blocant miARN) al miARN-494 injectat în amigdală centrală crește CBP/p300 și acetilarea histonei și provoacă efecte anxiolitice similare cu expunerea acută la EtOH la șobolani (Kyzar și colab., 2019b; Teppen și colab., 2016). Un alt mecanism mediat de miARN este activarea recent descoperită a TLR7 de către miARN let7. Nivelurile de TLR7 sunt crescute de expunerea la alcool contribuind la activarea neuroimună (Coleman și colab., 2017) și sunt crescute persistent la adulți după AIE (Crews și colab., 2017b). Astfel, modificările induse de AIE în expresia genelor par să implice multiple mecanisme epigenetice complexe care implică modificări ale factorilor proinflamatori și trofici, precum și genele implicate în remodelarea sinapselor și neurocircuitului.
Concluzie: expunerea la AIE induce creșteri persistente și persistente ale genelor neuroimune proinflamatorii, precum și ale histonei epigenetice și ale enzimelor modificatoare de ADN și ale miARN. La rândul lor, aceste modificări pot contribui la scăderea expresiei genice a factorului trofic care afectează transcriptomul sinaptic al creierului adult.
Modificări induse de Aie în celulele cerebrale adulte și neuroanatomia
Studiile NADIA au descoperit că expunerea la AIE modifică substanța gri și albă regională a creierului adult, neurogeneza creierului, markerii fenotipici colinergici, dopaminergici și serotoninergici, morfologia dendritică, microglia, astrocitele și expresia diferiților transmițători de peptide.
Markeri neuronali
Glia și Glial - Interacțiuni neuronale
Spini dendritici
Neurogeneza
Neurogeneza, formarea de noi neuroni, continuă în hipocampul creierului șobolanului și în zona subventriculară pe tot parcursul adolescenței până la vârsta adultă tânără, oferind un indice de plasticitate cerebrală. La adulți, expunerea la EtOH reduce neurogeneza hipocampului; cu toate acestea, abstinența are ca rezultat restaurarea după câteva săptămâni (Crews și Nixon, 2009). În contrast, adolescenții au niveluri ridicate de neurogeneză hipocampală, care sunt mai sensibili la inhibarea EtOH decât adulții. Studiile NADIA între laboratoare, folosind mai multe căi de administrare a EtOH și tulpini de șobolan, au constatat că AIE scade persistent neurogeneza atât în hipocampus, cât și în zonele subventriculare (Broadwater și colab., 2014; Sakharkar și colab., 2016; Vetreno și Crews, 2015). Mai mult, pierderea indusă de AIE a neurogenezei hipocampice este asociată semnificativ cu creșterea comportamentului dezinhibitor (Ehlers și colab., 2013a). Pierderea persistentă a neurogenezei indusă de AIE reflectă probabil expresia factorului trofic proinflamator și redus AIE (Fig. 1) în hipocamp (a se vedea studiile de prevenire - inversare de mai jos).
Întreg - Structura creierului
Concluzie: expunerea la AIE induce schimbări celulare și anatomice durabile în creierul adult, dintre care multe au fost observate la oameni cu AUD. Aceste schimbări celulare și structurale sunt susceptibile să stea la baza multor consecințe asupra expunerii AIE asupra neurocircuitului și comportamentului.
Aie - Schimbări induse în fiziologie
Consorțiul NADIA a studiat mai multe obiective fiziologice, incluzând fiziologia sinaptică a hipocampului, fiziologia sinaptică a PFC, activitatea electroencefalogramei (EEG), parametrii de somn și conectivitatea cerebrală RMN în stare de repaus și a documentat mai multe efecte specifice și persistente induse de AIE (pentru recenzii, vezi Crews și colab., 2016; Ehlers și Criado, 2010; Spear și Swartzwelder, 2014).
Fiziologie sinaptică
Dopamina și luarea deciziilor
EEG, somn și odihnă - conectivitate de stat
În concordanță cu desincronizarea electrofiziologică după AIE, studiile NADIA au relevat că AIE a scăzut conectivitatea RMN în stare de repaus între subregiunile PFC, precum și între PFC și regiunile striatale (Broadwater și colab., 2018). Constatările la animale sunt de acord cu studiile la om care au raportat o scădere a conectivității în starea de odihnă la AUD pentru adulți (Weiland și colab., 2014) și la adulții tineri cu risc ridicat cu antecedente familiale de AUD (Weiland și colab., 2013). În mod interesant, Broadwater și colegii (2018) au descoperit, de asemenea, că AIE a redus răspunsul de conectivitate acută la provocarea alcoolului, susținând în continuare alte descoperiri ale modificărilor induse de AIE în răspunsurile adulților la alcool. Pierderea de conectivitate corticală indusă de AIE la vârsta adultă este consecventă cu întreruperea luării deciziilor și decizii riscante crescute. Viitoarele studii de conectivitate funcțională sunt de așteptat să integreze concluziile AIE de șobolan ale consorțiului NADIA în studiile emergente privind adolescența umană, oferind legături critice cu mecanismele moleculare care se traduc la oameni.
Concluzie: AIE induce modificări de lungă durată în fiziologia creierului adult. Markerii sinaptici ai hipocampului, precum și GABAAR-urile, canalele de potasiu și LTP sunt modificate. Schimbările PFC și ale circuitului mezolimbic la adulți după AIE sunt legate de deficite cognitive, cum ar fi asumarea de riscuri sporită. Modificările induse de AIE în EEG, ERO, somn și conectivitate funcțională pentru adulți sugerează o interacțiune regională a creierului perturbată care poate reprezenta dezvoltarea tocită a circuitelor corticale.
Prevenirea și inversarea consecințelor AIE
Reducerile induse de etanol intermitent pentru adolescenți (AIE) ale colinei acetiltransferazei (CHAT) sunt prevenite sau inversate prin strategii multiple. Imunoreactivitatea ChAT - număr de celule pozitive (DCX + IR) sunt adaptate din publicațiile Neurobiology of Adolescent Drinking in Adulthood (NADIA) care studiază impactul AIE asupra fenotipului colinergic. Rețineți diferite scale de ordonate. (A) Vetreno și Crews (2018) au expus șobolani la AIE (zi postnatală [P] 25 până la 55, de exemplu) și au evaluat ChAT + IR la P80. Roata voluntară care rulează de la P24 la P80, concomitent și se extinde dincolo de expunerea la AIE, a împiedicat pierderea indusă de AIE de ChAT + IR fără a modifica semnificativ nivelurile șobolanilor de control. (B) Vetreno și colegii (2019) au expus șobolani la AIE (P25 până la 55, de exemplu) și au evaluat ChAT + IR la P95. Roata voluntară care rulează de la P56 la P95, după expunerea la AIE, a inversat pierderea indusă de AIE de ChAT + IR fără a modifica semnificativ nivelurile la șobolanii de control. (C) Vetreno și Crews (2018) au expus șobolani la AIE (zi postnatală [P] 25 până la 55, de exemplu) și au evaluat ChAT + IR la P56, la scurt timp după AIE. Indometacina, un medicament antiinflamator, a fost administrat în timpul AIE (4 mg/kg, i.p.) și a prevenit pierderea indusă de AIE de ChAT + IR.
Concluzie: modificările moleculare, sinaptice, fiziologice și comportamentale induse de AIE pot fi prevenite și/sau inversate prin blocarea inducției genelor proinflamatorii, inhibarea dezacetilării histonelor și/sau prin tratament farmacologic țintit.
Discuție și rezumat
În concluzie, studiile mecaniciste NADIA stabilesc că băuturile excesive ale adolescenților pot induce modificări de lungă durată în expresia genelor creierului, sinapsele, electrofiziologia și morfologia, precum și comportamentul. Ei au identificat mai multe ținte tratabile de droguri care pot fi utile în tratamentul AUD. În cele din urmă, aceste studii oferă sprijin suplimentar pentru importanța sănătății publice a reducerii și prevenirii consumului de alcool minor.
Finanțarea
Consorțiul NADIA este susținut de NIH (U24AA020022, U24AA020024, U24AA024603, U24AA024605, U01AA019925, U01AA019967, U01AA019969, U01AA019970, U01AA0199, U01AA0199.
Conflict de interese
Autorii nu declară niciun conflict de interese.
Mulțumiri
Autorii îi mulțumesc lui Diantha LaVine, MS, CMI, pentru asistența sa cu ilustrații și Jennie Vaughn, MSW, pentru asistența sa în pregătirea manuscrisului.
- Ca și vinul, alcoolul inferior înseamnă mai puține calorii (și poate mult mai mult) HuffPost Life
- Cum vă afectează alcoolul corpul; Fitness; Mașinile Lean
- Modul în care întreprinderile de panificație se pot pregăti pentru modificările etichetelor nutriționale
- Modificări de sănătate care vin la etichetele alimentelor - The Suffolk Times
- Cum pot calcula caloriile în alcool Nutracheck