Sung-Yun Cho
1 Centrul de cercetare pentru dezvoltarea materialelor preventive împotriva cancerului, Colegiul de Medicină Coreeană, Universitatea Kyung Hee, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Seul, Coreea de Sud
Hyo-Jeong Lee
1 Centrul de cercetare pentru dezvoltarea materialelor preventive împotriva cancerului, Colegiul de Medicină Coreeană, Universitatea Kyung Hee, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Seul, Coreea de Sud
Sun-Mi Cho
1 Centrul de cercetare pentru dezvoltarea materialelor preventive împotriva cancerului, Colegiul de Medicină Coreeană, Universitatea Kyung Hee, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Seul, Coreea de Sud
Bonglee Kim
1 Centrul de cercetare pentru dezvoltarea materialelor preventive împotriva cancerului, Colegiul de Medicină Coreeană, Universitatea Kyung Hee, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Seul, Coreea de Sud
Yeon Kwon Jung
2 SeoBong Biobestech Co., 831 Yeoksam-dong, Gangnam-gu, Ltd. Hye Cheon Bldg # 401, 135-080, Seoul, Republica Coreea
Sung-Hoon Kim
1 Centrul de cercetare pentru dezvoltarea materialelor preventive împotriva cancerului, Colegiul de Medicină Coreeană, Universitatea Kyung Hee, 1 Hoegi-dong, Dongdaemun-gu, 130-701, Seul, Coreea de Sud
Abstract
fundal
Deși Mica, o substanță subțire și minerală, a fost folosită ca medicament mineral pentru tratamentul sângerării, dizenteriei și inflamației în medicina tradițională, inclusiv în Ayurveda, dovezile biologice ale Mica nu au fost clarificate până acum. Astfel, în prezentul studiu, mecanismul antitumoral al Mica particulei (STB-HO) a fost examinat în cazurile de cancer colorectal.
Metode
Șoarecii nud athimici au fost inoculați cu celule canceroase de colon HCT116 și administrate oral STB-HO zilnic timp de 41 de zile, iar HCT116 și celule endoteliale ale venei ombilicale umane (HUVEC) au fost tratate cu STB-HO timp de 0
24 de ore pentru efectuarea imunoblotării, testul de citotoxicitate, analiza FAC și măsurarea secreției de matrice metaloproteinază 9 (MMP-9) și alte experimente. Diferențe semnificative ale tuturor datelor au fost evaluate folosind testul t Student și un test post-comparație multiplă Turkey-Kramer.
Rezultate
STB-HO a suprimat în mod semnificativ volumul și greutatea tumorii la șoarecii goi atimici inoculați cu celule HCT116 la o doză de 100 mg/kg. Astfel, mecanismul antitumoral in vivo al STB-HO a fost elucidat și in vitro. STB-HO a exercitat citotoxicitate în celulele cancerului colorectal HCT116, SW620 și HCT15. De asemenea, STB-HO a crescut populația de celule G1 într-un mod dependent de timp și concentrație, a îmbunătățit expresia p21, p27, p53 ca inhibitori ai kinazei dependente de ciclină (CDK), a atenuat expresia antigenului nuclear celular proliferant (PCNA) și a ciclinei D1 și a redus, de asemenea, producția factorului de creștere endotelial vascular (VEGF) și a matricei metaloproteinazei 9 (MMP-9) în celulele HCT116. În mod consecvent, STB-HO a suprimat fosforilarea VEGFR2 în celulele HCT116, SW620 și HCT15. De asemenea, STB-HO a inhibat proliferarea mediată de VEGF și a atenuat și fosforilarea VEGFR2 și Akt în celulele endoteliale ale venei ombilicale umane (HUVEC).
Concluzii
Colectiv, aceste descoperiri sugerează că STB-HO are potențial chimiopreventiv prin stoparea G1 și inhibarea proliferării și VEGFR2 în celulele cancerului colorectal HCT116.
fundal
Cancerul colorectal (CRC) este una dintre principalele cauze de mortalitate în lumea occidentală. Chimioterapia, inclusiv terapia cu 5-fluorouracil (5-FU) și rezecția chirurgicală sunt metode bine cunoscute pentru tratamentul cancerului de colon [1]. Cu toate acestea, efectele secundare sunt induse de chimioterapie, cum ar fi mucozita bucală, diareea, neuropatia, anemia și alopecia [2]. Astfel, recent s-a raportat că produsele naturale [3] și compușii [4-6] au efecte antitumorale numai în cazurile de cancer colorectal sau în combinație cu agenți anticancer [7] cu toxicitate scăzută. De asemenea, Hu și colab. a sugerat că în rândul bărbaților și femeilor care iau suplimente de vitamine și minerale timp de mai mult de 5 ani, asocierile invers semnificative cu cancerul de colon au fost cele mai pronunțate în rândul femeilor cu cancer de colon distal [8]. În mod similar, există dovezi că seleniul mineral are activitate antitumorală în cancerele de colon [9-12].
Grupul Mica al mineralelor din silicat de tablă este clasificat, în general, ca Mica trioctaedrică, incluzând Biotit, Lepidolit, Moscovit, Flogopit, Zinnwaldit și Mica cu deficit de strat intermediar [13]. Mica a fost folosită pentru decorare și tratament pentru sângerări, dizenterie și inflamații în medicina tradițională, inclusiv Ayurveda, de vârste. Nasrin și colab. nu a prezentat toxicitate pentru Chondrokola Rosh, un preparat ayurvedic metalic tradițional, incluzând diverse metale prăjite (Hg și Cu), nemetalice (sulf și Mica) și plante medicinale [14]. De asemenea, Mica era cunoscută pentru protejarea mucoasei gastrice prin îmbunătățirea fluxului sanguin și a răspunsului inflamator [15], precum și pentru suprimarea cancerului gastric prin reglarea p16 și Bcl-2 la șobolani [16], indicând că Mica poate fi utilizată ca medicament [17]. Astfel, în prezentul studiu, mecanismul antitumoral al Mica particulei (STB-HO) a fost examinat in vitro în celulele endoteliale ale cancerului colorectal HCT116 și ale venelor ombilicale umane (HUVECs) și șoarecii nudi atimici inoculați cu celule HCT116.
Metode
Substanțe chimice și reactivi
Cultură de celule
Celulele SW620 (ATCC CCL-227 ™), HCT116 (ATCC CCL-247 ™) și celulele HCT15 (ATCC CCL-225 () au fost însămânțate pe plăci Falcon de 100 mm la 2 × 106 celule/ml în RPMI 1640 suplimentat cu 10% FBS și 1% penicilină/streptomicină. Celulele au fost cultivate la 37 ° C într-o atmosferă umidificată conținând 5% CO2 până la 60-80% confluență și apoi utilizate pentru analiza Western blot. STB-HO a fost tratat cu diferite celule umane de cancer de colon timp de 24, 48, 72 și 96 de ore. HUVEC au fost menținute în M199 plus 20% ser fetal bovin inactivat termic (FBS), 3 ng/ml bFGF, 5 unități/ml heparină, 100 unități/ml soluție antibiotică-antimicotică (M199 complet) în baloane acoperite cu gelatină 0,1% și incubate 37 ° C într-o atmosferă umidificată conținând 5% CO2. Odată confluente, celulele au fost detașate prin soluție de tripsină-EDTA și utilizate în experimente de la pasajele al treilea până la al șaselea.
Test de citotoxicitate
Citotoxicitatea STB-HO a fost evaluată prin testul bromurii de 3- (4,5-dimetiltiazol-2-il) -2,5-difenil tetrazoliu (MTT). Pe scurt, HUVEC-urile au fost însămânțate pe microplăci cu 96 de godeuri acoperite cu gelatină 0,1% la o densitate de 5 × 103 celule per godeu și tratate cu diferite concentrații de STB-HO (0, 15,63, 31,25, 62,5,125, 250, 500 sau 1000 μg/ml) timp de 48 de ore. După timpii de incubație indicați, s-a adăugat soluție MTT (1 mg/ml) (Sigma Chemical Co., St. Louis, MO) timp de 2 ore și s-a adăugat tampon de liză MTT (20% SDS și 50% dimetilformamidă) peste noapte. Densitatea optică (DO) a fost măsurată folosind un cititor de microplăci (TECAN, Austria) la 570 nm. Viabilitatea celulară a fost calculată ca procent de celule viabile în grupul tratat cu STB-HO comparativ cu controlul netratat prin următoarea ecuație.
Test de proliferare
Proliferarea celulară în celulele HCT116 cu STB-HO a fost evaluată așa cum este descris utilizând kitul ELISA pentru proliferarea celulară (Roche, elvețian), conform instrucțiunilor producătorului. Pe scurt, după 48 de ore de tratament cu STB-HO, celulele au fost adăugate cu 10 μl/godeu de soluție de bromodeoxiuridină (BrdU) și reincubate timp de 2 ore la 37 ° C. Apoi, soluția de BrdU a fost îndepărtată și 200 pl de FixDenat au fost adăugați la fiecare godeu. După incubare timp de 30 de minute la temperatura camerei, soluția FixDenat a fost îndepărtată și s-au adăugat 100 pl de soluție de lucru anti-BrdU-POD în fiecare godeu. După spălare cu PBS de trei ori, s-au adăugat 100 pl de soluție de substrat la fiecare godeu și densitatea optică a fost măsurată la 450 nm folosind un cititor de microplăci (Molecular Devices Co., Sunnyvale, CA, SUA). Toate probele au fost preparate în triplicate și testul a fost repetat de cel puțin trei ori.
Analiza ciclului celular
Celulele HCT116 au fost tratate cu STB-HO (250 și 500 μg/ml) timp de 24, 48 și 72 h. Celulele au fost fixate în etanol 75% la -20 ° C și tratate cu RNază A (10 mg/ml) timp de 1 oră la 37 ° C, colorate cu iodură de propidiu (PI) (50 μg/ml) și analizate pentru conținutul de ADN de FACSCalibur (Becton - Dickinson, Franklin Lakes, NJ, SUA) utilizând software-ul CellQuest (BD Bio-sciences, San Jose, CA, SUA).
Western blot
Celulele (5 × 106 celule) tratate cu STB-HO au fost lizate utilizând tampon de liză (50 mM Tris - HCI, pH 7,4, 300 mM NaCI, 0,5% Triton X-100, 0,1% SDS, 5 mM EDTA și protează inhibitor de cocktail). Extractele au fost incubate pe gheață timp de 30 de minute și apoi centrifugate la 13.000 × g timp de 30 de minute la 4 ° C și supernatanții au fost colectați pentru Western Blot. Concentrațiile de proteine au fost determinate prin testul Bradford (Bio-Rad), iar cantități egale de proteine (30 μg) au fost separate prin electroforeză electrodoreză pe gel de dacil sulfat de poliacrilamidă (SDS-PAGE) și transferate în membranele PVDF (Amersham Biosciences, Piscataway, NJ, STATELE UNITE ALE AMERICII). Membranele au fost blocate cu lapte degresat 5% în soluție salină tamponată cu Tris conținând 0,1% Tween 20 timp de 2 ore la temperatura camerei. Membranele au fost sondate peste noapte la 4 ° C cu β-actină anti-umană de șoarece (1: 1000; Sigma Aldrich, St. Louis, MO, SUA), anti-uman pAKT, AKT, p21, p27, p53, pp53, ciclină D1, PCNA și PI3K (1: 1000; Semnalizare celulară, Danvers, MA, SUA), anti-uman VEGFR2 și pVEGFR2 (1: 500; Santa Cruz Biotechnology, CA, SUA) urmate de spălare și incubare cu anticorp secundar conjugat HRP AbD Serotec, Raleigh, NC, SUA). Benzile imunoreactive au fost vizualizate folosind sistemul ECL (Amersham-Pharmacia, Seoul, Coreea).
Măsurarea producției de VEGF și MMP-9 de către ELISA
Nivelurile VEGF și MMP-9 în celulele HCT116 tratate cu STB-HO au fost măsurate folosind kitul ELISA VEGF și MMP-9 (Invitrogen, Carlsbad, CA, SUA) conform instrucțiunilor producătorului. Pe scurt, supernatanții de cultură au fost adăugați pe o microplacă cu 96 de godeuri și incubați timp de 2 ore la temperatura camerei. Placa a fost apoi spălată de patru ori cu tampon de spălare și 100 pl de biotină conjugat au fost plasate în fiecare godeu timp de 1 oră la temperatura camerei. După spălare de patru ori cu tampon de spălare, 100 pl din cromogen stabilizat au fost plasate în fiecare godeu și incubate timp de 30 de minute la temperatura camerei în întuneric. În cele din urmă, s-au adăugat 100 μl de soluție stop la fiecare godeu și densitatea optică a fost măsurată la 450 nm folosind un cititor de microplăci (Molecular Devices Co., Sunnyvale, CA, SUA).
Model cu xenogrefă HCT116
Analize de date
Datele au fost prezentate ca medii ± SE. Diferențe semnificative au fost evaluate folosind testul t Student și un test post-comparație multiplă Turkey-Kramer.
Rezultate
STB-HO suprimă creșterea tumorii în modelul de xenogrefă HCT116
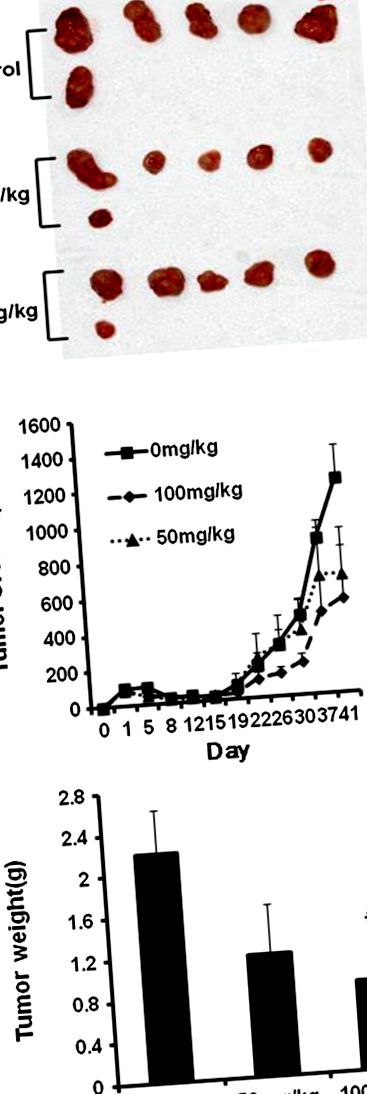
Așa cum se arată în Figura 1 B, STB-HO a suprimat creșterea celulelor canceroase HCT116 inoculate în șoareci nudi BALB/c atimici la doze de 50 și 100 mg/kg fără a afecta greutatea corporală (datele nu sunt prezentate). În mod consecvent, Tratamentul cu STB-HO a redus greutatea tumorii într-o manieră dependentă de doză comparativ cu grupul netratat după sacrificarea animalelor, dar semnificația statistică a fost recunoscută numai între grupul de control și grupul tratat cu STB-HO (100 mg/kg) (Figura 1 A, C ).
Efectul STB-HO asupra greutății tumorii și a creșterii la șoarecii nud atimici inoculați de celulele HCT116. De la trei zile după inocularea celulelor HCT116, STB-HO (50 și 100 mg/kg greutate corporală) a fost administrat oral pe zi. (A) Fotografii ale tumorilor disecate la șoareci. (B) Creșterea tumorii într-un curs de timp. (C) Greutatea finală a tumorii la încheierea experimentului. Valorile au fost medii ± SD, n = 6. * p 2 A, STB-HO a suprimat în mod semnificativ proliferarea celulară în celulele canceroase de colon uman. În special, suprimarea proliferării celulare prin tratamentul STB-HO a fost mai eficientă în celulele canceroase HCT 116 comparativ cu alte celule canceroase colorectale, cum ar fi celulele SW620 și HCT15. În mod consecvent, testul BrdU a dezvăluit, așa cum se arată în Figura 2 B, proliferarea celulelor HCT116 a fost redusă într-o manieră dependentă de concentrație prin tratamentul STB-HO, ceea ce implică faptul că STB-HO inhibă proliferarea celulelor cancerului colorectal.
Efectul STB-HO asupra morfologiei celulelor HCT116, SW620 și HCT15 și proliferării celulelor HCT116. (A) STB-HO a fost tratat cu celule HCT116, SW620 și HCT15 timp de 96 de ore, iar imaginile sale celulare au fost luate cu ajutorul unui microscop (X200). (B) Celulele HCT116 au fost tratate cu STB-HO timp de 48 de ore și proliferarea celulară a fost măsurată folosind kitul ELISA de proliferare BrdU (Roche, elvețian).
STB-HO induce oprirea G1 în celulele cancerului colorectal HCT116
Analiza ciclului celular a fost efectuată pentru a afla efectul STB-HO în celulele canceroase HCT116. STB-HO a crescut semnificativ populația G1 în celulele HCT116 într-un mod dependent de timp (Figura 3 A). La o zi după tratamentul cu STB-HO, expresia p21, p27 și pp53 ca inhibitori CDK a fost semnificativ crescută în celulele HCT116 (Figura 3 B). În plus, STB-HO a suprimat expresia ciclinei D1 și PCNA care reglează ciclul celular (Figura 3 B). Aceste date indică faptul că STB-HO induce arestarea G1, care este crucială pentru a inhiba proliferarea și a induce apoptoza în celulele canceroase colorectale HCT116.
Efectul STB-HO asupra pVEGFR2, PI3K și Akt în celulele cancerului de colon. (A) Expresia bazală a pVEGFR2 a fost confirmată în diferite celule de cancer de colon prin Western blot. (B) STB-HO (0, 250 sau 500 μg/ml) a fost tratat în celule canceroase de colon HCT15, SW620 și HCT116 timp de 24 de ore. Western blot a fost efectuat pentru a determina expresia pVEGFR2, VEGFR2, PI3K, pAKT, AKT și β-actină în celule de cancer de colon tratate cu STB-HO.
STB-HO inhibă proliferarea și fosforilarea mediată de VEGF a VEGFR2 și Akt în HUVECs
Așa cum se arată în Figura 6 A, testul MTT a dezvăluit că STB-HO nu a prezentat nicio citotoxicitate în HUVEC ca linie celulară normală. De asemenea, pentru a confirma activitatea antiangiogenă a STB-HO în HUVECs, testul de proliferare a fost efectuat în HUVECs tratați cu VEFG prin testul MTT. Așa cum se arată în Figura 6 B, STB-HO a inhibat proliferarea HUVEC indusă de VEGF într-o manieră dependentă de doză la concentrații netoxice în HUVEC. În plus, așa cum se arată în Figura 7, STB-HO a suprimat fosforilarea VEGFR-2 și Akt în HUVEC comparativ cu controlul netratat.
- Obezitatea și vârsta afectează potențialul de fertilitate masculină - ScienceDirect
- Obezitatea ca factor de risc potențial pentru adenocarcinoame și carcinoame cu celule scuamoase ale uterului
- Metabotipare în perspectivă-O strategie potențială de nutriție personalizată pentru prevenirea cu precizie a
- Semnalele neuronale reglează proliferarea celulelor β induse de obezitate prin mecanismul dependent de FoxM1 - PubMed
- Tratamentul obezității cu microbiota fecală arată potențialul, spune studiul