Ekaterina Zhurakovskaya
1 A. I. Institutul Virtanen pentru Științe Moleculare, Universitatea Finlandei de Est, Kuopio, FI-70211, Finlanda
Juuso Leikas
2 Școala de farmacie, Universitatea din Finlanda de Est, Kuopio, FI-70211, Finlanda
Tiina Pirttimäki
1 A. I. Institutul Virtanen pentru Științe Moleculare, Universitatea Finlandei de Est, Kuopio, FI-70211, Finlanda
Francesc Casas Mon
2 Școala de farmacie, Universitatea din Finlanda de Est, Kuopio, FI-70211, Finlanda
Mikko Gynther
2 Școala de farmacie, Universitatea din Finlanda de Est, Kuopio, FI-70211, Finlanda
Rubin Aliyev
3 Institutul de Fizică și Tehnologie din Moscova, 117303, Moscova, Rusia
4 Institutul de biofizică teoretică și experimentală, 142292, Puschino, Rusia,
Tomi Rantamäki
5 Laboratorul de Neuroterapie, Divizia de Farmacologie și Farmacoterapie, Facultatea de Farmacie, Universitatea din Helsinki, Helsinki, FI-00790, Finlanda
Heikki Tanila
1 A. I. Institutul Virtanen pentru Științe Moleculare, Universitatea Finlandei de Est, Kuopio, FI-70211, Finlanda
Markus M. Forsberg
2 Școala de farmacie, Universitatea din Finlanda de Est, Kuopio, FI-70211, Finlanda
Olli Gröhn
1 A. I. Institutul Virtanen pentru Științe Moleculare, Universitatea Finlandei de Est, Kuopio, FI-70211, Finlanda
Jaakko Paasonen
1 A. I. Institutul Virtanen pentru Științe Moleculare, Universitatea Finlandei de Est, Kuopio, FI-70211, Finlanda
Aaro J. Jalkanen
2 Școala de farmacie, Universitatea din Finlanda de Est, Kuopio, FI-70211, Finlanda
E.Z., J.L., T.P., M.M.F., O.G., J.P. și A.J.J. cercetare proiectată; E.Z., J.L., F.C.M., M.G., J.P. și A.J.J. cercetări efectuate; E.Z., J.L., M.G., J.P. și A.J.J. date analizate; E.Z., J.L., T.P., M.G., R.A., T.R., H.T., M.M.F., O.G., J.P. și A.J.J. a scris ziarul.
Abstract
Declarație de semnificație
Tulburările din schemele de somn și mișcarea rapidă a ochilor (REM) tulburarea comportamentului somnului sunt printre primele simptome ale bolii Parkinson (PD). Cu toate acestea, tulburările de somn legate de PD au fost practic neexplorate la modelele animale. Acesta este un prim studiu care a examinat conectivitatea funcțională (FC) în timpul stărilor asemănătoare somnului induse de uretan în modelul parțial striatal 6-OHDA leziune șobolan din PD în stadiu incipient utilizând imagistica prin rezonanță magnetică funcțională (fMRI). Am constatat că FC a fost redusă semnificativ la animalele cu leziuni 6-OHDA, dar numai în timpul stării asemănătoare REM. Aceste modificări au afectat atât emisferele lezate, cât și cele intacte, implicând în principal conexiuni corticocorticale și corticostriatale. Rezultatele sugerează că acest model de șobolan este un instrument promițător pentru studierea tulburărilor de somn în stadiul incipient al PD cu RMN în stare de repaus.
Introducere
Boala Parkinson (PD) este a doua cea mai frecventă boală neurodegenerativă și cea mai frecventă tulburare de mișcare care afectează 1% din populația lumii după vârsta de 70 de ani (Pringsheim și colab., 2014). O degenerare treptată și pierderea neuronilor dopaminergici în substanța nigra pars compacta a creierului mediu sunt semnele patologice care duc la epuizarea dopaminei striatale (DA), rezultând simptome motorii progresive, inclusiv bradikinezie, rigiditate și tremor de repaus, care sunt caracteristice PD (Schapira, 2009). În plus față de simptomele motorii, pacienții cu PD suferă de o varietate de simptome non-motorii, inclusiv tulburări de somn, disfuncție olfactivă, durere, depresie, anxietate, comportament impulsiv și tulburări cognitive, care afectează semnificativ calitatea vieții pacientului (Titova și Chaudhuri, 2017).
Pacienții cu PD pot prezenta o varietate de tulburări de somn, cum ar fi sindromul picioarelor neliniștite, mișcarea rapidă a ochilor (REM), tulburarea comportamentului somnului (RBD), fragmentarea somnului și insomnia (franceză și Muthusamy, 2016). Deoarece tulburările de somn apar cu câțiva ani înainte de apariția deficitelor motorii (Bargiotas et al., 2016), acestea au fost considerate ca un marker timpuriu pentru PD. În special, prezența RBD reprezintă un risc considerabil crescut de a dezvolta PD (Postuma și colab., 2013). Pacienții cu PD cu RBD au depozit crescut de α-sinucleină (Postuma și colab., 2015), simptome motorii inițiale mai severe și necesită doze mai mari de levodopa pe măsură ce boala progresează (Chung și colab., 2017). Este remarcabil faptul că modificările organizațiilor din rețeaua creierului au fost asociate cu RBD chiar înainte de apariția unei tulburări motorii evidente în PD (Ellmore și colab., 2013). Astfel, este necesar un model experimental care să mimeze tulburările de somn timpurii în evaluarea tratamentelor potențiale pentru aceste tulburări și poate reprezenta, de asemenea, o nouă abordare pentru testarea unor tratamente noi care modifică boala pentru PD în stadiu incipient.
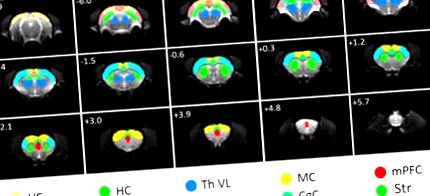
ROI utilizate pentru analiza FC. ROI-urile sunt suprapuse pe imagini RMN funcționale cu ecoplanare spin-original. AC, cortex auditiv; CgC, cortex cingulat; HC, hipocamp; MC, cortex motor; mPFC, cortexul prefrontal medial; RC, cortex retrosplenial; SC, cortex somatosenzorial; Str, striatum; Th VL, talamus lateral ventral; VC, cortex vizual. Distanța până la bregma în milimetri este marcată în colțul din stânga sus al fiecărei felii.
Pentru a obține măsuri pentru FC, coeficienții de corelație parțială dintre ROI (sau ROI și voxeli în hărțile de corelație) au fost calculați utilizând MATLAB. Toți cei șase parametri de corecție a mișcării, obținuți cu SPM, au fost folosiți ca regresori în calculele de corelație pentru a minimiza efectul mișcării asupra rezultatelor.
Evaluarea stărilor de somn și FC
Fluctuațiile ratei de respirație în timpul RMN-ului au fost utilizate ca măsuri indirecte pentru a detecta stările spontane de somn, așa cum este descris de (Wilson și colab., 2011; Pagliardini și colab., 2012). Statele cu rate de respirație ridicate și scăzute au fost etichetate manual ca stări de somn asemănătoare REM și, respectiv, non-REM (NREM). Animalele cu tranziții între starea NREM-like și REM-like au fost incluse în analiza stării de somn. Datele fMRI etichetate de stat au fost împărțite în ferestre cu dimensiuni de 30 de volume. Coeficienții de corelație parțială etichetați de stat au fost calculați pentru fiecare fereastră și ulterior mediatizați la fiecare subiect. Dacă un animal nu a avut cel puțin 90 de volume fMRI de stare asemănătoare somnului în total, acesta a fost exclus din analiza stării somnului.
Disecția probelor de creier și analize biochimice
Rapoartele DA striatale, GABA și glutamat au fost calculate cu ecuația Clesioned side/Cintact side.
analize statistice
Apoi, am comparat starea de repaus FC obținută din întreaga perioadă de măsurare fMRI între grupurile de leziune 6-OHDA și grupul de control. Această analiză nu a evidențiat diferențe semnificative în FC între animalele 6-OHDA lezate și animale de control în conectivitatea generală; au fost observate doar tendințele către FC crescută de la talamusul lateral ventral drept la stâng (p = 0,048, nu corectat cu FDR) și de la talamusul lateral ventral drept la cortexul cingulat (p = 0,040, nu corectat cu FDR). În plus, a existat o tendință spre scăderea FC de la striatul ipsilateral la cel contralateral (p = 0,047, nu corectat cu FDR). Cu toate acestea, după corecții pentru comparații multiple, aceste tendințe devin nesemnificative.
FC în diferite stări de somn
Faptul că somnul REM este o stare mai activă și mai solicitantă de energie (Steriade și Hobson, 1976; Franzini, 1992; Lenzi și colab., 2000) decât somnul NREM și propunerea că tulburările de somn asociate REM-somn sunt simptome timpurii ale progresului neurodegenerarea la pacienții cu PD (Heller și colab., 2017) ne-a determinat să separăm stările de somn REM și NREM în analiza noastră rsfMRI. Pe baza fluctuațiilor ratei de respirație (Wilson și colab., 2011), am observat modificări clare ale stării între starea REM și starea NREM la animalele de control 8/19 și la animalele cu leziuni 8/18. La restul animalelor, a fost observată o singură stare de somn și au fost excluși din analiza FC a stării de somn. Lipsa tranzițiilor stării de somn la aproximativ jumătate din animale poate fi explicată prin diferențe în profunzimea anesteziei (Gretenkord și colab., 2016) sau factori care influențează funcția respiratorie, cum ar fi temperatura mediului (Whitten și colab., 2009 ) sau oxigen inhalat (Pagliardini și colab., 2013; Hauer și colab., 2018). Duratele medii pentru stările REM și NREM au fost de 99 ± 80,4 și respectiv 78,6 ± 70,8 s. Nu au existat diferențe semnificative în duratele stării dintre animalele martor și leziunile cu 6-OHDA (p = 0,96 pentru stările asemănătoare REM, p = 0,84 pentru stările asemănătoare NREM, testul t nepereche).
Analizele pe bază de semințe voxelwise, obținute din cortexul motor ipsilateral și striat (Fig. 5), ilustrează întreruperile striatocorticale extinse induse de 6-OHDA și ulterioare corticocorticale în FC în timpul stării de somn REM. Nu s-au observat diferențe în timpul stării asemănătoare NREM (datele nu sunt prezentate).
- Ghid de sănătate naturală - ierburi care stimulează memoria și creierul
- Supraalimentarea poate fi o problemă a creierului în America, patch-ul SUA
- Tratamentul neuroplasticității Cum vă poate ajuta să vă recuperați după o leziune cerebrală
- Reconectați-vă creierul pentru pierderea în greutate (partea V) Nu mai numărați calorii; Georgie Fear
- Cumpărați pastile pentru cele mai sănătoase diete (Best Diet) Pastile pentru pierderea grăsimilor extreme BRAIN VISTEC