Florian Grahammer
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
Suresh K. Ramakrishnan
† Institutul de Anatomie, Departamentul de Medicină, Universitatea din Fribourg, Fribourg, Elveția;
Markus M. Rinschen
‡ Departamentul II de Medicină Internă și Centrul de Medicină Moleculară Köln, Universitatea din Köln, Köln, Germania;
Alexey A. Larionov
† Institutul de Anatomie, Departamentul de Medicină, Universitatea din Fribourg, Fribourg, Elveția;
Maryam Syed
† Institutul de Anatomie, Departamentul de Medicină, Universitatea din Fribourg, Fribourg, Elveția;
Hazim Khatib
§ Departamentul Medical IV, Sektion Nieren- und Hochdruckkrankheiten, Universitatea din Tübingen, Tübingen, Germania;
Malte Roerden
§ Departamentul Medical IV, Sektion Nieren- und Hochdruckkrankheiten, Universitatea din Tübingen, Tübingen, Germania;
Jörn Oliver Sass
‖ Bioanalitică și Biochimie, Departamentul de Științe ale Naturii, Universitatea de Științe Aplicate Bonn Rhein Sieg, Rheinbach, Germania;
¶ Divizia de Chimie Clinică și Biochimie și Centrul de Cercetare pentru Copii, Spitalul Universitar de Copii Zürich, Zurich, Elveția;
Martin Helmstaedter
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
Dorothea Osenberg
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
Lucas Kühne
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
Oliver Kretz
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
Nicola Wanner
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
Francois Jouret
** Grupul interdisciplinar de genoproteomică aplicată, științe cardiovasculare, Universitatea din Liège, Liege, Belgia; și
Thomas Benzing
‡ Departamentul II de Medicină Internă și Centrul de Medicină Moleculară Köln, Universitatea din Köln, Köln, Germania;
Ferruh Artunc
§ Departamentul Medical IV, Sektion Nieren- und Hochdruckkrankheiten, Universitatea din Tübingen, Tübingen, Germania;
Tobias B. Huber
* Departamentul de Medicină IV, Centrul Medical - Universitatea din Freiburg, Facultatea de Medicină, Universitatea din Freiburg, Freiburg, Germania;
†† BIOSS, Centrul pentru Studii de Semnalizare Biologică și
‡› FRIAS, Institutul de Studii Avansate din Freiburg și ZBSA, Centrul pentru Analiza Sistemelor Biologice, Universitatea Albert Ludwigs din Freiburg, Freiburg, Germania
Franziska Theilig
† Institutul de Anatomie, Departamentul de Medicină, Universitatea din Fribourg, Fribourg, Elveția;
Date asociate
Abstract
Celulele tubulare proximale renale reciclează în mod constant nutrienții pentru a asigura pierderea minimă a substraturilor vitale în urină. Deși majoritatea mecanismelor de transport au fost descoperite la nivel molecular, se știe puțin despre factorii care reglementează aceste procese. Aici, arătăm că mTORC1 și mTORC2 reglează în mod specific și sinergic procesele de endocitoză și transport PTC. Folosind o abordare genetică condiționată a șoarecilor pentru a dezactiva subunitățile non-redundante ale mTORC1, mTORC2 sau ambele, am arătat că șoarecii lipsiți de mTORC1 sau mTORC1/mTORC2, dar nu și mTORC2, dezvoltă un sindrom asemănător Fanconi de glucozurie, fosfaturie, aminoacidurie, proteine cu greutate moleculară mică și albuminurie. Interesant este că proteomica și fosfoproteomica cortexului renal proaspăt izolat au identificat fie expresia redusă, fie pierderea fosforilării la reziduurile critice ale diferitelor clase de proteine de transport specifice. Funcțional, acest lucru a dus la un transport redus de nutrienți și la o perturbare profundă a mașinilor endocitice, în ciuda expresiei absolute păstrate a principalilor receptori de scurgere, MEGALIN și CUBILIN. Descoperirile noastre evidențiază o nouă rețea de reglementare dependentă de mTOR pentru transportul nutrienților în celulele tubulare proximale renale.
Omologul de mamifer al TOR1 (mTORC1) și mTORC2 sunt complexe intracelulare multiproteice care reglementează funcțiile celulare specifice țesutului. 10 Proteina asociată regulatoare a țintei rapamicinei la mamifere (RAPTOR) este importantă pentru a asambla ținta mamiferelor a rapamicinei (mTOR) complexul 1, iar funcția sa poate fi blocată de rapamicină. În schimb, mTORC2, care conține însoțitorul insensibil de rapamicină al țintei de rapamicină la mamifere (RICTOR) ca proteină de schelă, pare a fi insensibil la tratamentul cu rapamicină pe termen scurt. 11 mTORC1 integrează o mare varietate de semnale, inclusiv factori de creștere, aminoacizi, conținut de energie celulară și stres celular, pentru a regla creșterea și divizarea celulară, precum și biogeneza lipidică și mitocondrială. 12, 13 Gama largă de ținte de fosforilare mTORC1 este încă incomplet definită, dar pare să varieze într-o manieră specifică celulei. În schimb, mTORC2 pare să fie activat de insulină și căile conexe și controlează mai multe kinaze AGC din aval prin fosforilarea motivului lor hidrofob. 14, 15 Prin urmare, mTORC2 ar putea juca un rol important în supraviețuirea celulelor și în organizarea citoscheletului.
Pentru a investiga efectul semnalizării controlate mTOR în funcția PT, am generat șoareci inducibili condiționat Raptor, Rictor sau dublu knock-out în celulele tubulare renale de-a lungul nefronului.
Rezultate
Pierderea mTOR în celulele PT are ca rezultat un fenotip de tip Fanconi
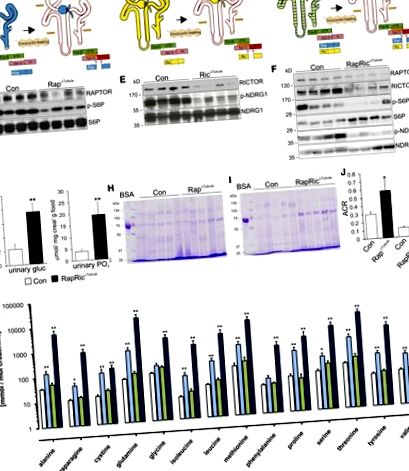
În comparație cu șoarecii martor, animalele Rap Δ Tubule și RapRic Δ Tubule au prezentat aporturi semnificativ mai mari de alimente și lichide, care au fost asociate cu creșterea volumului urinar și a excreției de sodiu (Tabelul suplimentar 1). Nu s-au găsit modificări la animalele Ric Δ Tubule. Împreună, aceste date arată un defect semnificativ dependent de mTORC1 în reabsorbția tubulară a glucozei, fosfatului, aminoacizilor, proteinelor LMW și albuminei.
mTOR Reglează endocitoza PTC și traficul intracelular in vivo
Pierderea rezultatelor mTOR în topologia membranei plasmatice apicale modificate cu o suprafață de reabsorbție redusă in vivo
Au fost efectuate analize microscopice cu lumină și electronice pentru a corela funcția PT redusă cu modificările morfologice. Acid periodic - colorarea Schiff pe secțiuni de parafină a dezvăluit microviliți cu membrană de margine de perie (BBM) redusă la toți șoarecii knockout transgenici, ceea ce a fost cel mai evident la Rap Δ Tubule și RapRic Δ Tubule comparativ cu animalele martor (Figura 3A). Totuși, morfologia brută generală a rămas neschimbată, așa cum se arată în secțiunile de semitină colorate cu albastru de metilen (Figura 3B). Analiza microscopiei electronice subcelulare a segmentelor PT S1 la șoarecii Rap Δ Tubule și RapRic Δ Tubule a arătat o lungime redusă a microvililor și formarea de vezicule endosomale comparativ cu animalele de control, precum și un număr redus de mitocondrii la animalele RapRic Δ Tubule (Figura 3C, Tabelul suplimentar 2). În plus, s-au observat endosomi precoce și tardivi umflați în mare parte și Golgi cisternae la șoarecii Rap Δ Tubule și RapRic Δ Tubule.
Ștergerea mTOR duce la modificări ultrastructurale în celulele PT. (A) Acid periodic - secțiuni de control colorate cu Schiff (Con), Rap Δ Tubule, Ric Δ Tubule și RapRic Δ Tubule care prezintă o lungime BBM redusă la mutanți comparativ cu șoarecii martor. (B) Secțiunile de semitină contracolorate cu albastru de metilen din Con, Rap Δ Tubule, Ric Δ Tubule și RapRic Δ Tubule prezentând morfologia intactă a celulelor epiteliale. (C) Imagini de microscopie electronică ale tuburilor Con, Rap Δ Tubule, Ric Δ Tubule și RapRic Δ Tubule care arată numărul și lungimea redusă a microviliilor BBM și numărul redus de vezicule acoperite cu clatrin, precum și reciclarea endozomilor în structuri celulare altfel normale în mutanți cu animale de control. Rețineți creșterea endozomilor timpurii și tardivi în celulele mutante comparativ cu Con în C. Bară de scală, 20 μm și 2 μm.
Endocitoza redusă este cauzată de formarea diminuată a veziculelor acoperite cu clatrin
Analizele proteomice și fosfoproteomice ale cortexului renal identifică un mTOR putativ - Rețea de proteine de reglementare a transportului dependent
Pentru a elucida în continuare cauzele moleculare ale reducerii observate a funcției de transport PT, am efectuat analize proteomice și fosfoproteomice detaliate ale cortexului renal în tubul Rap Δ și animalele de control respective. Deși diferențele generale între animalele martor și Rap ub Tubule au fost destul de subtile (Figura 4A), mai mulți transportori de aminoacizi, precum SLC6A19 (B 0 AT1), SLC7A7 (y + LAT1) și SLC3A2 (4F2hc), precum și proteinele la polaritate și endocitoză (de exemplu, DOCK8, Bcl2-like 1 [BCL-xL], Ras-related protein Rab-10 [RAB10] și sorting nexin 8 [SNX8]) au fost reduse (Figura 4B, Tabelul suplimentar 3). Folosind modelul de expresie a mozaicului celulelor cu deficit de RAPTOR în Rap ub Tubule, am putut confirma prin imunohistochimie expresia redusă a B 0 AT1, y + LAT1, 4F2hc, DOCK8 și BCL-xL în celulele cu deficit de RAPTOR în comparație cu celule de tip sălbatic (Figura 5, A - E). Acest lucru a fost coroborat prin analiza Western blot de pe membranele renale corticale izolate (Figura 5F), care a confirmat descoperirile noastre proteomice.
În schimb, mai multe ținte mTORC2, în special NDRG1, s-au dovedit a avea o stare de fosforilare crescută (T328 și S342). Similar analizei de îmbogățire a ontologiei genice la nivelul proteinelor, activitatea de transport transmembranar, precum și componentele membranei au fost reglate cel mai semnificativ (Figura 4G). Interesant este că atunci când se integrează atât seturi de date proteomice, cât și fosforoproteomice, a devenit evident că modificările fosforilării nu au fost o consecință a modificărilor abundenței proteinelor (Figura 4H). Am analizat în cele din urmă fosfomotivele fiind reglementate în sus sau în jos. Siturile de fosforilare nereglementate conțineau în principal un motiv direcționat către prolină ([S/T] –P), un motiv în concordanță cu fosforilarea de către mTOR, dar și alte kinaze direcționate către prolină (Figura 4I). 18 situsuri de fosforilare care conțin motivul AGC kinazei RxxS au fost crescute.
Discuţie
Deși funcțiile pleiotropice ale kinazelor mTOR au devenit de curând evidente, se știe foarte puțin despre rolul lor complex în reglarea transportului de proteine epiteliale și endocitoză. Interesant este faptul că seturile de date de registru după transplantul renal au redus nivelurile serice de potasiu și fosfor la pacienții tratați cu sirolimus, 19 - 21 îndreptându-se către o funcție de reglare mTOR pentru transportul electroliților și homeostazie. Folosind întreruperea specifică inducibilă, orientată spre gene, a mTORC1, mTORC2 sau ambele complexe mTOR în celulele PT, putem delimita acum influența semnalizării mTOR asupra fiziologiei PT, transportului proteinelor și endocitozei cu detalii fără precedent (Figura 6). De fapt, întreruperea semnalizării mTORC1 duce la un sindrom asemănător Fanconi, care se prezintă cu fosfaturie, glucozurie, aminoacidurie și proteinurie LMW. La nivel molecular, atât faza fluidă, cât și endocitoza mediată de receptor sunt afectate și coincid cu o lungime modificată a BBM și formarea veziculelor în PT.
Putor mTORC1 - reglarea dependentă a transportului tubular proximal și endocitoza. (A) mTORC1 pare să regleze proteinele de transport PT apicale și basolaterale. mTORC1 ar putea fosforila direct SGLT2 și NBC1 pentru a crește reabsorbția glucozei și sodiului și a excreției de sodiu și bicarbonat. mTORC1 ar putea influența pozitiv nivelul de expresie al transportorului de aminoacizi B 0 AT1 și y + LAT-4F2hc și starea de fosforilare a b 0, + AT1-rBAT pentru a reabsorbi aminoacizii filtrați și a-i secreta în fluxul sanguin. (B) mTORC1 ar putea regla endocitoza PT, biogeneza membranei, traficul de vezicule și polaritatea celulară. mTORC1 controlează probabil biogeneza apicală a membranei și polaritatea celulelor prin afectarea nivelului de expresie al DOCK8, formarea de vezicule și vezicule acoperite cu clatrin apical și endocitoza prin afectarea nivelurilor de expresie a BCL-xL, SNX8 și RAB10 și nivelul de fosforilare al GBF-1. De asemenea, controlează din nou funcția reticulului endoplasmatic (ER) și integritatea Golgi din nou, influențând expresiile și nivelurile de fosforilare ale RAB10 și respectiv GBF-1.
mTOR Reglează utilajul de endocitoză în celulele epiteliale PT
În plus față de afectarea etapelor inițiale ale endocitozei, am observat, de asemenea, un trafic endocitar perturbat, după cum se indică prin cantități crescute de albumină endocitată la animalele Rap Δ Tubule și RapRic Δ Tubule. Mai mult, analiza proteomică a Rap ub Tubule a identificat cantități intracelulare crescute de proteine LMW, cum ar fi angiotensinogen, proteină de legare a retinolului, proteină de legare a vitaminei D și β2-microglobulină. Aceste proteine sunt endocitate fiziologic de celulele PT și procesate în continuare pentru degradare sau transcitoză. 26 Traficul intracelular este o condiție prealabilă pentru ambele procese, iar perturbările sale pot duce, prin urmare, la acumulări intracelulare, așa cum se observă în modelele noastre animale (Figura 2).
mTOR reglementează proteinele specifice de transport tubular apical
Mulți transportatori BBM au fost afectați de ștergerea Raptorului, rezultând un sindrom asemănător Fanconi. SGLT2 (SLC5A2) este principalul transportor apical de glucoză din segmentele PT S1 și S2, cu o localizare exclusivă la BBM. 35 Activitatea transportatorului este reglementată decisiv de fosforilare. 36 Fosfoproteomica șoarecilor Rap Δ Tubule a indicat o fosforilare redusă a SGLT2 la S623 în comparație cu animalele martor. Acest reziduu este un fosfosit foarte conservat între specii, inclusiv SGLT2 uman (S624). 36 S-a arătat că fosforilarea crescută la acest sit crește transportul glucozei prin creșterea inserției membranei a SGLT2. 36 Pierderea fosforilării induse de mTORC1 la S623 ar putea, prin urmare, să contribuie la glucozurie la animalele Rap Δ Tubule și RapRic Δ Tubule.
Analiza fosfoproteomică a cortexului renal Rap Δ Tubule a relevat o reducere puternică a nivelului de fosforilare a trei situsuri de fosforilare pe SLC4A4 (NBC1). S-a raportat că mutațiile inactivante ale acestei gene duc la acidoză renală PT, o altă caracteristică frecvent observată a sindromului Fanconi. 6 Dacă fosfoziții identificați influențează transportul NBC1 necesită o determinare suplimentară la nivel molecular. 38, 39 În conformitate cu alte rapoarte care utilizează rapamicină, în ciuda expresiei similare a transportatorilor majori de fosfat PT (NaPi-IIa, NaPi-IIc și Pit-2), am detectat fosfaturie la animalele Rap Δ Tubule și RapRic Δ Tubule. 40, 41 Influența mTORC1 asupra interacțiunilor neidentificate de până acum ar putea fi responsabili pentru această constatare enigmatică.
În rezumat, ștergerea mTORC1 duce la o disfuncție PT generalizată, mimând diagnosticul clinic al sindromului Fanconi (Figura 6). Analiza noastră aprofundată relevă căile moleculare probabile care sunt afectate într-un mod specific organului. În plus, am identificat un nou regulator principal al kinazei funcției PT, deschizând noi căi pentru studii ulterioare pentru a dezlega rețelele kinazelor care guvernează transportul PT în sănătate și boală.
Metode concise
Animale și tratamente
Toate experimentele pe animale au fost efectuate conform ghidului Institutului Național de Sănătate pentru îngrijirea și utilizarea animalelor de laborator, precum și a legii germane pentru bunăstarea animalelor și au fost aprobate de autoritățile locale (G-13/07, M-9/11 și M-4/13). Șoarecii au fost găzduiți într-o instalație SPF cu acces gratuit la chow și apă și un ciclu de 12 ore zi-noapte. Reproducerea și genotiparea s-au făcut conform procedurilor standard. Șoarecii Raptorfl/fl și Rictorfl/fl au fost descriși anterior 42 și au fost încrucișați la animalele Pax8rtTA 43 și TetOCre 44. La vârsta de 5 săptămâni, animalele inductibile și controalele respective (lipsite fie de TetOCre, fie de Pax8rtTA) au primit clorhidrat de doxiciclină (Fagron, Barsbuettel, Germania) prin apa potabilă (2 mg/ml cu zaharoză 5% protejată de lumină) pentru un total de 14 zile. Pentru a estima eficacitatea recombinării și a identifica mozaicismele celulare, am încrucișat tulpina de șoarece reporter mT/mG cu niște șoareci Raptorfl/fl × Pax8rtTA × TetOCre (Material suplimentar). 45
Prezentarea datelor și analizelor statistice
Datele cantitative sunt prezentate ca mijloace ± SEM. Comparațiile statistice au fost efectuate folosind pachetul software GraphPad Prism 6 (GraphPad Software, La Jolla, CA). Pentru compararea statistică, s-au utilizat testul Mann-Whitney U, testul cu două cozi și, după caz, ANOVA. Valorile P ale lui Smith HW: From Fish to Philosopher, Boston, Little, Brown, 1953 [Google Scholar]
- Neutraceuticalele oferă suplimente nutritive, beneficii pentru sănătate, energie
- Nutriție esențială de fosfor pentru toate celulele corpului - manechine
- Maimuțele obeze slăbesc medicamentele care atacă alimentarea cu sânge a celulelor grase MD Anderson Cancer Center
- Controlul nutrienților pentru traducerea ARNm Revizuirea anuală a nutriției
- Compoziția nutrienților în cashews Healthy Eating SF Gate