Termeni asociați:
- Metaboliți
- Furazolidonă
- Cimetidină
- Nitrofurazonă
- Metabolism farmacologic
- Metal Organic Framework
- Agent antimicrobian
Descărcați în format PDF
Despre această pagină
Medicamente antimicrobiene
Nitrofurantoina
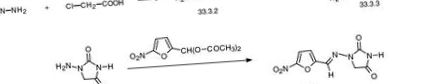
Nitrofurantoina, 1- (5-nitrofurfurilidenamino) hidantoina (33.3.5), este sintetizată din acidul hidrazinoacetic (33.3.2), care este sintetizat prin reacția acidului cloracetic cu hidrazina. Reacția acidului hidrazinoacetic cu cianatul de potasiu dă acidul semicarbazidoacetic (33.3.3), care la încălzire ciclizează în 1-aminoidantoină (33.3.4). Reacționând acest lucru cu diacetilacetal de 5-nitrofurfurol, se obține nitrofurantoina dorită [89-93].
La fel ca nitrofurazonă, nitrofurantoina este un medicament eficient care acționează asupra unui număr de microorganisme Gram-pozitive și Gram-negative (stafilococi, streptococi, bacil dizenterie, bacil colon, bacil paratifoid și altele). Este utilizat în principal pentru tratarea bolilor infecțioase ale tractului urinar (pielita, pielonefrita, cistita, uretrita). Sinonimele acestui medicament sunt furadonina, ituranul, fenurina, urolongul, cistofuranul, nitrofurina și multe altele.
Studii de caz în descoperirea drogurilor
Nitrofurantoina: un medicament cu succes surprinzător
În 1953, nitrofurantoina (Figura 13.11), cunoscută comercial sub numele de Macrobid®, Macrodantin® și Furadantin®, a fost introdusă pentru tratamentul infecțiilor tractului urinar. La acea vreme, nimeni nu ar fi putut prezice că va fi în cele din urmă inclusă pe lista medicamentelor esențiale a Organizației Mondiale a Sănătății. În ciuda dezvoltării unei game largi de antibiotice moderne, nitrofurantoina rămâne un tratament de primă linie pentru infecțiile tractului urinar necomplicate. În plus, în ciuda deceniilor de experiență clinică, rapoartele de rezistență bacteriană rămân rare. Acest lucru este în contrast puternic cu clasele majore de antibiotice (de exemplu, peniciline, chinolone), fiecare dintre acestea cunoscând dezvoltarea tulpinilor rezistente ca urmare a aplicării clinice pe scară largă. Având în vedere nivelul scăzut de rezistență la antibiotice care sa dezvoltat de la introducerea sa comercială inițială, ar putea părea logic să se aplice acest medicament pentru alte tipuri de infecții bacteriene, dar acest lucru nu este posibil. Nitrofurantoina este capabilă în mod unic să trateze infecțiile tractului urinar, dar alte infecții bacteriene nu sunt tratate eficient cu acest medicament.
Figura 13.11. Nitrofurantoina.
Pentru a înțelege modul în care acest medicament și-a păstrat poziția în cabinetul pentru medicamente, trebuie examinat atât mecanismul său de acțiune, cât și proprietățile sale farmacocinetice. În cazul nitrofurantoinei, există mai multe mecanisme de acțiune care ucid bacteriile invadatoare. Studiile au arătat că acest medicament ucide bacteriile prin deteriorarea ADN-ului, deteriorarea ARN-ului, deteriorarea proteinelor și inhibarea ciclului acidului citric. 25 Faptul că acționează prin mecanisme multiple explică lipsa dezvoltării rezistenței. Rezistența se dezvoltă ca urmare a selecției naturale și a mutației. Pentru ca bacteriile să dezvolte rezistență la penicilină, trebuie depășit un singur mecanism de acțiune. Cu toate acestea, în cazul nitrofurantoinei, mutațiile care conferă rezistență la cel puțin cele patru mecanisme enumerate trebuie să apară într-un singur organism. Șansele ca acest lucru să se întâmple sunt atât de mici încât nu se întâmplă aproape niciodată.
Interesant este faptul că activitățile antibacteriene ale nitrofurantoinei sunt conduse de o caracteristică structurală care ar fi evitată în programele moderne de descoperire a medicamentelor, o grupare aril nitro. Această funcționalitate specială este evitată în majoritatea programelor moderne de descoperire a medicamentelor, deoarece este un factor de risc cunoscut pentru carcinogenitate, mutagenicitate și teratogenitate. Atât la oameni, cât și la bacterii, grupările arii nitro sunt activate de enzima nitroreductază, care transformă gruparea nitro într-o grupare nitrozo, o funcționalitate reactivă care dăunează ADN-ului, ARN-ului și proteinelor prin reacții nucleofile și chimia redox. 26 Când aceste evenimente apar într-o bacterie, organismul moare și pacientul este fericit (Figura 13.12 (a)), dar dacă aceste evenimente apar în celulele pacientului, rezultatele pot fi catastrofale (de exemplu, cancer, toxicitate, 13.12 (b)). Cum se face că un compus cunoscut pentru a produce potențiali agenți cancerigeni, mutageni și teratogeni poate rămâne pe piață, în special în lumina concentrării puternice pe siguranță în era modernă a descoperirii medicamentelor?
Figura 13.12. (a) Nitroreductaza bacteriană convertește nitrofurantoina în compusul nitroso corespunzător (roșu) care ucide bacteriile prin deteriorarea ADN-ului, deteriorarea ARN-ului și deteriorarea proteinelor. (b) Nitroreductaza umană convertește, de asemenea, nitrofurantoina în compusul nitroso corespunzător (roșu) care este un potențial cancerigen, mutagen și teratogen.
Răspunsul la această întrebare este ameliorat examinând proprietățile farmacocinetice ale nitrofurantoinei. Când este administrat oral, o doză de 100 mg este îndepărtată rapid după absorbția inițială. Aproximativ 75% din doză este metabolizată la prima trecere, în timp ce restul de ~ 25% este excretat în tractul urinar sub formă de medicament nemodificat. Ca rezultat, concentrația plasmatică maximă a unei doze de nitrofurantoină de 100 mg este mai mică de 1 μg/ml, iar penetrarea țesutului este neglijabilă în toate părțile corpului, cu excepția căii urinare. Concentrația medicamentului în tractul urinar, pe de altă parte, poate depăși 200 μg/ml. Aceasta depășește concentrația necesară pentru a ucide bacteriile invadatoare. 27 În esență, proprietățile farmacocinetice ale nitrofurantoinei îl împiedică să ajungă în alte părți ale corpului, limitându-i utilitatea la infecții ale tractului urinar și prevenind daunele asociate mecanismului său de acțiune. Distribuția țesuturilor, metabolismul și excreția sunt cheia deceniilor de succes pe care le-a cunoscut acest medicament. Interesant este că este puțin probabil ca acest medicament să fi fost dezvoltat în programe moderne de descoperire a medicamentelor. Aproape sigur ar fi aruncat deoparte pe baza riscului posibil asociat grupului arii nitro.
Electroforeza capilară - Antibiotice
Nitrofurani
Nitrofuranii furazolidonă, furaltadonă, nitrofurantoină și nitrofurazonă (care conțin un inel caracteristic 5-nitrofuran) au fost folosiți în mod obișnuit ca aditivi furajeri pentru promovarea creșterii și, pentru a preveni infecțiile bacteriene și protozoare la șeptel, acvacultură și colonii de albine (adică enterita gastro-intestinală cauzate de E. coli și Salmonella spp., holeră de pasăre și capete negre de coccidioză). 26 Cu toate acestea, începând cu 1995, utilizarea acestor antibiotice este complet interzisă în UE, 27 Statele Unite, Australia, Filipine, Thailanda și Brazilia din cauza îngrijorării cu privire la carcinogenitatea reziduurilor de medicamente și a efectelor lor potențiale dăunătoare asupra sănătății umane. Cu toate acestea, analiza metaboliților nitrofuranici în alimente este încă necesară ca o problemă importantă în siguranța alimentelor, deoarece, deoarece sunt ieftine și eficiente, sunt ușor disponibile și sunt încă utilizate în unele țări din afara UE.
Controlul simultan al celor patru nitrofurani furazolidonă, furaltadonă, nitrofurantoină și nitrofurazonă (și chiar și cu metaboliții lor) a fost realizat de MEKC-UV, folosind o sare biliară (deoxicolat de sodiu, SDC) în borat-tampon fosfat la pH 9,0 și MEEKC-UV cu un tampon de tetraborat de sodiu (pH 9,7) în prezența SDS, octan și butan-2-ol Tabelul 8 ). Datorită absenței unui grup de cromofori UV în metaboliții lor, aceștia au fost derivați cu agent 2-nitrobenzaldehidă (2-NBA). Este demn de subliniat faptul că furaltadona a apărut în probele analizate (de exemplu, peștii de calcan) cu conținut mai mare decât cele permise de legislația europeană. Prin urmare, aceste metodologii contribuie la identificarea și eliminarea sursei de contaminare pentru a asigura siguranța chimică a alimentelor și, prin urmare, siguranța consumatorilor.
Biotransformare
P. Jungsuwadee, M.E. Vore, în Comprehensive Toxicology, 2010
4.26.13.6 Selectivitatea substratului
Substraturile BCRP sunt diverse din punct de vedere structural și includ numeroase medicamente (nitrofurantoină, cimetidină), substanțe cancerigene alimentare (PhIP) și vitaminele riboflavină și acid folic (Jonker și colab. 2002; van Herwaarden și colab. 2003). Conjugatele sulfatate de medicamente și hormoni steroizi (de exemplu, E1SO4), precum și conjugatele glucuronide, sunt, de asemenea, substraturi excelente (van Herwaarden și Schinkel 2006), deși mai mult la șoarece decât la șobolan (Zamek-Gliszczynski și colab. 2006b). Moleculele mari, cum ar fi metabolitul clorofilă feoforbidă și protoporfirina IX, sunt, de asemenea, substraturi BCRP, așa cum se arată în șoarecii nul BCRP care au dezvoltat fototoxicitate datorită acumulării de feoforbid dietetic și au demonstrat niveluri crescute de eritrocite de protoporfirină IX (Jonker și colab. 2002). După cum sa menționat mai sus, Krishnamurthy și colab. (2007) au demonstrat un rol pentru BCRP în transportul structurilor de tetrapirol. Având în vedere descoperirea sa în liniile celulare tumorale rezistente, mai mulți agenți chimioterapeutici, inclusiv mitoxantronă, doxorubicină, daunorubicină și topotecan, au fost identificați ca substraturi BCRP.
Într-un efort de a înțelege baza diferitelor specificități ale substratului BCRP clonate din linii celulare rezistente (R482G, R482T) față de proteina de tip sălbatic (Sarkadi și colab. 2006), Miwa și colab. (2003) au examinat efectul mutanților BCRP cu diferite substituții de aminoacizi în regiunile TM asupra rezistenței la medicamente celulare. Celulele transfectate cu oricare dintre ADNc-urile R482X-BCRP (X = N, C, M, S, T, V, A, G, E, W, D, Q și H, dar nu Y și K) au prezentat o rezistență mai mare la mitoxantronă și doxorubicină decât celulele transfectate cu BCRP de tip sălbatic. Mutantul R482G a arătat, de asemenea, o pierdere a activității de transport pentru MTX, în timp ce N557D a prezentat o rezistență similară la mitoxantronă, dar o rezistență mai mică la SN-38 decât omologul de tip sălbatic (Volk și Schneider 2003). Aceste și alte studii sugerează că E446 în TM2, R482 în TM3, N557 în TM5 și H630 în TM6 din BCRP joacă roluri importante în recunoașterea substratului lor (Miwa și colab. 2003).
Toxicologie hepatică
R.I. Sanchez, F.C. Kauffman, în Comprehensive Toxicology, 2010
9.05.2.3 Reducere
Similar cu nomenclatura utilizată pentru enzimele CYP, AKR-urile au fost clasificate pe baza omologiei lor de secvență (Penn Medicine). Superfamilia AKR cuprinde 14 familii (AKR1-14), unele dintre ele cu specificități largi ale substratului. AKR metabolizează steroizi, zaharuri, prostaglandine, hidrocarburi aromatice policiclice și aldehide și cetone nesteroidiene. AKR-urile se găsesc în aproape fiecare organism viu, dar familiile AKR1 și AKR7 sunt AKR-urile predominante ale mamiferelor.
Superfamilia SDR cuprinde enzime implicate în metabolismul steroizilor, zaharurilor, hidrocarburilor aromatice și prostaglandinelor. În ciuda specificității similare a substratului, SDR-urile sunt structural diferite de AKR-uri. De obicei, SDR-urile conțin 250-350 de aminoacizi și au o omologie de secvență scăzută (15-30%) (Kallberg și colab. 2002), dar structurile lor tridimensionale sunt foarte suprapozabile (Ghosh și colab. 2001; Krook și colab. 1993). Carbonil reductazele superfamiliei SDR au specificități de substrat similare cu cele ale membrilor superfamiliei AKR, dar sunt capabile să accepte cetone și chinone aromatice ca substraturi (Wermuth și colab. 1982). Menadiona și chinonele hidrocarburilor aromatice policiclice sunt substraturi excelente ale carbonil reductazelor umane (Wermuth și colab. 1986). Antibioticele antraciclinice utilizate ca medicamente antitumorale sunt substraturi ale carbonil reductazelor. Inactivarea acestor medicamente prin reducerea enzimei AKR sau SDR a fost asociată cu dezvoltarea rezistenței împotriva antraciclinelor purtătoare de carbonil (Soldan și colab. 1996). Doxorubicina, de exemplu, este redusă de carbonil reductaza la doxorubicinol, specia asociată cu cardiotoxicitatea (Olson și colab. 2003).
Chinonele, originare din dietă, terapie medicamentoasă sau poluanți ai mediului, sau generate endogen, sunt supuse reducerii cu mai multe enzime. Reducerea cu un singur electron prin CYP reductază microsomală, micotomamică redusă nicotinamidă adenină dinucleotidă (NADH) -citocrom b5 reductază sau NADH-ubiquinonă oxidoreductază mitocondrială duce la formarea de semiquinone. Acești compuși sunt instabili în prezența oxigenului molecular și sunt reoxidați rapid pentru a forma compusul părinte și anionul superoxid, ducând la stres oxidativ (Monks și colab. 1992). Alternativ, printr-o reducere cu doi electroni, NAD (P) H citosonică oxidoreductază citosolică (NQO1, DT-diaforază) și dihidronotinamidă ribozidă chinonă oxidoreductază (NQO2) catalizează reducerea chinonelor la hidroquinone, care pot fi ușor conjugate și eliminate în 2002.; Deller și colab. 2008). Carbonil reductazele catalizează, de asemenea, reducerea cu doi electroni a chinonelor (Wermuth și colab. 1986).
Abordări pentru proiectarea și sinteza medicamentelor antiparazitare
Satyavan Sharma, Nitya Anand, în Biblioteca de Farmacochimie, 1997
2 NITROFURANȚĂ
Nitrofuranii sunt cunoscuți în primul rând pentru activitatea lor antibacteriană; cu toate acestea, s-a constatat că câțiva compuși au activitate marcată împotriva filariozei și schistosomiazei. În filarioza experimentală nitrofurazonă (1 ), nitrofurantoina ( 2), nifurtimox3), furazolidonă (4) și furapirimidonă (5) s-a dovedit că ucide atât microfilarii cât și viermii adulți ai L. carinii la doze parenterale cuprinse între 15-150 mg/kg timp de 5 zile [4-9]. Dintre acestea, nifurtimox (3), furazolidonă (4) și furapirimidonă (5) au demonstrat o activitate bună împotriva filariozei umane.
În urma observației făcute de oamenii de știință chinezi că nitrofurazonă (1) posedă activitate profilactică împotriva S. japonicutn la șobolani albini [10,11], un număr mare de nitrofurani au fost sintetizați ca potențiali agenți schistosomicidi, dintre care F-30066 (furapromidium, 6) și F-30385 (7) a apărut ca antihelmintici puternici [12,13]. Un alt nitrofuran, SQ-18506 (8), s-a demonstrat, de asemenea, că prezintă o activitate ridicată împotriva bacteriilor gram-negative și gram-pozitive, a ciupercilor și a schistozomilor [14-16]. Din păcate, potențialul mutagen al diferitelor nitroheterocicluri face ca această clasă de compuși să fie suspectați ca agenți terapeutici [17,18] .
Toxicologie reproductivă și endocrină
E J. Implor. C.M.J. Kirkpatrick, în Comprehensive Toxicology, 2010
11.22.2.2 Transport activ
Activarea metabolică și toxicitatea furanoterpenoizilor
4. Concluzie
Furanoterpenoizii devin populari datorită efectelor lor antitumorale, antioxidante și a multor alte efecte farmacologice. Din păcate, evaluarea siguranței furanoterpenoizilor valoroși este întârziată și s-a efectuat încă o mică activitate mecanică a acțiunilor toxice ale acestor produse naturale. Bioactivarea acestor compuși care conțin inel furan pare a fi un pas critic pentru toxicitățile lor. Oxidarea fragmentului inelar furan de către P450 inițiază aparent acțiunile toxice ale furanoterpenoizilor. Două tipuri de intermediari reactivi, furanoepoxid și cis-enedial, sunt generate în timpul biotransformării furanoterpenoidelor prin epoxidare și deschiderea inelului oxidant furan catalizat de P450. Ambii intermediari sunt electrofili și reactivi la nucleofilii proteinelor și acizilor nucleici. Modificarea macromoleculelor este sugerată pentru a declanșa varietăți de toxicități.
Cu toate acestea, nu este necesar să se concluzioneze că toți compușii care conțin furan pot fi metabolizați la cele două tipuri de intermediari reactivi. Nitrofurantoina (NFT), un derivat de 5-nitrofuran, a fost folosită pentru tratamentul infecțiilor specifice tractului urinar de mult timp [255]. Din păcate, s-a raportat că utilizarea pe termen lung a NFT poate duce la hepatotoxicitate [256-265]. Recent am demonstrat că bioactivarea NFT poate atrage după sine epoxidarea fragmentului furan cu oxidarea P450 și apoi denitrarea printr-o reacție de eliminare (Schema 2.9), în timp ce nu au fost detectate cis-enediale prin studiul de captare [266]. Credem că substituenții de pe inelul furan ar dicta căile metabolice ale compușilor care conțin furan. Caracteristicile structurale ale substituenților pot influența bioactivarea inelului furanic.
Schema 2.9. Căi propuse pentru formarea conjugatelor derivate din NFT prin oxidare mediată de P450 [266] .
În plus, formarea cis-enedialelor ca metaboliți reactivi ai compușilor furanici nu înseamnă neapărat că acești furani sunt toxici. Prazozina, un derivat furanic 2-substituit, este un agent antihipertensiv și nu au fost raportate probleme de siguranță, în ciuda faptului că deschiderea inelului furan mediat de P450 este o cale principală de metabolizare a acestui medicament [267-269]. Metabolitul alcoolic corespunzător detectat în amestecurile de incubație microsomală a sugerat că absența toxicității observate cu prazosin poate rezulta dintr-o reducere/oxidare rapidă a metabolitului reactiv (Schema 2.10). Cu alte cuvinte, detoxifierea rapidă a intermediarului reactiv este probabil un proces critic de prevenire a potențialelor toxicități.
Schema 2.10. Căi metabolice propuse pentru formarea alcoolului prazosinului și a conjugaților GSH corespunzători [267.268] .
- Pedometru - o prezentare generală Subiecte ScienceDirect
- Exercițiu static - o prezentare generală Subiecte ScienceDirect
- Uscătoare rotative - o prezentare generală Subiecte ScienceDirect
- Cultura de început - o prezentare generală Subiecte ScienceDirect
- Picosulfat de sodiu - o prezentare generală Subiecte ScienceDirect