Abstract
Introducere
Acizii grași liberi (FFA) sunt o sursă majoră de energie pentru majoritatea țesuturilor la mamifere. FFA circulant în plasmă este derivat în principal din țesutul adipos, care este principalul depozit pentru depozitarea triacilglicerolului. Toate tratamentele pentru obezitate, inclusiv restricția dietetică a carbohidraților, au scopul de a reduce depozitarea grăsimilor în adipocite. S-a considerat că enzima principală responsabilă de mobilizarea FFA din țesutul adipos, adică lipoliza, este lipaza hormonală (HSL). Această revizuire abordează unele aspecte ale organizării componentelor metabolismului grăsimilor în adipocite, lipolizei și lipogenezei și modul în care manipularea genetică a căii lipolizei afectează metabolismul grăsimilor în adipocit.
Proprietățile HSL
HSL este o lipază intracelulară, neutră, care are o specificitate largă a substratului, catalizând hidroliza triacilglicerolului, diacilglicerolului, monoacilglicerolului și esterilor colesterilici, precum și a esterilor retinilici; cu toate acestea, nu are activitate de fosfolipază [1]. Activitatea sa împotriva diacilglicerolului este de aproximativ 10 ori și de 5 ori mai mare decât activitatea sa împotriva triacilglicerolului și respectiv monoacilglicerolului, în timp ce activitatea sa împotriva esterilor colesterilici este de aproximativ dublul activității sale față de triacilglicerol. Activitatea hidrolitică a HSL împotriva esterilor triacilglicerolului și colesterilului, dar nu împotriva diacilglicerolului, este stimulată de fosforilarea mediată în primul rând de protein kinaza A (PKA) [1].
Lipoliza
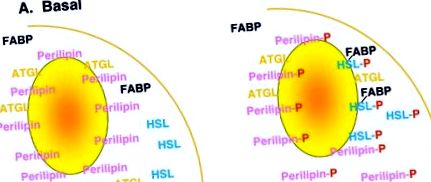
Reglarea lipolizei este complexă și, deși nu este pe deplin înțeleasă, implică multiple mecanisme, inclusiv hormonii lipolitici (agoniști β-adrenergici, ACTH etc.) și anti-lipolitici (insulină, adenozină etc.) și receptorii lor cognitivi și căile de semnalizare, care implică în special AMP ciclic și PKA. Modelele actuale de lucru pentru mecanismele care stau la baza lipolizei s-au concentrat pe treptele din aval de receptorii hormonali și cascadele de semnalizare, concentrându-se pe proteinele asociate picăturilor lipidice, cum ar fi perilipinele și lipazele, cum ar fi HSL și altele, care par să joace roluri vitale în lipoliză [ 1]. Într-o vedere simplificată (Figura 1), aceste modele sugerează că, în condiții bazale, nestimulate, perilipina decorează suprafața picăturii lipidice, protejând picătura lipidică de hidroliza prin HSL, care se află în principal în citosol. La stimularea lipolitică, PKA este activat, rezultând atât fosforilarea perilipinei cât și a HSL. Fosforilarea perilipinei facilitează apoi translocarea HSL din citosol în picătura lipidică, unde poate continua hidroliza triacilglicerolului și lipolizei.
Model de desene animate de lipoliză. În condiții bazale, perilipina este localizată în picătura lipidică, împreună cu alte proteine asociate picăturii, cum ar fi ATGL (triglicerid lipazic adipos), în timp ce HSL este localizat în principal în citosol împreună cu alte proteine citosolice, cum ar fi FABP (proteina de legare a acidului gras). După stimularea lipolitică, PKA este activat, rezultând fosforilarea perilipinei și HSL. Acest lucru este asociat cu translocarea HSL din citosol în picătura lipidică unde apare hidroliza picăturii lipidice triacilglicerol.
Lipazele din adipocite
Șoarecii HSL KO sunt rezistenți la obezitate
Expresia modificată a genei adipoase la șoareci HSL KO
Pe lângă acumularea de diacilglicerol în țesuturile menționate mai sus, conținutul de colesterol în țesuturile adipoase a crescut la șoarecii nul HSL și acest lucru a fost accentuat de hrănirea ridicată cu grăsimi, unde conținutul de colesterol a fost de 5 ori mai mare la șoarecii nul HSL [13]. Pe lângă modificările histologice și ale conținutului de lipide, deficitul de HSL are efecte multiple asupra metabolismului adipos. Nivelurile de expresie a ARNm ale receptorului activat cu proliferatorul peroxizomului γ (PPARγ) și al proteinei de legare CCAAT/amplificator α (C/EBPα), doi dintre factorii majori de transcripție pentru adipogeneză [15, 16], au fost suprimate cu 40-70% în WAT de Șoareci nul HSL. În mod similar, nivelurile PPARα au fost, de asemenea, diminuate
70% în WAT de șoareci nul HSL.
În paralel cu suprimarea factorilor de transcripție, expresia ARNm a markerilor diferențierii adipoase, cum ar fi adiponectina, leptina, rezistina și adipsina, care sunt factori umorali derivați din țesutul adipos, au fost reduse cu 60-90% [13]. În schimb, expresia TNFα a fost reglată în sus de 2-3 ori în WAT și de 5-10 ori în BAT a șoarecilor nul HSL comparativ cu martorul. Din nou, în concordanță cu reducerea factorilor de transcripție adipogenă, toate genele asociate cu metabolismul acidului gras și al trigliceridelor, cum ar fi proteina de legare a acidului gras adipocit, perilipina, lipoprotein lipaza, glicerol-3-fosfat aciltransferază (GPAT), GPAT mitocondrial, acetil-CoA carboxilază, acizii grași sintaza, acil-CoA sintetaza, acil-CoA: diacilglicerol aciltransferaza 1 (DGAT-1), DGAT-2, ATP citrat liasa, au fost reduse în WAT de șoareci nul HSL fie pe o dietă normală, fie pe o dietă bogată în grăsimi [13], 17]. Aceste modificări ale expresiei genice au dus la o scădere marcată a căilor de esterificare a acizilor grași și la sinteza lipidelor neutre și a glicerol-fosfolipidelor în WAT a șoarecilor nul HSL [17]. Astfel, odată cu întreruperea lipolizei prin îndepărtarea HSL, există o reducere drastică a lipogenezei, care ar putea permite un export mai eficient al acizilor grași eliberați prin lipoliză din celulă.
În conformitate cu reglarea descendentă a factorilor de transcripție adipogenă, expresia receptorului de insulină, a substratului receptorului de insulină-1 și a transportorului de glucoză 4 mARN a scăzut cu 30-80% în WAT de șoareci nul HSL comparativ cu martorul [13]. Cu toate acestea, examinarea genelor implicate în metabolismul colesterolului a arătat că expresia 3-hidroxi-3-metilglutaril-CoA (HMG CoA) reductază, enzima care limitează rata pentru sinteza colesterolului, a fost reglată în sus
De 2 ori; întrucât, HMG CoA sintază-1, o enzimă în amonte de HMG CoA reductază, a fost reglementată în jos cu 50-70% în WAT de șoareci nul HSL [13]. În mod surprinzător, expresia acil-CoA: colesterol aciltransferază 1, enzima care mediază esterificarea colesterolului în esteri celulari de colesteril a crescut de 2-4 ori în WAT și de 5-8 ori în BAT. Nivelurile de expresie ale factorului de transcripție lipogenică a elementului de reglare a sterolului care leagă proteina-1c (SREBP-1c) au fost suprimate cu 50-75%, în timp ce expresia SREBP-2, care controlează sinteza și absorbția colesterolului, a fost reglată în sus de două ori. În paralel cu modificările SREBP-2, proteina 2 de decuplare a crescut de 3-4 ori în BAT la șoareci nul HSL [13].
Metabolizarea insulinei și a glucozei la șoarecii HSL KO
Efectele deficitului de HSL asupra metabolismului insulinei și glucozei sunt controversate în sensul că au fost publicate mai multe lucrări care raportează rezultate contradictorii. De exemplu, sensibilitatea generală la insulină la șoarecii nul HSL a fost raportată ca fiind scăzută de unii autori [7] și normală de către alți autori [18, 19]. S-a raportat că sensibilitatea la insulină hepatică a crescut [18, 19], în timp ce sensibilitatea la insulină în țesutul adipos și în mușchi a fost raportată a fi redusă [7, 17] sau normală [18, 19]. În mod similar, secreția de insulină la șoarecii nul HSL a fost raportată fie normală [7, 20], fie redusă [21, 22]. Bazele pentru aceste diferențe de rezultate nu sunt ușor de evidente, dar pot fi datorate diferențelor în fundalul genetic pe care au fost examinați șoarecii nul HSL sau pot depinde dacă studiile au fost efectuate in vitro sau in vivo.
Macrofage în țesutul adipos al șoarecilor HSL KO
Observațiile recente conform cărora există o infiltrație crescută de macrofage în WAT în obezitate au fost extinse la șoareci nuli HSL [23]. Chiar dacă există o masă WAT scăzută la șoarecii nul HSL, spre deosebire de creșterea observată la obezitate, există o prevalență mai mare a adipocitelor hipertrofiate la șoarecii nul HSL. Studii recente au observat că, în paralel cu hipertrofia adipocitelor, există o creștere a macrofagelor situate în structuri asemănătoare coroanei care înconjoară adipocitele cu macrofagele care elimină picăturile lipidice lipsite de adipocite eliberate din celulele care suferă moarte celulară asemănătoare necrozei [23]. Astfel, un număr mai mare de macrofage în WAT la șoareci nul HSL ar putea contribui la creșterea TNFα și la unele dintre celelalte modificări ale funcției adipocite observate.
Concluzie
Modele de desene animate ale potențialelor mecanisme care stau la baza metabolismului modificat al adipocitelor la șoarecii HSL KO. Panoul A. Deoarece HSL este diacilglicerol lipaza cheie în țesutul adipos, diacilglicerolul se acumulează în șoareci nul HSL ducând la activarea membrilor familiei protein kinazei C și a țintelor din aval, cum ar fi MAPK, afectând astfel proliferarea celulară, apoptoza și diferențierea. Panoul B. Deoarece HSL este cheia colesteril ester hidrolază neutră în țesutul adipos, un șir regulator de colesterol liber ar putea fi epuizat la șoarecii nul HSL, ducând la o creștere a factorului de transcripție SREBP2 (proteina de legare a elementului de reglare a sterolului 2) și o reglare ulterioară ulterioară a țintele sale transcripționale, cum ar fi UCP2 (proteina 2 de decuplare). Panoul C. Deoarece HSL mediază mobilizarea acizilor grași, eliberarea acizilor grași specifici de către HSL ar putea fi necesară pentru producerea liganzilor care sunt utilizați preferențial de PPARγ. O lipsă relativă de liganzi PPARγ ar putea suprima activarea reciprocă a PPARγ și C/EBPα, cei mai importanți 2 factori de transcripție necesari pentru diferențierea adipocitelor.
- Misoprostol înainte de introducerea dispozitivului intrauterin (DIU) la femeile nulipare - Vizualizare text complet
- Exercițiu de intensitate moderată și fenilcetonurie - Vizualizare text complet
- Muscletech Vitamax Energy and Metabolism for Men SX-7 Onyx negru 120 comprimate; Nutriție Bizz
- Keto Slim Nutrition Herbs Pentru a crește metabolismul Moduri de a pierde în greutate într-o săptămână Eagle CNC
- Eu; m Slimming Down versuri de Wesley Willis - text integral al melodiei originale