Subiecte
Abstract
Introducere
Obezitatea a devenit una dintre preocupările majore de sănătate publică din ultimele decenii, fiind un factor cheie de risc pentru diabetul de tip 2, bolile cardiovasculare, dislipidemia, hipertensiunea și anumite tipuri de cancer, ducând astfel la o mortalitate crescută. În timp ce tratamentul pentru obezitate și prevenirea bolilor legate de obezitate nu au întotdeauna succes, un subgrup de indivizi obezi prezintă un risc scăzut de complicații metabolice. „Obezitatea sănătoasă din punct de vedere metabolic (MHO)” reprezintă un astfel de subgrup de indivizi obezi care prezintă acumularea excesivă de țesut adipos fără efecte metabolice adverse, inclusiv rezistența la insulină, intoleranța la glucoză și dislipidemia 1. Persoanele MHO se caracterizează prin creșterea capacității de depozitare a grăsimii țesutului adipos cu fenotip antiinflamator și scăderea depunerii de grăsime ectopică în ficat și mușchiul scheletic; aceste modificări morfologice și funcționale ale țesutului adipos inhibă în consecință dezvoltarea rezistenței la insulină și a bolilor cardiometabolice.
Inhibitorii cotransportorului de sodiu-glucoză 2 (SGLT2) sunt medicamente antidiabetice orale care promovează excreția urinară a glucozei prin blocarea reabsorbției acesteia în tubulii proximali renali. Am raportat anterior că inhibitorul SGLT2 ipragliflozin (Ipra) promovează expansiunea țesutului adipos epididimal (Epi) fără a deteriora metabolismul sistemic al glucozei/lipidelor și inflamația adipoasă la șoarecii obezi 2,3. Această stare de creștere a masei grase cu o capacitate metabolică conservată a fost denumită „expansiune sănătoasă a țesutului adipos”, care este similară cu țesutul adipos găsit la indivizii MHO.
În acest studiu, am demonstrat că Ipra a promovat expansiunea țesutului adipos sănătos asociat cu un raport redus de tip M1/M2 de tip ATM-uri. Observația noastră a sugerat că modificarea raportului asemănător M1/M2 al ATM-urilor ar putea determina adipocitele să inducă expansiunea sănătoasă a țesutului adipos în timpul inhibării SGLT2 și, mai larg, ar putea oferi noi perspective asupra mecanismelor de expansiune adipoasă care ar putea fi ținte terapeutice. pentru comorbiditățile metabolice asociate obezității.
Materiale și metode
Experimente pe animale
Analiza metabolică
Nivelurile de glucoză din sânge au fost măsurate cu ajutorul unui glucometru (Glutest Pro R). Concentrațiile serice de insulină și acid gras (FFA) au fost măsurate utilizând testul imunosorbent legat de enzime (Morinaga, Yokohama, Japonia) și metoda enzimatică (Wako, Osaka, Japonia), respectiv. Nivelurile de hidroxibutirat beta (BHB) au fost determinate folosind o metodă colorimetrică (ab83390, Abcam). Concentrațiile serice de colesterol total, trigliceride (TG) și alanină aminotransferază (ALT) au fost măsurate folosind Fuji Dry-chem 7000 V (Fujifilm Corporation, Tokyo, Japonia). Pentru testele de toleranță la glucoză (GTT), șoarecii au fost posti timp de 16 ore cu acces gratuit la apă, urmat de injecția intraperitoneală de glucoză (2 g/kg). Am măsurat concentrațiile de glucoză din sânge la 0, 15, 30, 60 și 120 de minute după injectare. Concentrația mare de glucoză nemăsurată (> 600 mg/dl) a fost înregistrată la 600 mg/dl. Toate analizele, cu excepția GTT, au fost efectuate în stare alimentată ad libitum.
Histologie
Țesutul adipos a fost fixat în soluție tampon de fosfat de paraformaldehidă 4% timp de 24 de ore la temperatura camerei. Secțiunile deparafinizate (2 μm) au fost incubate cu proteinază K timp de 5 min pentru antigenul de recuperare. Activitatea endogenă a peroxidazei a fost blocată cu 0,3% H2O2 în metanol timp de 30 de minute. Un anticorp anti-șobolan F4/80 (clonă: A3-1, diluție 1: 1000: AbD Serotec) și un anticorp IL-15 anti-policlonal de iepure (1 µg/ml, PeproTech) au fost utilizate pentru a evalua infiltrarea macrofagelor și pentru a detectează celule care exprimă IL -15 în țesutul adipos, respectiv. Numărul de structuri asemănătoare coroanei a fost numărat în 15 câmpuri diferite (× 200) per diapozitiv și exprimat ca număr mediu pe câmp. Zona pozitivă IL-15 a fost măsurată în 15-18 câmpuri diferite (× 200) per diapozitiv folosind imaginea J. Dimensiunea adipocitelor a fost cuantificată cu programul Fiji (imaginea J) Adiposoft 1.13 așa cum a fost descris anterior 3 .
Cultură de celule
Celulele 3T3-L1 au fost achiziționate de la ATCC și menținute în mediu Eagle modificat Dulbecco (DMEM) conținând 10% ser de vițel. La două zile după atingerea confluenței de 100%, celulele au fost incubate în DMEM conținând 10% ser bovin fetal (FBS), 5 µg/ml insulină, 0,5 mM izobutilmetil xantină și 0,25 µM dexametazonă (ziua 0). După 2 zile, mediul a fost înlocuit cu DMEM conținând 10% FBS și 5 μg/ml insulină (ziua 2). Ulterior, mediul de cultură a fost înlocuit la fiecare 2 zile cu DMEM conținând 10% FBS. Adipocitele diferențiate au fost stimulate cu IL-15 murin recombinant (50 sau 250 ng/ml, Peprotech) în zilele 10, 12 și 14, așa cum s-a descris anterior 14 cu unele modificări. În ziua 15 de diferențiere, celulele au fost fixate cu soluție tampon de paraformaldehidă fosfat 4% timp de 2 ore la temperatura camerei și spălate cu izopropanol 60% timp de 1 min. Celulele fixe au fost colorate cu soluție filtrată de ulei roșu O timp de 2 ore la temperatura camerei. Pentru a cuantifica conținutul de lipide, Oil Red O a fost eluat cu izopropanol 100% și absorbanța extractelor a fost măsurată la 540 nm folosind un cititor de microplăci (Bio-Rad Laboratories, Hercules, CA, SUA).
Pentru izolarea macrofagelor peritoneale, șoarecii masculi WT de 12 săptămâni au fost injectați intraperitoneal cu 3% tioglicolat Brewer. Patru zile mai târziu, macrofagele au fost colectate prin spălare peritoneală utilizând DMEM rece conținând 2% FBS. Celulele au fost cultivate timp de 3 ore în DMEM conținând 0,25% albumină serică bovină (BSA) și 1% penicilină/streptomicină. Culturile au fost spălate de două ori cu soluție salină tamponată cu fosfat (PBS) pentru a îndepărta celulele neaderente, pretratate cu BHB (1 sau 10 mM) în mediu de cultură și stimulate cu lipopolizaharidă (LPS, 1 ng/ml), IL-4 (10 ng/ml) )., Biolegend) sau IL-13 (10 ng/ml, Biolegend) peste noapte.
Izolarea adipocitelor și a celulelor fracției vasculare stromale
Epi a fost cântărit, tocat și digerat în 15 ml soluție de colagenază tip 2 (2 mg/ml, Worthington) timp de 20 minute la 37 ° C cu agitare ușoară. Amestecul de digestie a fost centrifugat la 500 g timp de 3 min. Adipocitele plutitoare au fost colectate pentru extracția acidului ribonucleic (ARN) și peletele care conțin celule ale fracției vasculare stromale (SVF) au fost suspendate în PBS. Suspensia a fost trecută printr-un filtru de plasă de nailon de 100 μm (BD Falcon) și centrifugată la 500 g timp de 3 min pentru a granula celule SVF.
Izolarea leucocitelor din sângele periferic
Probele de sânge au fost obținute din vena cozii folosind tuburi capilare. Sângele a fost amestecat cu acid etilendiaminetetraacetic 0,5 M (EDTA), lizat cu tampon de lizare ACK și centrifugat la 500 g timp de 3 min.
Citometrie de flux și sortare celulară
Celulele SVF izolate sau leucocitele au fost resuspendate în 200 μl PBS conținând 0,25% BSA, 0,2 mM EDTA și 1% penicilină/streptomicină. Celulele au fost preincubate timp de 7 minute la 4 ° C în bloc Fc (CD16/32, BD Biosciences) și apoi colorate timp de 15 minute cu anticorpi conjugați cu fluorofor la 4 ° C. Au fost utilizați următorii anticorpi: anti-CD45 (clonă: 30-F11, Biolegend), anti-F4/80 (clonă: BM8, Biolegend), anti-CD11b (clonă: M1/70, Biolegend), anti-CD11c: N418, Biolegend), anti-CD206 (clonă: C068C2, Biolegend), anti-CCR2 (clonă: SA203G11, Biolegend), anti-Ly6G/Ly6C (clonă: RB6- 8C5, Biolegend) și anti-CD115 (clonă: AFS98, Biolegend) 15. Analiza citometrică de flux a fost efectuată folosind un FACSCantoII (BD Biosciences). Sortarea celulelor a fost efectuată cu un FACSAriaII (BD Biosciences). Datele au fost analizate utilizând software-ul FlowJo (v9.4.10, Tree Star).
Analiza expresiei genelor
ARN-ul total a fost extras folosind Qiazol (QIAGEN). Sinteza ADNc și reacția în lanț cantitativă în timp real a polimerazei (PCR) au fost efectuate așa cum s-a descris anterior 16 .
Analiza microarray
ARN-ul total extras din Epi a fost purificat folosind RNeasy MinElute Cleanup Kit (QIAGEN). Analiza microarray a fost efectuată la GeneticLab Co (Sapporo, Japonia) folosind GeneChip Mouse Gene 2.0 ST Array (Affymetrix). Rezultatul a fost analizat folosind Affymetrix Transcriptome Analysis Console ™ de GeneticLab Co. Analiza ontologiei genetice a fost efectuată utilizând resursele bioinformatice DAVID 6.8.
Analiza Western blot
Țesuturile adipose epididimale au fost lizate prin bătăi de mărgele într-un tampon de liză (2% SDS, 4 M uree, 1 mM EDTA, 150 mM NaCI, 50 mM Tris pH 8,0), sonicate și centrifugate. Lizatele au fost separate de 8% SDS-PAGE și transferate în membranele PVDF. Western blot a fost efectuat folosind anticorpul phospho (Ser473) - Akt (9271, Cell Signaling Technology) și anticorpul Akt (9272, Cell Signaling Technology), urmat de detectarea ECL (GE Lifescience). Intensitatea benzii a fost cuantificată utilizând software-ul NIH Image J.
analize statistice
Toate datele au fost analizate folosind Graph Pad Prism 6 și au fost prezentate ca medie ± eroare standard a mediei. O valoare p
Rezultate
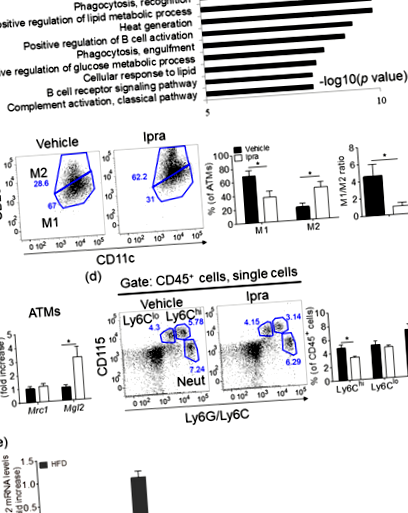
Ipra induce o expansiune sănătoasă a țesutului adipos cu un raport redus de tip M1/M2 de ATM-uri la șoareci WT alimentați cu HFD
Reducerea farmacologică a ATM-urilor asemănătoare M2 prin blocarea semnalizării receptorului factorului 1 care stimulează colonia nu afectează expansiunea țesutului adipos la șoarecii hrăniți cu HFD tratați cu Ipra
Deficitul de CCR2 îmbunătățește expansiunea țesutului adipos sănătos indus de Ipra la șoarecii hrăniți cu HFD
Corpul cetonic se atenuează Il15 reglarea ascendentă în macrofagele polarizate M1
În ceea ce privește un posibil factor care inhibă Il15 expresie în celulele SVF în timpul tratamentului cu Ipra, ne-am concentrat asupra corpului cetonic BHB, a cărui concentrație serică este crescută la șoarecii tratați cu Ipra 2. BHB atenuat semnificativ Il15 inducerea în macrofagele peritoneale polarizate M1 (Fig. 4d), fără a afecta Il1b, Il6, sau Tnfa inducerea în macrofagele peritoneale polarizate M1 (Figura suplimentară 5c). La șoarecii HFD tratați cu Ipra, în timp ce tratamentul cu GW2580 nu a modificat concentrația serică de BHB, șoarecii CCR2 KO au prezentat o creștere a concentrațiilor serice de BHB (Fig. 4e).
IL-15 inhibă acumularea de lipide în celulele 3T3-L1 cu Pck1 downregulation
În concordanță cu un raport anterior 14, IL-15 recombinant, inhibat în mod dependent de doză, acumularea de lipide în adipocite 3T3-L1 (Fig. 4f), în asociere cu o expresie redusă a genelor lipogene, cum ar fi Pck1, Fasn, și Scd1 (Fig. 4d). Printre aceste gene lipogene, Pck1, care codifică fosfoenolpiruvatul carboxicinază (PEPCK), a fost raportat că mediază gliceroneogeneza în adipocite, promovând astfel acumularea de TG prin reesterificarea acidului gras. S-a raportat că creșterea reesterificării acizilor grași prin supraexpresia PEPCK în țesutul adipos duce la expansiunea adipoză fără rezistență la insulină 20, sugerând că acumularea de TG dependentă de PEPCK ar putea contribui la o expansiune sănătoasă a adiposului. În adipocite de la șoareci tratați cu Ipra, Pck1 expresia a fost semnificativ crescută în raport cu șoarecii tratați cu vehicul (Fig. 4h). Un rezultat similar a fost obținut la Epi de la șoarecii CCR2 KO tratați de Ipra (Figura suplimentară 5e). În contrast, Pck1 expresia a fost scăzută la Epi a șoarecilor obezi induși de HFD comparativ cu șoarecii hrăniți cu SD (Figura suplimentară 5f).
Ipra modifică subspeciile ceramidă și sfingomielină din țesutul adipos al șoarecilor hrăniți cu HFD
Am efectuat profilarea lipidomică a Epi pentru a evalua dacă expansiunea adiposă sănătoasă a însoțit profilurile lipidice modificate, inclusiv clasele individuale de lipide. Tratamentul cu Ipra a scăzut ceramida (CER) [FA24: 1] și sfingomielina (SM) [FA24: 1] și a crescut SM [FA18: 0] la șoarecii alimentați cu HFD (Figura suplimentară 6a). Deficiența CCR2 la șoarecii hrăniți cu HFD în timpul tratamentului cu Ipra a avut, de asemenea, efecte similare asupra subspeciilor CER și SM din Epi (Figura suplimentară 6b). Ipra a avut un efect redus asupra di- și triacilglicerolului sau subspeciei acizilor grași liberi la Epi de șoareci hrăniți cu HFD (datele nu sunt prezentate).
Dieta ketogenică fenocopează expansiunea țesutului adipos la șoarecii tratați cu Ipra
Am examinat în cele din urmă dacă corpurile cetonice ar putea provoca expansiunea grăsimii fără a deteriora metabolismul sistemic al glucozei in vivo, și dacă însoțește o scădere Il15 așa cum se observă în macrofagele peritoneale polarizate M1 cultivate (Fig. 4d). Șoarecii masculi WT de opt săptămâni au fost hrăniți cu o dietă ketogenă timp de 4 săptămâni; după 2 săptămâni de dietă ketogenică, nivelurile serice de BHB au fost semnificativ crescute în comparație cu dieta de control (Fig. 5a). Dieta ketogenică nu a modificat greutatea corporală la șoarecii WT în comparație cu cei hrăniți cu dieta de control (Fig. 5b). Dieta ketogenică a crescut semnificativ greutatea Epi (Fig. 5c), fără a induce hiperglicemie sau hiperinsulinemie (Fig. 5d). Mai mult, dieta ketogenică este suprimată semnificativ Il15 expresie cu o crescută Pck1 expresie în Epi (Fig. 5e). Analiza lipidomică a confirmat, similar cu deficiența de Ipra și CCR2, dieta ketogenică a scăzut CER [FA24: 1] și SM [FA24: 1] și a crescut SM [FA18: 0] în Epi (Figura suplimentară 6c).
Discuţie
Luate în considerare din lucrările anterioare care raportează efectele inhibitorilor SGLT2 asupra șoarecilor hrăniți cu HFD, efectele inhibitorilor SGLT2 asupra greutății corporale și adipozității variază de-a lungul studiilor; tratamentul cu tofogliflozin a suprimat creșterea în greutate corporală indusă de HFD, precum și progresia steatozei hepatice, atunci când este administrată timp de 20 de săptămâni începând cu începutul hrănirii cu HFD 22. În schimb, tratamentul de 4 săptămâni cu remogliflozin după 11 săptămâni de hrănire cu HFD a atenuat steatoza hepatică fără a modifica creșterea în greutate corporală 23. Un alt raport a arătat că luseogliflozina a scăzut greutatea ficatului și nivelurile serice de ALT la șoarecii tratați cu STZ hrăniți cu HFD, fără a afecta creșterea în greutate corporală 24. Luate împreună, deși mecanismele precise rămân necunoscute, aceste observații sugerează că protocolul de studiu, în special în momentul administrării inhibitorilor SGLT2 în timpul hrănirii HFD și al unui model de șoarece, ar putea afecta creșterea în greutate corporală la șoareci.
Pe lângă un rozător, un studiu la om a demonstrat că inhibitorul SGLT2 empagliflozin a determinat o creștere adaptivă a aportului de energie la pacienții cu diabet zaharat de tip 2, ceea ce a cauzat o pierdere în greutate substanțial mai mică decât cea așteptată din energia disipată din cauza glicozuriei 25. Acesta sugerează că inhibarea SGLT2 provoacă în principiu răspunsuri biologice similare ale apetitului și aportului de energie la om și șoareci. Deși studiile anterioare la om 26,27,28 au arătat în mod constant că tratamentul inhibitorilor SGLT2 reduce greutatea corporală ca medie, datele noastre anterioare au demonstrat că aproximativ 20% dintre pacienții tratați cu Ipra nu au realizat mai mult de 1% din reducerea greutății corporale 2. În timp ce studiile efectuate la oameni descriu predominant pierderea în greutate cu tratamentul cu inhibitori SGLT2, efectul inhibitorilor SGLT2 asupra greutății corporale și adipozității în studiile murine a fost variabil.
S-a raportat că alți agenți antidiabetici, cum ar fi tiazolidinediona 10, inhibitorul dipeptidil peptidazei-4 și metformina 30, au efecte directe asupra ATM-urilor prin inducerea unei deplasări dominante M2. Cu toate acestea, având în vedere nivelurile reduse de expresie ale Slc5a2 în macrofage, adipocite, celule SVF și țesut adipos, este puțin probabil ca Ipra să aibă efecte directe asupra acestor celule sau asupra unui țesut. În contextul comorbidităților metabolice asociate obezității, s-a arătat că hiperglicemia interferează cu acțiunea IL-4 la polarizarea asemănătoare cu M2 în macrofage, astfel cum se evaluează prin expresia scăzută a genelor legate de M2 și activitatea funcțională redusă a arginazei 31. Prin urmare, îmbunătățirea hiperglicemiei ar putea fi considerată drept unul dintre mecanismele pentru modificarea raportului de tip M1/M2 de tip ATM la șoarecii tratați cu Ipra.
Dintre genele legate de M1 din țesutul adipos modificate prin tratamentul cu Ipra, Il15 este semnificativ reglat în SVF la șoareci tratați cu Ipra. În concordanță cu un raport anterior 35, imunocolorarea pentru IL-15 în Epi sugerează că ATM-urile sunt presupuse a fi sursa celulară de IL-15 în SVF. Il15 sa raportat că ablația la șoareci duce la o creștere semnificativă în greutate, independent de apetit; în special, șoarecii nu prezintă inflamație asociată cu obezitatea, caracterizată ca o creștere a concentrațiilor serice de IL-6 și a factorului de necroză tumorală-α 36. În plus, în concordanță cu observația noastră, tratamentul adipocitelor umane diferențiate cu IL-15 recombinant a dus la scăderea depunerii de lipide, indicând efectul său inhibitor direct asupra adipogenezei 14. Deși relevanța patologică a IL-15 în extinderea țesutului adipos sănătos necesită studii suplimentare, reglarea descendentă indusă de Ipra Il15 în celulele SVF, posibil în ATM-uri, pare să promoveze expansiunea adipocitelor într-un mod paracrin.
Deoarece mediul condiționat de țesut adipos de la șoareci hranați cu HFD tratați cu Ipra a crescut Mrc1 și Mgl2 expresia în macrofagele peritoneale în comparație cu șoarecii alimentați cu HFD tratați cu vehicul, substanțele derivate din țesutul adipos, precum și corpul cetonic, sunt considerați posibili factori diferiți și unici pentru a induce modularea funcțională a ATM-urilor indusă de Ipra. Se știe că diferite molecule de semnalizare eliberate din celulele pe moarte acționează ca chimioatractori și afectează răspunsurile imune 39,40,41. În țesuturile adipoase, am arătat anterior că lectina de tip C indusă de macrofage (Mincle), un senzor patogen pentru Mycobacterium tuberculosis, este localizat la ATM-uri care constituie CLS și activat de un ligand endogen eliberat din adipocitele pe moarte 42. Activarea Mincle induce răspunsuri inflamatorii și producerea de matrice extracelulară în macrofage, care pot deteriora inflamația țesutului adipos și limita hipertrofia adipocitelor indusă de HFD pentru a inhiba acumularea de lipide ectopice. Prin urmare, substanțele provenite din adipocite moarte și/sau moarte au fost, de asemenea, propuse pentru a afecta local caracterele ATM-urilor, iar moartea redusă a adipocitelor indusă de Ipra poate afecta fenotipurile ATM-urilor.
În concluzie, acest studiu a dezvăluit mecanismele mediate de ATM prin care inhibarea SGLT2 a promovat expansiunea sănătoasă a adiposului. Mai mult, ATM-urile sunt propuse ca potențiale ținte terapeutice pentru comorbiditățile metabolice asociate obezității prin modificările pe care le induc în caracteristicile țesutului adipos.
- Lipoliza țesutului adipos revizuită (din nou!) Implicarea lactatului în acțiunea antipolitică a insulinei -
- Pepenele amar îmbunătățește controlul glicemic și inflamația în țesutul adipos al obezilor și diabetului
- Țesutul adipos, dieta și îmbătrânirea - ScienceDirect
- O dietă bogată în grăsimi mărește țesutul adipos al măduvei osoase (MAT), dar nu modifică trabecularul sau
- Subtipurile receptorilor de angiotensină reglează reînnoirea și remodelarea țesutului adipos - Tyurin - Kuzmin -