Subiecte
Abstract
Introducere
Material si metode
Model animal
In vivo electrofiziologie
Analiza datelor
i.p. Test de toleranță la glucoză, i.c.v. injectarea insulinei și măsurători hormonale
Standard i.p. testarea toleranței la glucoză a fost efectuată folosind o soluție de glucoză 20% într-o doză ajustată în funcție de greutate (2 mg/g greutate corporală). Procedura a început la 7-8 ore după îndepărtarea alimentelor și inițierea anesteziei. Prelevarea de sânge din coada întreagă a fost efectuată la 0, 30, 60, 90 și 120 de minute. Nivelurile de glucoză au fost măsurate folosind un instrument de măsurare standard (Contour XT, Bayer, Germania). Măsurătorile insulinei și leptinei au fost efectuate folosind kituri ELISA disponibile comercial (10-1247-01, Mercodia, Suedia, Cat.Nr. MOB00, R&D Systems, SUA). Pentru informații suplimentare, consultați materialul suplimentar. Injecția de insulină intracerebroventriculară a fost efectuată utilizând o canulă de tip contondent de 33 g, fixată pe o seringă Hamilton de 10 μl (WorldPrecision Instruments, FL, SUA). Cel de-al treilea ventricul a fost vizat folosind coordonatele stereotactice AP: -2,3, ML: 0,0, DV: -8,5 mm. 2 μl de 4mU/l insulină sau soluție salină au fost injectate într-un ritm de 1 μl/min printr-o pompă de seringă de precizie (Micro4 ™, World Precision Instruments, FL, SUA).
Declarație privind disponibilitatea datelor
Seturile de date generate și analizate în timpul studiului curent sunt disponibile de la autorul corespunzător, la cerere rezonabilă.
Statistici
Calculele statistice au fost efectuate folosind SPSS 20.0 (IBM Statistics, Germania). Toate valorile sunt prezentate ca eroare medie și standard a mediei (SEM). Parametrii metabolici au fost transformați în jurnal. Distribuția normală a fost testată folosind testul Shapiro Wilk. Parametrii metabolici distribuiți în mod normal și datele electrofiziologice au fost analizate folosind testul t al elevului. Variabilele înclinate (greutatea corporală) au fost analizate folosind testul Mann-Whitney-U. Pentru analiza subgrupurilor au fost utilizate în mod corespunzător testul ANOVA unidirecțional și testul Kruskall-Wallis. Corecția Bonferroni a fost aplicată pentru ajustarea pentru comparații multiple. Pentru a testa o interacțiune de timp în grup, s-a efectuat măsurarea repetată a ANOVA. ANOVA cu măsuri repetate a fost utilizat pentru a analiza diferențele de activitate beta între diferitele condiții metabolice. Corelațiile au fost calculate prin coeficientul de corelație al rangului Spearman. Am folosit un model de regresie liniară pentru ajustarea pentru activitatea corticală a undelor lente, punctul de timp al prelevării probelor și greutatea corporală pentru evaluarea asocierilor dintre activitatea oscilatorie și nivelurile de insulină. Nivelul de semnificație a fost ales ca p
Rezultate
Caracteristici metabolice de bază
În cohorta principală, șobolanii au fost repartizați aleatoriu pentru a primi fie un chow normal (controale), fie o dietă bogată în grăsimi (HFD) pentru o perioadă de 4 săptămâni. Grupul HFD a atins o greutate corporală semnificativ mai mare decât animalele martor potrivite pentru vârstă (Tabelul 1). Valorile inițiale ale glucozei nu au prezentat nicio diferență semnificativă între cele două grupuri (Tabelul 1). Standardul i.p. testul de toleranță la glucoză (GTT) a fost efectuat în timpul înregistrărilor electrofiziologice sub anestezie cu uretan, relevând o zonă semnificativ mai mare sub nivelul curbei (ASC) de glucoză pentru grupul HFD comparativ cu martorii. În conformitate, nivelurile de insulină la momentul inițial, precum și ASC ale insulinei au fost mai mari la animalele HFD (Tabelul 1). Concentrațiile bazice de leptină serică au fost mai mult decât dublate în grupul HFD comparativ cu martorii (Tabelul 1). Cursul de timp al nivelului de glucoză și insulină în timpul i.p. GTT sunt prezentate în materialul suplimentar (Figura S2). De remarcat sunt concentrațiile serice crescute în general și creșterea destul de constantă pe durata testului de 2 ore, despre care se știe că se manifestă sub anestezie generală cu uretan.
Grupul HFD a prezentat o putere beta crescută în ansa cortico-bazală a ganglionilor la momentul inițial
Am efectuat simultan înregistrări potențiale de câmp local de la mPFC, VTA și NAC la toate animalele. Epocile de activare corticală globală robustă (stări activate) au fost analizate la momentul inițial și în prima și a doua jumătate a testului de toleranță la glucoză. Pentru a exclude faptul că uretanul ar fi putut avea un efect diferit asupra stărilor de sincronizare corticală la animale cu diferite compoziții corporale, am comparat puterea oscilațiilor de frecvență joasă (Tabelul 2 Analiza statistică a puterii medii și iCoherența benzii de frecvență beta joase în condițiile de bază.
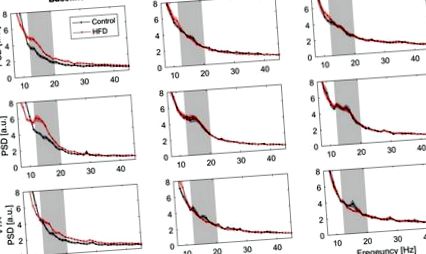
Analiza densității spectrale de putere (PSD) pe un spectru de frecvență de la 7 la 45 Hz descris ca unitate medie arbitrară [A.U.] pentru pubele de frecvență de 1 Hz ± SEM. Rândul unu: cortexul prefrontal medial (mPFC), rândul doi: regiunea cochiliei nucleului accumbens (NAC) și rândul trei: zona tegmentului ventral (VTA). Coloana din stânga prezintă datele PSD pentru starea inițială, măsurate înainte de inițierea testului de toleranță la glucoză (Control N = 12, HFD N = 20). Coloana din mijloc prezintă datele PSD măsurate în prima oră a testului de toleranță la glucoză (Control N = 11, HFD N = 18) și coloana din dreapta în a doua oră a testului (Control N = 11, HFD N = 18). Zona gri marchează spectrul de frecvență beta scăzut (13-20 Hz).
Grupul HFD a arătat o scădere selectivă a coerenței cortico-subcorticale în banda de frecvență beta la momentul inițial
Pentru a analiza conectivitatea funcțională în cadrul buclei limbice a rețelei cortex-ganglionilor bazali am analizat coerența dintre țintele corticale și subcorticale înregistrate (Fig. 2). La valorile inițiale iCoherence calculate pentru combinația de mPFC și NAC, precum și pentru mPFC și VTA au arătat o coerență medie semnificativ mai mică în banda de frecvență beta scăzută la animalele hrănite cu o dietă bogată în grăsimi (Tabelul 2). Nu s-a detectat nicio diferență consistentă pentru iCoherența dintre VTA și NAC.
Analiza iCoherence pe un spectru de frecvență de la 7 la 45 Hz descris ca o coerență medie pentru coșurile de frecvență de 1 Hz ± SEM. Rândul unu: cortexul prefrontal medial (mPFC) cu regiunea învelișului nucleului accumbens (NAC), rândul doi: cortexul prefrontal medial (mPFC) cu zona tegmentului ventral (VTA) și rândul trei: regiunea învelișului nucleului accumbens (NAC) cu zona tegmentului ventral ( NAC) WTA). Coloana din stânga prezintă datele PSD pentru starea inițială, măsurate înainte de inițierea testului de toleranță la glucoză (Control N = 12, HFD N = 20). Coloana din mijloc prezintă datele PSD măsurate în prima oră a testului de toleranță la glucoză (Control N = 11, HFD N = 18) și coloana din dreapta în a doua oră a testului (Control N = 11, HFD N = 18). Zona gri marchează spectrul de frecvență beta scăzut de la 13 la 20 Hz.
În hiperglicemie, oscilațiile beta au crescut și coerența beta a scăzut la animalele martor, rămânând stabilă în grupul HFD
După finalizarea înregistrărilor de bază am continuat cu înregistrările LFP după un i.p. injectarea a 2 mg/g greutate corporală de glucoză. Densitățile spectrale de putere au fost calculate după prima și a doua oră după injectare (Fig. 1). Analiza puterii pentru primul segment de timp a arătat o putere beta scăzută semnificativ crescută la animalele martor (figurile 1 și 3), care a fost cea mai pronunțată în NAC. În grupul cu diete bogate în grăsimi, puterea beta redusă a rămas la nivelul crescut observat înainte de provocarea glucozei (Fig. 3). Acest efect a rămas stabil pentru a doua oară. Analiza ANOVA cu măsură repetată a relevat o interacțiune semnificativă în grupul de timp (Teste ale contrastelor subiecților, Pătrat mediu 3,91, p Figura 3
Puterea oscilatorilor beta NAC este corelată cu markerii metabolici la momentul inițial
Pentru a evalua în continuare posibilele interacțiuni între fenomenele oscilatorii din sistemul cortico-striatal limbic și profilul metabolic în general, am analizat corelațiile activității beta NAC inițiale de bază (13-20 Hz) și a puterii de frecvență de vârf NAC beta cu markerii metabolici înregistrați ai cohorta de animale întregi, independent de atribuirea grupului (Tabelul de materiale suplimentare S2). Analiza corelației bivariate a relevat asocieri puternice pozitive între puterea NAC beta de vârf cu greutatea corporală (r = 0,49, p = 0,004), ASC a glucozei (r = 0,46, p = 0,008) și nivelurile serice de leptină (r = 0,49, p = 0,005; dispersie parcele prevăzute în Figura suplimentară a materialului S3). Cea mai puternică corelație pozitivă a constat între puterea de vârf NAC beta și nivelurile inițiale de insulină (Fig. 4). În analiza de regresie liniară această asociere (adj. R² = 0,44, ß = 0,68, p Figura 4
Corelația puterii NAC beta de vârf și a nivelurilor de insulină măsurate înainte (N = 31) și în timpul primei (N = 29) și a doua jumătate (N = 29) a testului de toleranță la glucoză.
Injecția cu insulină ICV crește puterea oscilatorie beta NAC
Pentru a investiga dacă creșterea observată a activității beta oscilatorii în NAC a rezultat din semnalizarea centrală a insulinei, am efectuat un set suplimentar de experimente la animale de control slab. Puterea oscilatorie beta medie în banda de frecvență beta scăzută a CNA a fost măsurată înainte și după injecția centrală de insulină (Fig. 5). Aplicarea insulinei ICV a indus o creștere semnificativă a puterii beta NAC medii (pre-injecție 3,03 [au], post injecție 3,64 [au], p = 0,031) în timp ce injecția simulată nu a indus nicio modificare (pre injecție 3,10, post injecție 2,87, p = 0,279) . De remarcat, vârful beta indus a avut ca maxim în jur de 19-20 Hz, în timp ce vârful beta observat după aplicarea sistemică a glucozei a crescut la aproximativ 15 Hz. Nu au existat diferențe semnificative între diferențele de grup în ceea ce privește greutatea corporală (grupul de insulină 387,1 g față de grupul simulat 384,9 g) și timpul dintre AS și aplicarea insulinei (preinjecție: grupul de insulină -21,0 min față de grupul fals -19,5 min, p = Post injecție: grupul de insulină +33,4 min față de grupul fals după injectare +42,8 min, p = 0,303).
Discuţie
Concluzie
În studiul de față, suntem primii care identifică activitatea oscilatorie beta diferențială și coerența în ansa limbică a ganglionilor cortico-bazali la obezitate, care este puternic corelată cu nivelurile serice de insulină și leptină. Puterea oscilatorie beta NAC este sporită de hiperglicemie și poate fi indusă prin aplicarea directă a insulinei în sistemul nervos central. Datele noastre susțin ipoteza că obezitatea și rezistența la insulină pot fi considerate ca tulburări ale circuitului, caracterizate prin activitate disfuncțională a rețelei oscilatorii în ansa limbică a ganglionilor cortico-bazali. Studiile viitoare ar trebui să investigheze rolul activității creierului oscilator în fiziopatologia obezității și a rezistenței la insulină pentru a permite dezvoltarea unor terapii neuromodulatoare specifice.
Dezvăluire
Consultanți: Medtronic, Sf. Andrea Kühn | Jude Medical, Boston Scientific. Comitete consultative: Boston Scientific, Medtronic.
- Oxidul nitric sintaz inductibil promovează rezistența la insulină în obezitate GI și știri despre hepatologie
- Niveluri scăzute de clusterină în lipoproteinele de înaltă densitate asociate cu rezistența la insulină, obezitate și
- Rezistența la insulină legătura dintre obezitate și bolile cardiovasculare - ScienceDirect
- Cacao ingerat poate preveni obezitatea indusă de dietă bogată în grăsimi prin reglarea expresiei genelor pentru
- Inflamație, rezistență la insulină și obezitate SpringerLink