Proteinele PDZ sunt proteine care interacționează cu o varietate de proteine membranare și citosolice, modulează activitățile partenerilor lor de legare, asociază partenerii cu complexe de proteine cito-scheletice lângă membrană și recrutează proteine de semnalizare (Kim și Sheng, 2004).
Termeni asociați:
- Enzimă
- Proteină
- Mutaţie
- Membrana celulara
- Secvența terminalului Carboxy
- Domeniul PDZ
- Ligand
- Fosforilarea
Descărcați în format PDF
Despre această pagină
Farmacologia receptorilor cuplați cu proteine G
Guillermo Romero,. Peter A. Friedman, în Advances in Pharmacology, 2011
Abstract
Mișcări ale clorurilor peste membranele celulare
Peying Fong, Michael A. Gray, în Advances in Molecular and Cell Biology, 2006
1 Nomenclatură
Proteinele PDZ se caracterizează prin prezența a cel puțin unui motiv structural distinct, domeniul PDZ. Regiunile domeniului PDZ sunt formate din aproximativ 80-90 aminoacizi. Studiile structurale indică faptul că acești aminoacizi sunt organizați ca șase β-catene antiparalele și două α-elice care formează o canelură de legare a ligandului. Nomenclatura favorizată în prezent, PDZ, apare din faptul că aceste motive au fost inițial recunoscute în proteinele din densitățile postsinaptice ale creierului șobolanului (PSD - 95; Cho et al., 1992), joncțiunile septate care leagă Drosophila epithelia (Discuri proteine mari, produsul a genei supresoare tumorale dlg) (Woods și Bryant, 1991) și TJ-urile epiteliilor de mamifere (ZO-1) (Itoh și colab., 1993; Willott și colab., 1993). Cu toate acestea, domeniile PDZ au fost, de asemenea, denumite domenii DHR (pentru regiunea homologă mare a discurilor) și GLGF (după un motiv conservat de secvență de aminoacizi) în literatura de început.
Cho et al. (1992) au recunoscut mai întâi omologia structurală existentă între PSD-95 și proteina Discs Large identificată anterior. Interesant, nu numai că ambele posedă trei domenii PDZ la termenii lor N-respectivi, dar împărtășesc și o structură generală similară a domeniului: domeniile PDZ sunt urmate de un domeniu src omologie 3 (SH3), precum și o guanilat kinază (GK) domeniu. Curând după aceea, elucidarea structurii primare a proteinei epiteliale TJ, ZO-1, a dezvăluit, de asemenea, același plan general al corpului. Este important să rețineți că, deși acești trei membri definitori ai proteinelor din domeniul PDZ constituie, de asemenea, o clasă de guanilat kinaze (MAGUK) asociate membranei, nu toate proteinele PDZ sunt MAGUK. După cum se va discuta, diverse proteine conțin domenii PDZ. Prin legarea lor la secvențe specifice de peptide C-terminale, secvențe localizate intern și chiar la regiuni PDZ din liganzi, domeniile PDZ permit în cele din urmă o gamă diversă de funcții extrem de specializate.
Volumul 1
Exprimarea polarizată a proteinelor PDZ în celulele epiteliale
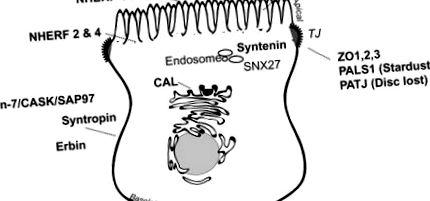
Un număr de proteine PDZ sunt exprimate preferențial la domeniile de membrană polarizată sau în compartimentele critice de sortare (Figura 14.2), unde efectuează operațiuni de retenție/sortare și organizează complexe de semnalizare locale în localizări polarizate. 34 Exemple de proteine PDZ care locuiesc predominant la membrana basolaterală a anumitor epitelii intestinali și renali includ sintrofina 35 (a se vedea „Complexul de proteine asociate cu distrofina” de mai jos), Lin-7 36,37 (a se vedea Lin-7/CASK/SAP97, ”Mai jos), proteina care interacționează cu ErbB, ERBIN, 38 și anumiți membri ai membranei asociate familiei de guanilat kinază a proteinelor PDZ, cum ar fi CASK, 39 PSD-93, 40 și SAP97 (alias Disc omolog mare 1 41). Alte proteine PDZ, inclusiv factorii de reglare a schimbului de hidrogen de sodiu (vezi NHERF, mai jos), Shank2E, 42 și PSD-95, 40 sunt exprimate în principal pe membrana apicală sau în apropierea acesteia. Unele proteine PDZ, cum ar fi zonula occludens, PALS1 (Stardust) și PATJ (Disc pierdut), 43 joacă roluri importante în generarea și întreținerea joncțiunii strânse. 44 Altele, cum ar fi CAL, care se află în principal în Golgi 45 sau SNX27, 46 și sintenină, 47,48, care se găsesc în endozomi, se află în compartimente de sortare biosintetice sau endocitotice.
Figura 14.2. Proteine PDZ majore din celulele epiteliale.
Domeniul PDZ care conține proteine se localizează diferențiat la marginile periei de celule epiteliale, domenii subapicale, endosomi, joncțiuni strânse și membrane basolaterale.
Un motiv de legare PDZ poate servi ca un semnal polarizat de sortare 49 sau de retenție. 50 Unul dintre primele exemple a evoluat din studii efectuate cu transportoare GABA sau GAT 51; ștergerea motivului de legare a PDZ din izoforma apicală GAT-3 a determinat transportorul să se localizeze aleatoriu atât pe membranele apicale cât și pe cele bazolaterale. 52 De asemenea, s-a constatat că expresia membranei bazolaterale a mai multor proteine de membrană necesită un motiv de legare a PDZ. De exemplu, receptorii ERBB, care joacă roluri cruciale în morfogeneză și oncogeneză, interacționează cu o proteină bazolaterală PDZ, numită ERBIN, și necesită un motiv de legare a PDZ pentru exprimarea bazolaterală a membranei. 38 ERBIN este direcționat către membrana basolaterală prin domeniul său de repetare bogat în leucină. 53 Expresia eficientă a membranei basolaterale a unui număr de transportori care interacționează cu proteina basolaterală PDZ Lin-7 necesită, de asemenea, un site intact de legare a PDZ (vezi mai jos).
Reglare presinaptică de către liprine
K. Miller, D. Van Vactor, în Enciclopedia Neuroștiinței, 2009
Liprin-α, GRIP și GluR2
GRIP este o proteină care conține un domeniu multi-PDZ care leagă liprina-α, precum și receptorii și liganzii de efrină și membrul familiei de proteine motorii kinesin-3 KIF1A. GRIP-urile au fost sugerate pentru a media transportul receptorilor de glutamat, stabilizarea receptorilor în interiorul densităților postsinaptice și sortarea receptorilor interiorizați. GRIP1 se găsește în preparatele sinaptice și în compartimentele intracelulare. Aceasta include vezicule de transport supuse receptorilor de glutamat. Analiza genetică la șoareci arată că GRIP1 este necesar devreme în timpul dezvoltării, deoarece un knockout GRIP1 este letal embrionar în ziua 12 și embrionii suferă de defecte în formarea joncțiunilor dintre derm și epiderm.
Având în vedere dovezile puternice că (1) liprin-α interacționează cu GRIP, (2) DGRIP se găsește în mușchi și (3) interacțiunea dintre liprin-α și GRIP a fost implicată în gruparea receptorilor de glutamat, este surprinzător faptul că perturbarea liprin-α nu are ca rezultat o scădere a sensibilității postsinaptice (adică amplitudinea potențialelor de joncțiune mini-excitatorii). Cu toate acestea, întrucât salvarea completă a funcției sinaptice se poate face prin exprimarea selectivă a liprinei-α (SYD-2) în neuroni, este posibil ca liprina-α să joace un rol minor în funcționarea postsinaptică la nevertebrate și un rol mai important în sinapsele vertebratelor.
Distrofii musculare
Patogeneza moleculară
ZASP (proteina conținând domeniu PDZ cu discuri Z, alternativ, produs genic LDB3) este o componentă a discului Z. Interacțiunile sunt cunoscute cu α-actinina (vezi Figura 16.1) (Selcen și Engel, 2005), cu proteinele ALP și FATZ (Huang și colab., 2003; Klaavuniemi și colab., 2006) și au fost, de asemenea, prezentate cu nebuletă și protein kinază. C (și Velthuis și colab., 2007). ZASP este membru al familiei de proteine PDZ/LIM care, printre altele, sunt implicate în dinamica actinei (te Velthuis și colab., 2007). Majoritatea mutațiilor care cauzează distrofia distală sunt localizate în exonul 6. Această regiune a proteinei este importantă pentru izoformele specifice mușchilor scheletici și conține un domeniu ZM conservat necesar pentru legarea α-actininei (Klaavuniemi și colab., 2006). Prin imunohistochimie, agregările de proteine miofibrilare din probele de mușchi ale pacienților prezintă mai multe anomalii cu miotilina, αB-cristalina și desmin decât ZASP în sine (Griggs și colab., 2007). ZASP poate furniza astfel o funcție de conducere pentru localizarea acestor alte componente ale discului Z și poate avea legătură cu faptul că șoarecii knock-out ZASP prezintă un fenotip sever, în timp ce șoarecii knotout de miotilină au un fenotip mai blând (Zhou și colab., 2001).
Miopatiile distale
Genetica moleculară
Două mutații în ZASP (proteina conținând domeniu PDZ cu discuri Z, denumite și gena LDB3) sunt asociate frecvent cu acest tip de miopatie distală. 42 Mutația cauzală A165V din familia Markesbery-Griggs s-a dovedit a fi o mutație fondatoare europeană antică bazată pe un haplotip comun relativ scurt în jurul mutației în șase familii fără legătură testate. 17 Cealaltă mutație ZASP recurentă, A147T, provoacă un fenotip identic. Aceste mutații sunt localizate în domeniul de legare la actină al ZASP și provoacă întreruperea filamentelor de actină ale mușchilor scheletici. 41
Volumul 2
Interacțiuni proteină-proteină ale co-transportorilor Na/Pi de tip II
Sortarea intracelulară, reglarea hormonală și stabilitatea la membrana plasmatică a unei proteine date pot fi controlate prin asocierea acesteia cu partenerii care interacționează. Prin drojdie-două ecrane hibride au fost identificate mai multe proteine care interacționează cu NaPi-IIa și NaPi-IIc. Nu au fost identificate până acum proteine care ar putea interacționa cu transportorul PiT-2.
Proteine asociate NaPi-IIa
NaPi-IIa interacționează, printre altele, cu mai multe proteine care conțin domeniu PDZ, și anume cei patru membri ai familiei NHERF 76,84,91,101 și Shank2E 26 (Figura 68.3). Important, aceste cinci proteine sunt localizate fie la nivelul BBM proximal renal (NHERF1, NHERF3 și Shank2E), fie în imediata apropiere (NHERF2, NHERF4). 84.159 cel mai frecvent
Studiile biochimice au indicat că interacțiunea NaPi-IIa cu proteinele PDZ necesită prezența ultimelor trei reziduuri de aminoacizi (TRL) și implică domenii PDZ particulare în cadrul NHERF. 91 NaPi-IIa interacționează cu primul domeniu PDZ al NHERF1, iar această interacțiune este reglementată hormonal de un mecanism care implică fosforilarea NHERF1 (vezi mai jos). 94.95.113.114 Absența NHERF1 sau prevenirea asocierii sale cu NaPi-IIa duce la localizarea greșită a cotransportatorului. 86,93,171 Astfel, șoarecii cu deficit de NHERF1 sunt caracterizați de hiperfosfaturie datorită exprimării reduse a NaPi-IIa în BBM. 86 Deoarece BBM proximal este puternic îmbogățit în actină, mecanismul molecular prin care NHERF1 controlează expresia apicală a NaPi-IIa se poate baza pe capacitatea NHERF1 de a se lega de citoscheletul de actină prin domeniul său de legare a ERM. 159 Deși sunt șoferi fosfaturici, șoarecii cu deficit de NHERF1 sunt normofosfatemici, 86 sugerând un mecanism compensator extra-renal. Fosfaturia normală și expresia apicală normală a NaPi-IIa au fost observate la șoareci NHERF2 -/-. 98.159 cea mai frecventă
NHERF3, cunoscut anterior ca PDZK1, se colocalizează, de asemenea, cu NaPi-IIa la nivelul BBM al tubulilor proximali. 76 Spre deosebire de NHERF1, NHERF3 nu are un domeniu capabil să se lege de citoscheletul de actină. Cu toate acestea, prezența sa la BBM proximal poate fi explicată prin capacitatea sa de heterodimerizare cu NHERF1. 76.91 Cu toate acestea, rolul fiziologic al interacțiunii NHERF3 cu NaPi-IIa rămâne necunoscut, deoarece absența NHERF3 nu afectează nici expresia, nici reglarea NaPi-IIa. 11.99
Proteine asociate NaPi-IIc
NaPi-IIc interacționează cu NHERF1 și NHERF3, dar nu cu celelalte proteine PDZ care se asociază cu NaPi-IIa. 135 Cu toate acestea, NaPi-IIc nu conține un motiv tipic de legare a PDZ C-terminal și domeniile moleculare implicate în interacțiuni sunt diferite de cele ale NaPi-IIa. Spre deosebire de NaPi-lla, 99 adaptarea cronică a NaPi-llc la o dietă cu conținut scăzut de Pi este afectată la șoarecii cu deficit de PDZK1. 49
Semnalizarea hipopotamului în proliferarea, migrația și angiogeneza celulară
Până la 14-3-3 proteine influențează semnalizarea hipopotamului?
Pentru a recapitula, TAZ este co-activatorul transcripțional care posedă domeniul de interacțiune cu proteina PDZ. După ce sunt reglementate negativ de fosforilarea mediată de Lats, TAZ și YAP conduc la manifestarea efectelor supresoare ale căii Hippo asupra proliferării celulare și inducerii apoptozei și inhibării angiogenezei. TAZ este o proteină de legare 14-3-3 și, prin urmare, în mod legitim rolul proteinelor 14-3-3 necesită discuții.
Proteinele 14-3-3 sunt proteine exprimate omniprezent și asociate cu semnalizarea proliferării celulare, apoptoză, dinamică citoscheletală și joacă roluri cruciale în dezvoltarea și diseminarea tumorii. Unii sunt supresori tumorali, iar alții promotori. 14-3-3s funcționează prin legarea la motivele fosforilate-serină/treonină pe proteinele lor țintă și le modulează funcția. Acestea influențează mai multe căi de semnalizare în acest mod și reglează pozitiv sau negativ motilitatea și invazia celulară, proliferarea și apoptoza celulară, EMT și metastaza. Un aspect proeminent al activității 14-3-3 este acela că se leagă de proteine de semnalizare importante și reglează translocația și localizarea și dispunerea lor intracelulare cu consecințe grave asupra transducției semnalului.
Modul de acțiune prin care 14-3-3 proteine influențează semnalizarea hipopotamului face obiectul unor investigații. S-au concentrat modificările în localizarea subcelulară a moleculelor efectoare cauzate de interacțiunile cu proteinele 14-3-3. Translocarea nucleară a omologului Merlin FRMD6, care este un regulator în amonte al Hippo, este îngreunată de legarea 14-3-3 (Meng FB și colab., 2015). Deoarece Merlin reglează activarea MST1 și MST2, activarea Lats și inactivarea YAP, inhibarea mișcării în nucleul FRMD6 ar opri funcția supresoare a Hippo.
Un alt mecanism sugerat este că translocarea YAP în nucleu ar putea fi împiedicată prin legarea la proteinele 14-3-3, cum ar fi 14-3-3σ la YAP. Când se previne o astfel de legare, efectele inhibitoare ale 14-3-3σ asupra proliferării celulare sunt blocate (Sambandam și colab., 2015). Anterior Lei QY și colab. (2008) au raportat că fosforilarea Lats a creat 14-3-3 situri de legare în TAZ și că TAZ părea apoi sechestrată de 14-3-3 și păstrată în citoplasmă, ceea ce a dus la o inactivare eficientă a TAZ. Nu ar fi în afara contextului să subliniem aici că 14-3-3ζ, care promovează proliferarea celulară și agresiunea tumorii, reglează în jos 14-3-3σ. Acest lucru a fost sugerat ca un mecanism implicat în funcția dublă a TGF-β ca efect supresor în etapele timpurii ale tumorigenezei și ca promotor al progresiei în etapele ulterioare ale dezvoltării tumorii. Reglarea descendentă a 14-3-3σ pare a fi legată de modificarea partenerilor de semnalizare Smad și de trecerea TGF-β de la funcția sa de supresoare tumorală la modul promotor tumoral (Xu J și colab., 2015).
Proteinele 14-3-3 angajează YAP și acest complex se leagă de endotelial-cadherină vasculară, care apare la joncțiunile celulelor endoteliale prevenind în mod eficient translocația subcelulară a YAP (Giampietro și colab., 2015). După cum sa menționat anterior, verteporfina inactivează YAP și acest lucru are loc prin reglarea în sus și legarea de 14-3-3σ. Acest lucru sechestrează în mod eficient YAP către compartimentul citoplasmatic și vizează degradarea mediată de proteazom (Wang C și colab., 2016).
Proteina 14-3-3 ar putea fi capabilă să influențeze Hippo prin interferența cu funcția kinazelor Lats. Fosforilarea YAP creează site-uri de legare pentru proteinele 14-3-3. Situl de fosforilare Lats al izoformei CHO1 a kinesinei este, de asemenea, un situs de legare pentru 14-3-3 (Fesquet și colab., 2015) și acest lucru ar putea fi o considerație relevantă în funcția izoformelor kinesinei în procesul de citokineză. Defosforilarea TAZ și prevenirea legării sale 14-3-3 facilitează localizarea nucleară. S-a demonstrat că semnalizarea Wnt canonică activează TAZ în acest mod (Byun MR și colab., 2014). În mod similar, defosforilarea YAP2 are ca rezultat acumularea sa în nucleu și la activitatea transcripțională (Wang P și colab., 2011).
Mișcări ale clorurilor peste membranele celulare
Haley J. Shandro, Joseph R. Casey, în Advances in Molecular and Cell Biology, 2006
Domeniul C PDZ - Interacțiuni mediate
Transportorii SLC26 au un domeniu PDZ de tip 1 la capătul C-terminal extrem de citoplasmatic. Motivul de interacțiune pentru proteinele PDZ este C - terminal T/SXϕ, unde ϕ este un aminoacid hidrofob (Caplan, 1997; Songyang și colab., 1997). Proteinele care conțin PDZ ajută la menținerea polarității și funcției celulare (Aroeti și colab., 1998; Fanning și Anderson, 1999). Funcția motivelor PDZ în proteinele SLC26 nu este pe deplin înțeleasă. În rinichi, SLC26A6 poate interacționa cu alți transportori, cum ar fi NHE3, prin intermediul proteinelor de schelă PDZ (Ko și colab., 2002b; Gisler și colab., 2003; Lohi și colab., 2003). Cele două proteine pot funcționa împreună în rinichi pentru a menține homeostazia NaCl și transportul HCO3 (Gisler și colab., 2003). NHE3 importă Na + în schimbul protonilor. Odată ajuns în lumen, protonii reacționează cu HCO 3 -, ducând la afluxul de Cl - în celulele renale de către SLC26A6 (Knauf și colab., 2001; Schwartz, 2002; Wang și colab., 2002). Proteinele pentru schela PDZ pot permite acestor transportori să fie complexați fizic. Transportorii familiei SLC26 pot interacționa, de asemenea, cu CFTR prin motive PDZ (Ko și colab., 2004). Interacțiunea dintre transportorii SLC26 și CFTR va fi discutată în secțiunea V.D. .
- Alimentare restricționată - o prezentare generală a subiectelor ScienceDirect
- Prolactinom - o prezentare generală a subiectelor ScienceDirect
- Grăsimi mononesaturate - o prezentare generală Subiecte ScienceDirect
- Monocot - o prezentare generală Subiecte ScienceDirect
- Deficiența nutrițională - o prezentare generală a subiectelor ScienceDirect