Abstract
fundal
Pierderea în greutate este o caracteristică frecventă în boala neuronilor motori Scleroza laterală amiotrofică (SLA). În acest studiu am investigat posibile cauze ale pierderii în greutate în SLA, impactul acesteia asupra stării de spirit/calității vieții (QOL) și beneficiul suplimentelor alimentare bogate în calorii nutriționale/alte suplimente alimentare și a gastrostomiei endoscopice percutanate (PEG).
Metode
121 de pacienți cu SLA au fost intervievați și au răspuns la chestionare standardizate (inventarul depresiei Beck - II, chestionarul SF36 Health Survey, scara de evaluare funcțională a SLA revizuită). La doi ani de la sondajul inițial am efectuat un interviu de urmărire.
Rezultate
În cohorta noastră SLA, 56,3% dintre pacienți au suferit pierderi în greutate. Pierderea în greutate a avut un impact negativ asupra QOL și a fost asociată cu o supraviețuire mai scurtă. Pacienții care au luat suplimente nutritive bogate în calorii au avut, respectiv, un PEG, au declarat un mare beneficiu în ceea ce privește stabilizarea greutății și/sau QOL.
38,2% dintre pacienții noștri au avut o pierdere semnificativă în greutate fără a suferi de disfagie. Pentru a clarifica motivele pierderii în greutate la acești pacienți, le-am comparat cu pacienții fără pierderea în greutate. Cele două grupuri nu au diferit în ceea ce privește severitatea bolii, depresia, demența frontotemporală sau fasciculările, dar pacienții cu scădere în greutate au declarat mai des creșterea muncii respiratorii.
Concluzii
Pierderea în greutate este o problemă gravă în SLA și nu poate fi întotdeauna atribuită disfagiei. Tratamentul simptomatic al pierderii în greutate (suplimente nutritive bogate în calorii și/sau PEG) ar trebui oferit mai frecvent.
fundal
Scleroza laterală amiotrofică (SLA) este cea mai frecventă tulburare neurodegenerativă cu debut la adult a sistemului motor. Se caracterizează prin pierderea neuronilor motori superiori și inferiori în cortexul motor primar, trunchiul cerebral și măduva spinării. Paralizia rezultată este rapid progresivă și duce la deces din cauza insuficienței respiratorii în decurs de 2-5 ani [1]. Pierderea în greutate este un fenomen frecvent în SLA. Apare nu numai în asociere cu disfagia, ci și din motive care nu sunt încă pe deplin înțelese, specifice bolii. Ipotezele care explică pierderea în greutate în SLA includ risipă mai mare de energie din cauza fasciculărilor musculare, creșterea eforturilor respiratorii, hipermetabolism și scăderea aportului alimentar din cauza depresiei [2-4]. În orice caz, este bine cunoscut faptul că pierderea în greutate și un indice de masă corporală mai scăzut (IMC) sunt factori de prognostic negativi pentru supraviețuirea în SLA [5-8]. Dieta cu conținut ridicat de energie supraviețuiește prelungit la șoarecii transgenici ALS [9]. Cu toate acestea, administrarea de suplimente nutritive bogate în calorii sau gastrostomie endoscopică percutană (PEG) în caz de scădere în greutate nu este considerată suficient de devreme și suficient de frecventă.
În schimb, automedicația cu alte suplimente alimentare, numite și „nutriceutice” sau „alimente funcționale”, a devenit din ce în ce mai populară în rândul pacienților cu SLA și, conform literaturii, este utilizată de până la 80% dintre aceștia [7, 10]. Se presupune că suplimentele alimentare afectează diverse mecanisme care duc la moartea neuronilor motori sau ameliorează simptomele SLA, adesea bazate pe beneficii teoretice sau rapoarte anecdotice [7]. În mod frecvent se auto-prescriu, iar pacienții iau simultan mai multe suplimente alimentare.
Scopul prezentului studiu a fost de a investiga măsura pierderii în greutate în SLA și de a analiza impactul pierderii în greutate asupra dispoziției, calității vieții (QOL) și supraviețuirii pacienților cu SLA. În plus, ar trebui evaluate potențialele cauze care stau la baza pierderii în greutate dincolo de disfagie. Mai mult, am fost interesați de frecvența și beneficiile inserției PEG, a suplimentului bogat în calorii (de exemplu, shake-uri/băuturi cu densitate calorică) și a altor suplimente alimentare (de exemplu, vitamine, medicamente homeopate) la pacienții cu SLA.
Metode
La sondaj au participat 121 de pacienți SLA din ambulatoriul SLA de la Școala de Medicină din Hanovra. Studiul a fost aprobat de comitetul etic al Facultății de Medicină din Hanovra și toți subiecții au dat consimțământul informat pentru participare. Toți pacienții îndepliniseră criteriile revizuite El Escorial pentru SLA probabilă sau definitivă. Doar la un singur pacient, au fost prezente semne clinice subtile ale demenței frontotemporale (FTD). FTD a fost subreprezentată în populația noastră, deoarece acești pacienți sunt mai puțin motivați și mai puțin potriviți să participe la acest tip de studiu. Pacienții au completat trei chestionare standardizate (inventarul depresiei Beck - II (BDI), chestionarul SF-36 Health Survey (SF-36) și scala de evaluare funcțională ALS revizuită (ALS-FRS-R)) și au fost intervievați în continuare despre pierderea în greutate, disfagia, obiceiurile alimentare și aportul lor de suplimente alimentare. S-a documentat dacă pacienții au suferit fasciculări sau suferință respiratorie (da sau nu).
La doi ani de la ancheta inițială, 61,2% dintre pacienți sau rudele acestora erau disponibili pentru un scurt interviu telefonic de urmărire pentru a afla dacă pacientul era încă în viață și dacă pacientul mai folosea suplimente alimentare.
ALSFRS_R este un scor bine stabilit și utilizat pe scară largă pentru starea funcțională a pacienților cu SLA [11]. Se bazează pe 12 articole, fiecare evaluat pe o scară de 0-4 puncte. Rata dizabilității funcționale variază de la 0 (invaliditate maximă) la 48 de puncte (normale). Trei elemente din ALSFRS_R evaluează implicarea bulbară (vorbire, salivație, înghițire), care, prin urmare, poate fi evaluată de la 0 (implicare bulbară maximă) la 12 (fără implicare bulbară).
BDI este un inventar cu auto-raport cu alegeri multiple cu 21 de întrebări și un instrument utilizat în mod obișnuit pentru cuantificarea nivelurilor de depresie. Fiecare dintre cele 21 de elemente este notat pe o valoare a scării de la 0 (simptomul nu este prezent) la 3 (simptomul foarte intens) ducând la un interval general de 63. Limitele utilizate sunt 0-8: fără depresie, 9-13: minim depresie, 14-19: depresie ușoară, 20-28: depresie moderată, 29-63 depresie severă [12].
Chestionarul SF36 este un sondaj de sănătate multifuncțional, de formă scurtă, cu 36 de întrebări. Este un sistem de evaluare QOL autoadministrat care include opt scale independente: 1. funcționarea fizică (limitări în activitățile fizice), 2. Rolul fizic (limitări în activitățile obișnuite de rol din cauza problemelor de sănătate fizică), 3. Durerea corporală, 4. Percepție generală asupra sănătății, 5. Vitalitate (energie și oboseală), 6. funcționare socială (limitări în activitățile sociale din cauza problemelor fizice sau emoționale), 7. Rol emoțional (limitări în activitățile obișnuite de rol din cauza problemelor emoționale), 8. Sănătate mintală (stres psihologic și bunăstare) [13]. Chestionarul SF-36 este utilizat pe scară largă și adecvat la pacienții cu SLA [14].
Testele și chestionarele utilizate în acest studiu sunt rezumate pe scurt în Tabelul 1.
Pacienții au fost împărțiți în următoarele grupuri: „pierderea în greutate” (definită ca> 3 kg de la debutul bolii), din nou subdivizată în „pierderea în greutate fără/cu disfagie” și „lipsa pierderii în greutate” și, pentru al doilea aspect al studiului, „Cu aport suplimentar” și „fără aport suplimentar” (supliment definit aici ca suplimente alimentare (de exemplu, vitamine)). Grupurile nu au diferit în ceea ce privește sexul sau locul de debut. Severitatea bolii (ALSFRS_R), gradul depresiei (BDI) și calitatea vieții (SF36) au fost comparate între aceste grupuri de pacienți (compoziția grupului a se vedea tabelul 2) folosind teste t pentru probe independente. Pentru a identifica corelațiile dintre pierderea în greutate sau aportul de suplimente și QOL independent de severitatea bolii (ALSFRS-R) am efectuat analize de regresie multiplă (variabilă dependentă: SF-36, variabile predictive: ALSFRS-R și pierderea în greutate sau aportul suplimentar). Analizele statistice au fost efectuate utilizând software-ul SPSS V. 19 (SPSS, Chicago, IL), o valoare p a Tabelului 2 Compoziția grupului și caracteristicile pacienților cu sau fără aport alimentar/pierdere în greutate
Rezultate
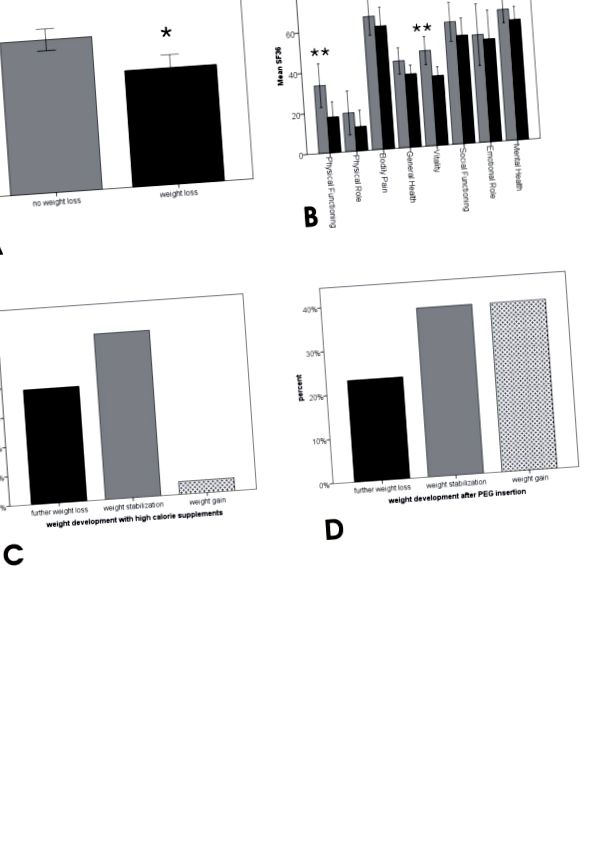
56,2% (n = 68) dintre pacienții din cohorta noastră au raportat pierderea în greutate. Pierderea în greutate a fost asociată cu un scor ALSFRS_R semnificativ mai slab și, de asemenea, cu o depresie mai mare (BDI, nesemnificativă) și scoruri QOL semnificativ mai mici (SF36) în ceea ce privește „funcționarea fizică” și „vitalitatea” subscalelor (Figura 1A și B). Analiza de regresie multiplă a identificat scorul ALSFRS_R ca un factor confuz, arătând că diferențele în BDI și „funcționarea fizică” au fost probabil cauzate de discrepanța în ALSFRS_R. Dar diferența de „vitalitate” a subscalei SF36 între pacienții cu și fără pierderea în greutate a rămas foarte semnificativă (Tabelul 3A), ceea ce înseamnă că pacienții cu pierderea în greutate se simt mai des epuizați, obosiți și lipsiți de spirit, indiferent de stadiul bolii. Analiza de regresie multiplă a arătat că această influență a pierderii în greutate asupra vitalității a fost independentă de suferința respiratorie, care a avut un efect semnificativ și asupra vitalității (Tabelul 3B).
33,8% (n = 23) dintre pacienții cu scădere în greutate au consumat suplimente calorice ridicate și 60,8% (n = 14) dintre aceștia au raportat stabilizarea greutății ulterioare sau chiar creșterea în greutate (Figura 1C). 25,5% (n = 13) dintre pacienții cu disfagie au suferit PEG; 76,9% (n = 10) dintre acești pacienți au declarat stabilizare în greutate sau creștere în greutate (Figura 1D) și 84,6% (n = 11) au declarat o îmbunătățire a QOL după inserția PEG. În mod remarcabil, niciun pacient nu a indicat deteriorarea QOL după inserția PEG (deși acest lucru este adesea suspectat de pacienți și rude înainte de procedură).
38,2% (n = 26) dintre pacienții cu scădere în greutate nu au suferit de disfagie (conform declarației auto-raportate și ALSFRS_R). Acest grup de pacienți nu a diferit de pacienții fără pierderea în greutate în ceea ce privește ALSFRS_R (total și bulbar) și depresie (BDI) și nici nu au raportat modificări ale obiceiurilor lor alimentare. Pe de altă parte, pacienții cu disfagie au prezentat scoruri ALSFRS_R semnificativ mai mici, în principal datorită subscorei bulbare (Figura 2A). Prevalența fasciculărilor la pacienții cu pierderea în greutate fără disfagie a fost egală cu pacienții fără pierderea în greutate. Cu toate acestea, au declarat mai des eforturile respiratorii crescute în comparație cu pacienții fără pierderea în greutate (Figura 2B).
Compararea pacienților cu scădere în greutate cu/fără disfagie și a pacienților fără scădere în greutate. Pacienții cu scădere în greutate și disfagie au diferit semnificativ de pacienții fără scădere în greutate în BDI și ALSFRS_R (total și bulbar). Pe de altă parte, pacienții cu pierderea în greutate fără disfagie nu au avut scoruri BDI mai mari/ALSFRS_R mai mici decât pacienții fără pierderea în greutate (A). Prin urmare, pierderea în greutate la pacienții fără disfagie nu pare să fie direct legată de un stadiu de boală mai avansat sau de o depresie crescută. Pacienții cu pierderea în greutate și disfagia au declarat în mod semnificativ mai frecvent o activitate respiratorie crescută decât pacienții fără pierderea în greutate. Pacienții cu scădere în greutate fără disfagie au prezentat o tendință spre creșterea muncii respiratorii comparativ cu pacienții fără scădere în greutate (p = 0,12). Nu au existat diferențe în ceea ce privește frecvența fasciculărilor între grupuri (B). Urmărirea telefonică la doi ani după ancheta inițială a evidențiat valoarea prognostică a pierderii în greutate: analiza de supraviețuire Kaplan-Meier pentru pacienții cu SLA cu și fără pierderea în greutate a relevat o supraviețuire semnificativ mai scurtă a pacienților cu SLA cu pierderea în greutate (log rank p = 0,001)C).
Sondajul telefonic după doi ani a arătat că pierderea în greutate a fost un factor de prognostic negativ puternic: curbele de supraviețuire Kaplan-Meier ale pacienților cu și fără pierderea în greutate au arătat o supraviețuire semnificativ mai scurtă a pacienților cu pierderea în greutate (log rank p = 0,001) (Figura 2C).
Discuţie
Proporția pacienților care au luat alte suplimente dietetice, nu bogate în calorii, cum ar fi vitaminele, a fost mai mică în cohorta noastră (cu 54,5%) decât în literatura de specialitate, în cazul în care procentul aportului de suplimente în rândul pacienților cu SLA este estimat la aproximativ 80% [7, 10]. ].
Diferențele observate în ceea ce privește severitatea bolii, depresia și QOL nu sunt cel mai probabil un efect direct al acestor suplimente alimentare diverse. Deși trebuie luat în considerare un anumit efect placebo, cea mai probabilă explicație este că pacienții care se auto-medicează cu suplimente alimentare reprezintă probabil un subgrup mai plin de speranță și optimism. Această presupunere este susținută de faptul că au avut scoruri SF36 mai mari de „funcționare socială”, adică s-au simțit mai puțin afectați de interacțiunile lor cu membrii familiei, prieteni și vecini. O viață socială mai activă ar fi putut oferi, de asemenea, stimulări crescute pentru a încerca abordări alternative de tratament. Întreruperea suplimentelor alimentare în timp (așa cum este dezvăluit de interviul nostru de urmărire de doi ani) este probabil rezultatul pierderii speranței, în general asociată cu progresia ulterioară a bolii.
Deși există o lipsă de dovezi pentru orice beneficiu relevant al suplimentelor alimentare, atât timp cât nu există o contraindicație clară și atâta timp cât nu au fost descoperite medicamente neuroprotectoare eficiente dincolo de riluzol, automedicația cu suplimente alimentare poate reprezenta speranță și încredere pentru unii pacienți și astfel au un impact pozitiv asupra evoluției bolii și calității vieții.
Concluzie
Semnificația prezentului studiu este limitată, deoarece este retrospectivă și se bazează pe date subiective de la pacienții înșiși. Cu toate acestea, oferă informații valoroase care pot fi utilizate ca punct de plecare pentru investigații prospective ulterioare.
Chiar dacă malnutriția este un factor de prognostic semnificativ și independent în supraviețuire, este adesea abordată în mod inadecvat în practica clinică. Conform rezultatelor noastre, efectul suplimentelor nutritive bogate în calorii și al PEG este adesea mai mare decât se aștepta. Prin urmare, pacienții, îngrijitorii și medicii trebuie încurajați să ia în considerare aceste măsuri. Cu toate acestea, beneficiile lor necesită în continuare confirmări suplimentare prin studii prospective.
Pentru a evalua motivele pierderii în greutate pe lângă disfagie, se va face o analiză prospectivă suplimentară a pacienților fără pierderea în greutate în comparație cu pacienții care suferă de pierderea în greutate care nu se pot atribui disfagiei, comparând parametrii clinici precum fasciculările, spasticitatea și anomaliile cognitive sau comportamentale, împreună cu REE și FVC. oferă cu siguranță o înțelegere mai aprofundată a acestui fenomen. În orice caz, existența acestor fenotipuri diferite evidențiază încă o dată eterogenitatea în prezentarea clinică a SLA.
În ceea ce privește suplimentele alimentare, sunt necesare studii suplimentare pentru a evalua siguranța și eficacitatea a numeroase suplimente alimentare și pentru a permite recomandări adecvate.
- Scăderea în greutate va deveni un tratament viitor al adenomului hepatocelular la pacienții obezi PubMed
- Tvc Produse pentru scăderea în greutate Supliment Keto Diet Scăderea în greutate Menopauză Exercițiu Bicicletă Slăbire
- Pierderea în greutate și dieta Patch Review; Suplimente transdermice patch-uri cu activ dovedit clinic
- Ecografia genunchiului la pacienții obezi cu osteoartrita genunchiului; Pierdere în greutate - Vizualizare text complet
- Băuturile de slăbit pot reduce considerabil aportul de calorii