Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Institutul Național de Știință și Tehnologie Industrială Avansată, Higashi 1-1-1, AIST Central 2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Departamentul de Chimie Moleculară Aplicată, Universitatea Nihon, Izumi-cho 1-2-1, Narashino, Chiba, 275-8575 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Institutul Național de Știință și Tehnologie Industrială Avansată, Higashi 1-1-1, AIST Central 2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Institutul Național de Știință și Tehnologie Industrială Avansată, Higashi 1-1-1, AIST Central 2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Departamentul de Chimie Moleculară Aplicată, Universitatea Nihon, Izumi-cho 1-2-1, Narashino, Chiba, 275-8575 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Institutul Național de Știință și Tehnologie Industrială Avansată, Higashi 1-1-1, AIST Central 2, Tsukuba, Ibaraki, 305-8565 Japonia
Baza de evaluare și cercetare a materialelor chimice (CEREBA), Higashi 1-1-1, AIST Central 5-2, Tsukuba, Ibaraki, 305-8565 Japonia
Abstract
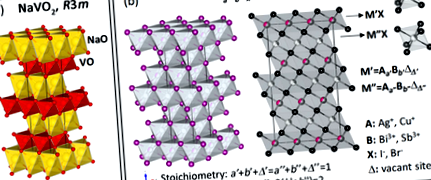
Structuri cristaline ale prototipului de oxid NaVO2 (a) și AABbXX halogenuri rudorffite (b).
Rudorfitele Ag-Bi-I și Cu-Bi-I au fost investigate în urmă cu câteva decenii ca potențiali conductori ionici, deși au demonstrat o conductivitate ionică destul de slabă a Ag și Cu chiar la temperaturi ridicate. Energia de activare a migrației Ag în rudorffita AgBiI4 a fost raportată a fi 0,4 eV, 21, care este similară cu energia de activare a migrării iodului de 0,44 eV în perovskitul CH3NH3PbI3. Mai multe diagrame de fază pseudo-binare publicate ale AgI-BiI3 demonstrează o discrepanță semnificativă în stoichiometria compușilor raportați și natura tranzițiilor lor de fază la topire. Fourcroy și colab. 22 au raportat doi compuși ternari: Ag2BiI5 și AgBi2I7, care ambii se topesc incongruent. În contrast, Dzeranova și colab. 23 au raportat doi compuși de topire congruenți Ag3BiI6 și AgBiI4. De asemenea, Oldag și colab. 21 a demonstrat formarea monocristalelor Ag3BiI6 și AgBiI4 printr-o metodă solvotermală. Mai târziu, Mashadeiva și colab. 24 au raportat topirea Ag2BiI5 în mod congruent și topirea incongruentă a compușilor AgBi2I7. În ceea ce privește sistemul Cu - Bi - I, Fourcroy și colab. 25 au raportat formarea a doi compuși Cu2BiI5 și CuBiI4 care se topesc incongruent.
Proprietățile PV ale rudorfitelor au rămas necunoscute până de curând. Am raportat performanța PV a celulelor solare rudorfitice Ag3BiI6 cu o eficiență de până la 4% în cererea noastră de brevet 26 în 2016. Apoi, Kim și colab. 27 și Zhu și colab. 28 de celule solare rudorffite raportate pe baza AgBi2I7 și Ag2BiI5 cu PCE de 1,22 și respectiv 2,1%.
Cu toate acestea, Kim și colab. 27 a descris rețeaua cristalină AgBi2I7 ca o combinație de octaedre [AgI6] și hexaedre [BiI8] conform structurii prototipului cubic ThZr2H7. Această descriere a fost destul de discutabilă datorită lungimii nefizic scurte a legăturilor Bi - I din hexahedra [BiI8]. Mai târziu, Xiao și colab. 29 au efectuat o investigație teoretică AgBi2I7 cu structura prototipului ThZr2H7, au constatat că este instabil din punct de vedere termodinamic și au propus Ag - deficit cubic Fd3m Structura AgBiI4 în schimb. Conform opiniei noastre, structura AgBi2I7 se bazează numai pe octaedre [AgI6] și [BiI6] și adoptă structura prototip a rudorffitei NaVO2 cu R3m simetrie. Spre deosebire de structura oxidului NaVO2 (Figura 1 a), în care ocuparea tuturor siturilor atât în cation, cât și în sublatisele anionice sunt egale cu 1, regula neutralității sarcinii a X=A+3 b pentru halogenura AABbXX rudorffitele (A: Ag, Cu; B: Bi, Sb; X: Br, I) dictează necesitatea ocupării parțiale în sublatisa cationică a acestora, care poate fi descrisă ca populații comune de monovalente (A: Ag, Cu), trivalente (B: Bi, Sb) și situri vacante neutre (Figura 1 b).
Putem găsi multe combinații ale numerelor de ocupare care îndeplinesc simultan aceste reguli și apoi, presupunând R3m simetria rețelei rudorffite, trasați dimensiunea celulelor unitare (exprimată în număr de situri cationice) față de compoziția sistemului (a se vedea Figura 2a) După cum putem vedea, materialele rudorffite care au fost raportate anterior, cum ar fi Ag3BiI6, Ag2BiI5, AgBiI4, AgBi2I7 au celulele unitare cele mai mici și, prin urmare, cele mai probabile termodinamic. Combinațiile de ocupări care corespund acestor compoziții sunt date în Tabelul 1. De exemplu, AgBiI4 are cea mai mică unitate celulară posibilă, care are doar 8 situri în subrețeaua cationică, inclusiv siturile vacante. Ușoare abateri de la compoziția nominală AgBiI4 fie la partea bogată în Ag, fie la partea Bi-bogată cresc semnificativ dimensiunea celulei unitare pentru a conserva neutralitatea de încărcare a rețelei. De asemenea, așa cum se arată în Figura 2 b, numărul de situri vacante din sublatisa cationică crește către compozițiile bogate în Bi.
Fiecare punct de pe grafic (a) reprezintă o posibilă structură rudorffită cu numere de ocupare în sublatisa cationică care satisface simultan regulile de neutralitate a sarcinii și stoichiometrie pentru un anumit R3m dimensiunea celulei unitare, în timp ce graficul (b) arată variația raportului siturilor vacante în sublatisa cationică în funcție de stoichiometrie.
- Laptele de cocos condensat îndulcit (o alternativă fără lactate) - Lotus savuros
- Membrană biopolimerică fără text complet, fără polimeri, îmbogățită cu chitosan și argint pentru ionii metalici
- SILVER Ear Thread Cercei picătură Bijuterii la modă C POST GRATUIT
- Club de energie organică pentru extractul de propolis de albine canadian organic (fără alcool)
- Organica Bee Propolis Liquid (fără alcool) 30 ML - Cu transport gratuit în Canada