Abstract
Mediul nostru nutrițional de viață timpurie poate influența mai multe aspecte ale fiziologiei, inclusiv tendința noastră de a deveni obezi. Există acum dovezi care sugerează că dieta perinatală poate influența și în mod independent dezvoltarea sistemului nostru imunitar înnăscut. Această revizuire va aborda trei mecanisme care nu sunt neapărat exclusive prin care nutriția perinatală poate programa funcția neuroimună pe termen lung: prin predispoziția individului la obezitate, prin modificarea microbiotei intestinale și prin inducerea modificărilor epigenetice care modifică transcripția genică pe tot parcursul vieții.
Influența alimentară perinatală asupra dezvoltării sistemului imunitar
Sistemul imunitar al unui nou-născut este relativ naiv și sunt necesare influențe din mediu pentru a-i permite să devină pe deplin funcțional. Expunerea timpurie la agenți patogeni dezvoltă o imunitate adaptivă (Flajnik și Kasahara, 2010) și înnăscută (Galic și colab., 2009; Spencer și colab., 2011) care va facilita răspunsurile adecvate la agenți patogeni suplimentari de-a lungul vieții. Cu toate acestea, există acum dovezi că dieta timpurie a vieții este, de asemenea, crucială în programarea funcției imune pe termen lung.
Nutrienții specifici din dieta perinatală influențează dezvoltarea sistemului imunitar
Dieta perinatală influențează dezvoltarea sistemului imunitar prin microbiota intestinală
Un mecanism prin care substanțele nutritive specifice din dieta vieții timpurii pot influența sistemul imunitar al adulților este prin afectarea dezvoltării, diversității și funcției microbiotei intestinale. La om, tractul gastro-intestinal găzduiește mai mult de 100 de miliarde de bacterii, compuse din peste 1000 de specii (Qin și colab., 2010). De asemenea, găzduiește numeroși viruși, arhee, paraziți și ciuperci care formează împreună microbiota intestinală (Ashida și colab., 2012). Această microbiotă există într-o relație simbiotică cu gazdele sale umane și poate influența funcția de barieră, efectele trofice, metabolismul și dezvoltarea sistemului imunitar adaptativ și înnăscut (Matamoros și colab., 2013).
Microbiomul intestinal al unui adult poate fi influențat de schimbările pe termen lung ale factorilor de mediu. Hildebrandt și colegii săi au demonstrat că 3 luni de dietă bogată în grăsimi (HFD) - hrănirea poate influența o schimbare a compoziției microbiotei intestinale către o creștere a Firmicutes și Proteobacteria și o scădere a filelor Bacteroidetes la șoarecii femele (Hildebrandt și colab., 2009). Deși aceste modificări au fost independente de obezitate, alte grupuri au demonstrat o dietă bogată în grăsimi, cu un conținut ridicat de zahăr, încurajează adipozitatea crescută și acest fenotip poate fi transmis animalelor slabe inițial (dietă normală) prin transplantul microbiotei (Turnbaugh și colab., 2008). Cu toate acestea, majoritatea dovezilor sugerează că flora intestinală a adulților este foarte stabilă, iar influențele de mediu pe termen scurt la vârsta adultă au un efect limitat (Wu și colab., 2011). Un copil, pe de altă parte, nu se naște cu un microbiom intestinal stabilit. Mai degrabă, intestinul este colonizat din bacterii din mediu în primele ore până în zilele de viață, iar microbiomul câștigă diversitate și devine stabil și asemănător adulților până la vârsta de aproximativ 3 ani (Mackie și colab., 1999; Palmer și colab., 2007). În special, dieta unui individ în timpul fazei timpurii de colonizare poate fi extrem de importantă în determinarea compoziției ulterioare a microbiotei intestinale.
Dieta perinatală influențează dezvoltarea sistemului imunitar prin modificări epigenetice
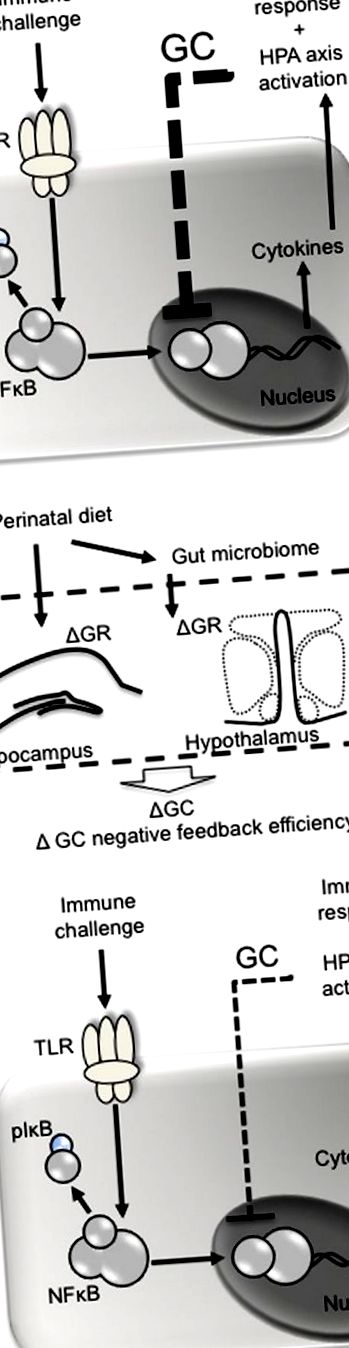
Dieta perinatală poate influența reacția negativă a glucocorticoizilor în urma provocării imune. (A) Agenții patogeni precum lipopolizaharida acționează la receptorii asemănători (de exemplu, TLR4) asupra celulelor imune ducând la fosforilarea factorului inhibitor (I) κ B, eliberând factorul nuclear (NF) κ B din complexul său și permițându-i să fie translocați către nucleu . NKκ B este responsabil pentru transcrierea citokinelor pro- și antiinflamatoare, dintre care primele stimulează conversia mediată de ciclo-oxigenază 2 a acidului aracidonic în prostaglandine. Prostaglandinele (de exemplu, PGE2) acționează la nivelul creierului pentru a stimula comportamentul de febră și boală și de a recruta axa HPA. Odată eliberat, glucocorticoizii (GC) se hrănesc negativ pentru a inhiba transcrierea ulterioară a citokinelor mediată de NFκ B. (B) Dieta perinatală poate influența feedback-ul negativ al glucocorticoizilor prin modificarea expresiei receptorilor glucocorticoizi (GR) în hipocamp și hipotalamus, ducând la o inhibare mai puțin eficientă a NFκ B mediată de glucocorticoizi și un răspuns imun exacerbat.
Influența alimentară perinatală asupra adipozității - legături cu dezvoltarea sistemului imunitar
Factorii dietetici din viața timpurie au în mod clar o influență crucială asupra dezvoltării sistemului imunitar. A doua jumătate a acestei revizuiri se va concentra asupra modului în care nutriția timpurie a vieții poate programa un profil imun bazal pro-inflamator prin predispoziția unui individ la un fenotip obez.
Obezitatea devine o problemă uriașă la nivel mondial. În țările dezvoltate, cum ar fi Australia și SUA, 70-74% dintre bărbații adulți și 56-64% dintre femeile adulte sunt acum supraponderali sau obezi, cu 28% dintre ambii clasificați ca obezi (IMC> 30). Până la 25-32% dintre copiii australieni și americani sunt clasificați ca supraponderali sau obezi (Cretikos și colab., 2008; Nhanes, 2009-2010; AHS, 2011-2012).
Nutriția perinatală poate programa greutatea și metabolismul adulților, ducând la modificări ale funcției imune dependente de grăsime
Obezitatea însăși, fie datorită modificărilor metabolice programate în viața timpurie, fie a factorilor adulți, este legată de modificările profilului inflamator. Se recunoaște acum că obezitatea este asociată cu și poate fi chiar precipitată de o inflamație cronică sistemică și locală de grad scăzut (Gregor și Hotamisligil, 2011). Această inflamație metabolică poate contribui la rezistența la insulină și leptină la diferite niveluri, inclusiv la nivelul hipotalamusului (Thaler și Schwartz, 2010).
Factorii dietetici, cum ar fi PUFA și glucoza, precum și modificările microbiotei intestinale, sunt capabili să declanșeze un profil inflamator cronic de grad scăzut inițial în țesutul adipos alb (WAT). Această modificare se caracterizează prin infiltrarea macrofagelor în WAT, apoptoza și necroza adipocitelor și vascularizația redusă (Shu și colab., 2012). Aceste modificări au ca rezultat o preponderență anormală a macrofagelor țesutului adipos și acestea pot constitui aproape 40% din celulele din țesutul adipos obez (Weisberg și colab., 2003; Xu și colab., 2003). Macrofagele țesutului adipos și, potențial, o creștere a receptorilor de recunoaștere a tiparelor asupra adipocitelor în sine, conduc la inflamații locale, cu o predominanță a citokinelor proinflamatorii asupra antiinflamatoare eliberate (Shu și colab., 2012). Hotamisligil și colegii săi au arătat încă de la început că există o creștere substanțială a expresiei factorului de necroză tumorală pro-inflamatorie citokină (TNF) α în mai multe modele de rozătoare ale obezității și că neutralizarea TNFα ar putea îmbunătăți sensibilitatea la insulină la aceste animale, Hotamisligil și colab., 1993, 1995; Uysal și colab., 1997). Profilul pro-inflamator din adipos duce la eliberarea de citokine, adipokine și acizi grași în circulație, care au efecte în aval asupra ficatului, mușchilor și creierului și contribuie în cele din urmă la rezistența la insulină (Shu și colab., 2012).
Ca urmare a acestor modificări ale profilului inflamator, subiecții obezi au compromis funcția imunitară și sunt mai predispuși să moară din cauza unei infecții acute decât cei cu greutate normală (Falagas și Kompoti, 2006). De exemplu, creșterea excesivă a greutății corporale predispune imediat postnatal la sugari la tulburări de atopie și respirație șuierătoare (Pike și colab., 2010). Pacienții obezi în general sunt, de asemenea, de două ori mai predispuși să moară în terapie intensivă din cauza complicațiilor legate de infecție decât pacienții cu greutate normală (Falagas și Kompoti, 2006).
Este clar de ceva timp că nutriția timpurie a vieții este capabilă să programeze creșterea și poate influența dezvoltarea căilor centrale care servesc hrănirea și metabolismul (Spencer, 2012). Bebelușii născuți din mame supraponderale sau obeze sunt semnificativ mai predispuși să devină ei înșiși supraponderali sau obezi (Dabelea și colab., 2000; Ruager-Martin și colab., 2010), iar copiii născuți din mame care au consumat o dietă bogată în grăsimi, junk food în timp ce gravidele au niveluri mai ridicate de grăsime corporală la naștere, indiferent dacă mamele erau sau nu obeze în timpul sarcinii (Albuquerque și colab., 2006; Srinivasan și colab., 2006; Ashino și colab., 2012). Asociați cu acest exces de grăsime corporală sunt indicii sindromului metabolic, cum ar fi hiperinsulinemia și rezistența la insulină (Dabelea și colab., 2000; Boney și colab., 2005; Sewell și colab., 2006; Catalano și colab., 2009).
Paradoxal, bebelușii care au fost subnutriți în uter sunt, de asemenea, mai susceptibili de a dezvolta obezitate și tulburări metabolice asociate (Spencer, 2012). Într-o primă instanță, factorii in utero care determină nașterea copilului mic pot, de asemenea, să-și modifice căile metabolice pentru a încuraja stocarea energiei atunci când alimentele sunt disponibile (Vickers și colab., 2000, 2003; Bellinger și colab., 2004; Bellinger și Langley -Evans, 2005). În al doilea rând, practica preferată cu copii mici pentru vârsta gestațională este un program de hrănire intensivă pentru a încuraja dezvoltarea adecvată a creierului și a plămânilor (Lubchenco și colab., 1972a, b; Brandt și colab., 2003) și acest lucru recuperează creșterea și în perioada postnatală predispune un individ la obezitate (Ong și colab., 2000, 2006; Brandt și colab., 2003; Desai și colab., 2005).
Importanța acestor descoperiri se reflectă în statisticile care arată că copiii supraponderali sunt semnificativ mai susceptibili de a fi adulți supraponderali decât cei cu greutate normală. După cum sa menționat, creșterea excesivă în greutate în prima săptămână de viață crește riscul de obezitate pe termen lung (Stettler și colab., 2005). Mai mult, comparativ cu copiii cu un IMC sub percentila 50, copiii între percentila 50 și 74 de IMC au aproximativ cinci ori mai multe șanse să devină adulți supraponderali (Baird și colab., 2005; Field și colab., 2005; Druet și colab. ., 2012).
Nutriția perinatală poate programa modificări ale funcției imune care sunt independente de adipozitate
Putem concluziona din aceste studii că există o legătură evidentă între evenimentele din viața timpurie care programează o înclinație crescută spre obezitate și obezitatea însăși, rezultând un profil proinflamator bazal și susceptibilitate la infecție. Cu toate acestea, este de asemenea evident că supraponderalitatea la începutul vieții poate avea efecte independente și agravante asupra profilului inflamator la vârsta adultă.
Dovezi interesante pentru efectele pe termen lung ale dietei timpurii asupra sistemului imunitar la adulți provin de la indivizi care au fost subnutriți în uter sau ca sugari și nu au dezvoltat obezitate. Astfel, un studiu realizat pe trei sate rurale din Gambia a arătat că subiecții au fost mult mai predispuși să moară de boli infecțioase la vârsta adultă dacă s-au născut în timpul sezonului „flămând” debilitant din punct de vedere nutrițional din iulie - decembrie decât în perioada ianuarie - iunie când alimentele erau abundente ( Moore și colab., 1999). S-a demonstrat că o dietă perinatală cu restricții calorice influențează activarea macrofagelor la vârsta adultă, astfel încât șobolanii adulți subnutriți în timpul alăptării au avut mai puține macrofage alveolare și aceștia au eliberat mai puțin oxid nitric ca răspuns la o provocare cu fluoxetină (Ferreira și colab., 2009). În mod similar, șobolanii adulți subnutriți în timpul alăptării nu au prezentat nicio modificare a parametrilor imuni după o provocare imună, fie în condiții de control, fie după ce au fost supuși șocului la picioare, în timp ce șobolanii de control (dieta normală în timpul alăptării) au avut un număr crescut de leucocite și titruri de anticorpi (Barreto-Medeiros și colab. ., 2007). Aceste date sugerează că malnutriția neonatală poate duce la un răspuns imun mai puțin reactiv sau mai puțin eficient.
Există, de asemenea, unele dovezi că animalele obezizate ca urmare a dietei perinatale pot avea modificări ale funcției neuroimune în viața ulterioară, care sunt independente de obezitatea în sine. Mai multe grupuri au prezentat acum șobolani alăptați în puieturi mici, unde au acces mai mare la laptele barajului, se îngrașă mai repede și mențin o greutate corporală mai mare până la maturitate (Plagemann și colab., 1999; Schmidt și colab., 2001; Morris și colab ., 2005; Rodel și colab., 2008). Am arătat că aceste șobolani supraponderali, atât masculi, cât și femele, au un răspuns neuroimun semnificativ exacerbat la LPS. Acest răspuns este clasificat prin activarea NFκ B exacerbată la șobolanii supraponderali, citokine pro-inflamatorii mai circulante și febrele mai mari (Clarke și colab., 2012).
Foarte important, există unele diferențe fundamentale între modificările funcției neuroimune la șobolanii supraponderali din cauza supraalimentării timpurii a vieții și cei la șobolanii supraponderali din cauza hrănirii HFD la vârsta adultă. În primul rând, șobolanii supraalimentați neonatal nu au un profil de inflamație bazală. Nu există diferențe în concentrațiile bazale de citokine pro-inflamatorii circulante între cele alăptate în litiere mici (supraponderale) și cele alăptate în litiere de control (Clarke și colab., 2012). După cum sa discutat mai sus, mai multe studii au arătat că subiecții obezi la om (Hak și colab., 1999; Yudkin și colab., 1999) și la rozătoare (Hotamisligil și colab., 1993) au niveluri mai ridicate de citokine pro-inflamatorii circulante în condiții nestimulate, reflectând un profil pro-inflamator. Această diferență poate fi rezultatul gradului de obezitate, al compoziției dietetice și/sau al faptului că supraalimentarea perinatală este capabilă să conducă sistemul pentru a afișa un răspuns prea activ la provocarea imunitară fără a afecta profilul inflamator bazal (Pohl și colab., 2009).
Ca și în cazul TLR4, există o expresie TLR3 crescută în țesutul adipos de șobolan supraalimentat neonatal (Clarke și colab., 2012). Cu toate acestea, spre deosebire de oamenii cu obezitate la debutul adulților (MMWR, 2009; Fuhrman și colab., 2011) și rozătoarele adulte alimentate cu HFD (Smith și colab., 2007), răspunsul imun la un ligand TLR3 nu este modificat la șobolanii fabricați obezi din cauza supraalimentării neonatale (Clarke și colab., 2012). O posibilă explicație pentru efectele diferențiale asupra semnalizării TLR4 și TLR3 se află în locația receptorului, TLR4 fiind legat de membrană și TLR3 internalizat (Kumar și colab., 2009; Konner și Bruning, 2011). Astfel, deși obezitatea în general poate crește expresia TLR3, obezitatea indusă perinatal nu poate provoca modificări corespunzătoare în transportul ligandului în celulă. Pentru pacient, acest lucru poate însemna că programarea timpurie a obezității poate fi asociată cu o formă de protecție împotriva unei infecții virale în comparație cu obezitatea la debutul adulților.
Hrana excesivă perinatală, spre deosebire de obezitatea la debutul adulților, poate, de asemenea, să exacerbeze răspunsurile imune independent de comportamentul bolii. În general, un răspuns imun provoacă o varietate de comportamente de boală, pe lângă schimbările pro-inflamatorii și febrile. Acestea includ anorexia, letargia, depresia, activitatea redusă, pierderea libidoului (Dantzer și Kelley, 2007). Deși există o expresie tipică a comportamentului de boală cu LPS la șobolanii supraalimentați perinatal, acest lucru nu este exacerbat la aceste animale, deoarece răspunsurile pro-inflamatorii și febrile sunt (Clarke și colab., 2012). În schimb, obezitatea la debutul adulților este puternic asociată cu o creștere a comportamentului de boală față de adulții slabi (Lawrence și colab., 2012). Este posibil ca mai multe aspecte ale comportamentului de boală să fie mediate central. De exemplu, leptina este un modulator semnificativ al anorexiei asociate cu infecția (Luheshi și colab., 1999), iar tratamentul cu leptină antiseric poate inversa anorexia indusă de LPS (Sachot și colab., 2004; Harden și colab., 2006) . Răspunsurile la leptină la LPS sunt similare la sobolanii supraalimentați neonatal și la șobolanii de control, în ciuda diferențelor pronunțate în alte citokine, facilitând potențial răspunsuri similare la boală (Clarke și colab., 2012).
Încă nu este clar ce ar însemna pentru un subiect această absență a unui răspuns bolnav exacerbat după supraalimentarea perinatală. Pe de o parte, este posibil ca subiectul să fie rezistent la senzația de boală asociată cu o provocare imunitară, în ciuda faptului că a exacerbat răspunsul proinflamator și febril, permițându-le să-și continue viața în mod normal atunci când este bolnav. Pe de altă parte, comportamentul bolii este foarte important în promovarea retragerii, astfel încât resursele organismului sunt pe deplin disponibile pentru a combate eficient infecția (Carlton și colab., 2012).
Axul hipotalamo-hipofizo-suprarenal
Dimorfism sexual în programarea nutrițională perinatală a funcției imune
Rezumat și perspective de viitor
Mulțumiri și surse de finanțare
Această lucrare a fost susținută de un grant Discovery Project acordat de Consiliul australian de cercetare (ARC) către Sarah J. Spencer (DP109339) și un proiect acordat de Consiliul Național de Sănătate și Cercetare Medicală (NHMRC) către Dr. Zane Andrews și Sarah J. Spencer (APP1011274). Sarah J. Spencer este membru al ARC Future Fellow (FT110100084) și membru al cercetării universitare RMIT Senior VC.
Declarație privind conflictul de interese
Autorul declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi construite ca un potențial conflict de interese.
- Nutriția în evaluarea ciclului de viață al alimentelor - funcție sau impact SpringerLink
- Prezentare generală a programelor nutriționale - Centrul național de drept agricol
- Programe de nutriție în comunitate
- Programe de nutriție
- Programele naționale de nutriție, sănătate publică Foame și sănătate